田蓟苷对缺氧/复氧损伤大鼠心肌细胞H9c2 的影响
2021-03-21李海宁都研文杨洁热孜亚木吾甫尔于宁邢建国
李海宁,都研文,杨洁,热孜亚木.吾甫尔,于宁,邢建国
1.石河子大学,新疆 石河子 832000;2.新疆维吾尔自治区药物研究所,新疆 乌鲁木齐 830004;3.新疆医科大学,新疆 乌鲁木齐 830011
缺血性心脏病是临床常见的高死亡和高致残性疾病,近年来,随着临床预防的普及,以及介入、冠状动脉旁路移植术等治疗手段的发展,患者生存率有一定程度的提高,但随之而来的心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)引起患者心功能的较大损害。研究显示,再灌注引起的致死性损伤占心肌梗死面积的30%,目前针对MIRI心肌病尚无特效药[1-2]。香青兰Drococephalum moldivacaL.是新疆维吾尔族习用药食两用植物,主要用于治疗冠心病和高血压,其具有促进血液循环、改善心脏功能、治疗心肌缺血作用。田蓟苷(Tilianin)是从香青兰中提取的一种天然活性成分,属黄酮类化合物。前期研究表明,田蓟苷是抗MIRI 的主要活性物质,与普萘洛尔比较,较小剂量田蓟苷即具有同等作用,可降低心电图ST 段抬高幅度,改善心肌细胞肿胀、坏死、中性粒细胞浸润等病理现象[3-7],但其作用机制还未完全阐明。肝X 受体α(LXR-α)是核受体家族具有抗MIRI 作用的LXR 亚型,是一种新的内源性保护因子,上调LXR-α 可增加促细胞存活的Akt 磷酸化、抑制促细胞凋亡的p38MAPK磷酸化,抑制细胞凋亡,缓解MIRI[8-14]。本实验以田蓟苷为研究对象,以H9c2 细胞缺氧/复氧(hypoxia/reoxygenation,H/R)损伤为模型,从LXR-α 相关通路观察田蓟苷对心肌细胞的影响,探讨其体外抗MIRI 作用机制。
1 材料与方法
1.1 药物和细胞株
田蓟苷,新疆维吾尔自治区药物研究所,纯度98%,批号20171012。大鼠心肌细胞H9c2,中国科学院上海细胞库。
1.2 主要试剂与仪器
低糖DMEM 培养基(美国Hyclone 公司,货号SH30021.01),胰蛋白酶(美国Hyclone 公司,货号SH30042.01),无糖DMEM 培养基(美国Gibco 公司,货号11966-025),胎牛血清(美国Gibco 公司,货号10099-141),厌氧安宁包(日本MGC 公司,货号C-1),CCK-8 试剂盒(博士德生物工程有限公司,货号AR1160),活性氧(ROS)检测试剂盒(北京索莱宝科技有限公司,货号CA1410),线粒体膜电位(JC-1)试剂盒(北京索莱宝科技有限公司,货号M8650),Annexin V-FITC/PI 凋亡检测试剂盒(美国BD 公司,货号556547),LXR-α(英国Abcam 公司,货号ab176323),p-p38MAPK(美国CST 公司,货号8690S,4511S),Akt、p-Akt(美国CST 公司,货号4691S、13038S),Bax(美国CST 公司,货号2772S),Bcl-2(英国Abcam 公司,货号ab59348),Caspase-3(美国CST 公司,货号9662S),GAPDH、HRP 标记山羊抗兔IgG、HRP 标记山羊抗大鼠IgG(北京中杉金桥公司,货号分别为TA-08、ZB-2301、ZB-2305)。电泳、转膜试剂(武汉博士德生物工程有限公司),ECL发光液(美国Millipore,货号WBKLS0100),EVOS FLoid 倒置荧光显微镜(Thermo Fisher 公司),多功能酶标仪(美国BioTek 公司),FACS Aria 型流式细胞仪(美国BD 公司),转移电泳仪槽(美国Bio-Rad公司),垂直电泳槽(美国Bio-Rad 公司),Allegra 64R冷冻高速离心机(美国Beckman 公司)。
1.3 细胞培养与分组
H9c2 细胞用含10%胎牛血清DMEM 低糖培养基,37 ℃、5%CO2培养,取对数生长期细胞进行实验。实验随机分为对照组、模型组和田蓟苷低、中、高剂量(5、10、20 μg/mL)组。
1.4 缺氧/复氧细胞模型建立
参照文献[15-17]方法操作,细胞用田蓟苷预处理3 h,换液为无糖无血清DMEM 培养基,置于放有厌氧安宁包的密封盒,缺氧6 h,弃去旧培养基,加含10%胎牛血清DMEM 低糖培养基,37 ℃、5%CO2培养进行复氧处理,复氧3 h,建立H/R 细胞模型。
1.5 细胞形态观察
取对数生长期细胞,以1×105个/mL 接种于6 孔板,每孔2 mL,培养24 h,弃去培养液,PBS 冲洗2 次,4%多聚甲醛固定20 min,镜下观察细胞形态。
1.6 细胞活力检测
取对数生长期细胞,以1×105个/mL 接种于96孔板,每孔100 μL,每组设6 个复孔,按照CCK-8检测试剂盒说明书测定细胞活力,于酶标仪波长450 nm 处检测各孔吸光度(OD 值),在不含细胞培养液中加入等量CCK-8 溶液,按相同方法测定吸光度作为对照,计算细胞存活率。细胞存活率(%)=(实验孔OD 值-空白孔OD 值)÷(对照孔OD 值-空白孔OD 值)×100%。
1.7 细胞凋亡检测
取对数生长期细胞,以1×105个/mL 接种于6 孔板,弃去上清液,PBS 洗2 次,加250 μL 胰蛋白酶消化100 s,每孔加1 mL 含血清培养液终止消化,1000 r/min 离心5 min,PBS 洗2 次,离心,收集细胞,用400 μL Annexin V-Binding Buffer 重悬细胞,按照Annexin V-FITC/PI 细胞凋亡检测试剂盒说明书操作,利用流式细胞仪检测细胞凋亡率。
1.8 活性氧检测细胞内
细胞处理同“1.7”项下方法,收集细胞,分别加入10μmol/L DCFH-DA工作液1mL,37℃避光孵育30min,弃去工作液,用不含胎牛血清的细胞培养液清洗3次,500 μL培养基重悬细胞,设置阴性和阳性对照,经流式检测细胞释放ROS 百分比。
1.9 细胞线粒体膜电位检测
细胞处理同“1.7”项下方法,收集细胞,每组加0.5mL 配制好的JC-1染色工作液,混匀后置于培养箱孵育20 min,1000 r/min离心3 min,并用配制好的JC-1染色缓冲液反复重悬洗涤细胞3次,除去未结合的多余染色液。再加入0.4mL JC-1染色缓冲液重悬细胞,过300目筛,经流式检测线粒体膜电位(MMP)变化,以红绿荧光之比判断MMP水平。
1.10 Westernblot 检测蛋白表达
H9c2细胞按“1.4”项下方法处理,冰上完成蛋白提取,裂解液按比例加蛋白酶、磷酸酶抑制剂。蛋白样品经BCA 法测定浓度,按比例加入蛋白上样缓冲液,金属浴95℃、5min变性。经SDS-双丙烯酰胺凝胶电泳后电转至PVDF膜。含5%脱脂牛奶TBST溶液封闭,加一抗LXR-α、p-p38MAPK、p-Akt、Akt、Bax、Bcl-2(1∶1000),4℃孵育过夜,次日用TBST摇洗3次×10 min,加HRP标记二抗(1∶2000),室温孵育2h,TBST 洗涤3次×10 min,ECL 成像系统采集图像,ImageJ 软件分析条带灰度值。
1.11 统计学方法
采用SPSS22.0统计软件进行分析。实验数据以表示,多组间比较采用方差分析,非配对t检验进行两组间比较,Bonferroni法进行校正。P<0.05表示差异有统计学意义。
2 结果
2.1 田蓟苷对缺氧/复氧损伤H9c2细胞形态的影响
对照组细胞数较多,形态完整,呈完整梭形,单层簇状生长;模型组细胞核皱缩,细胞变圆,漂浮于培养基上;田蓟苷各剂量组细胞形态有不同程度改善,其中田蓟苷中、高剂量组细胞密度略增加。见图1。

图1 各组H9c2细胞形态(标尺=100μm)
2.2 田蓟苷对缺氧/复氧损伤H9c2细胞活力的影响
与对照组比较,模型组细胞存活率明显降低(P<0.05);与模型组比较,田蓟苷各剂量组H9c2细胞存活率明显升高(P<0.05),田蓟苷高剂量组升高最明显。结果见图2。
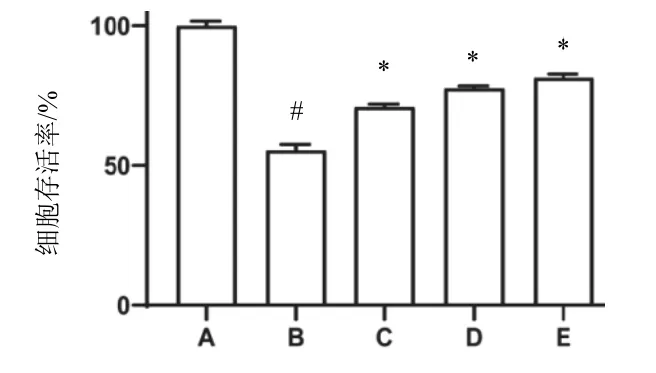
图2 各组H9c2细胞存活率比较(,n=3)
2.3 田蓟苷对缺氧/复氧损伤H9c2细胞凋亡的影响
与对照组比较,模型组细胞凋亡率显著升高(P<0.05);与模型组比较,田蓟苷中、高剂量组H9c2细胞凋亡率明显降低(P<0.05),田蓟苷高剂量组降低最明显。结果见图3。

图3 各组H9c2 细胞凋亡率比较(,n=3)
2.4 田蓟苷对缺氧/复氧损伤H9c2细胞活性氧水平的影响
与对照组比较,模型组ROS含量明显增加(P<0.05);与模型组比较,田蓟苷各剂量组H9c2细胞ROS 含量明显降低(P<0.05)。结果见图4。

图4 各组H9c2细胞ROS含量比较(,n=3)
2.5 田蓟苷对缺氧/复氧损伤H9c2细胞线粒体膜电位的影响
红色荧光JC-1 聚合物从线粒体基质释放到胞浆,呈单体状态,显示绿色荧光,红绿荧光之比降低,即MMP 明显降低。与模型组比较,田蓟苷各剂量组H9c2细胞红绿荧光之比明显升高(P<0.05),田蓟苷高剂量组H9c2细胞MMP升高最明显。结果见图5。
2.6 田蓟苷达的影响对缺氧/复氧损伤H9c2细胞相关蛋白表
与对照组比较,模型组H9c2细胞LXR-α、p-Akt、Bcl-2蛋白表达明显降低,p-p38MAPK、Bax、Caspase-3蛋白表达明显升高(P<0.05);与模型组比较,田蓟苷中、高剂量组H9c2细胞LXR-α、p-Akt、Bcl-2蛋白表达明显升高,p-p38MAPK、Bax、Caspase-3蛋白表达明显降低(P<0.05)。结果见图6。

图5 各组H9c2细胞MMP 水平比较(,n=3)
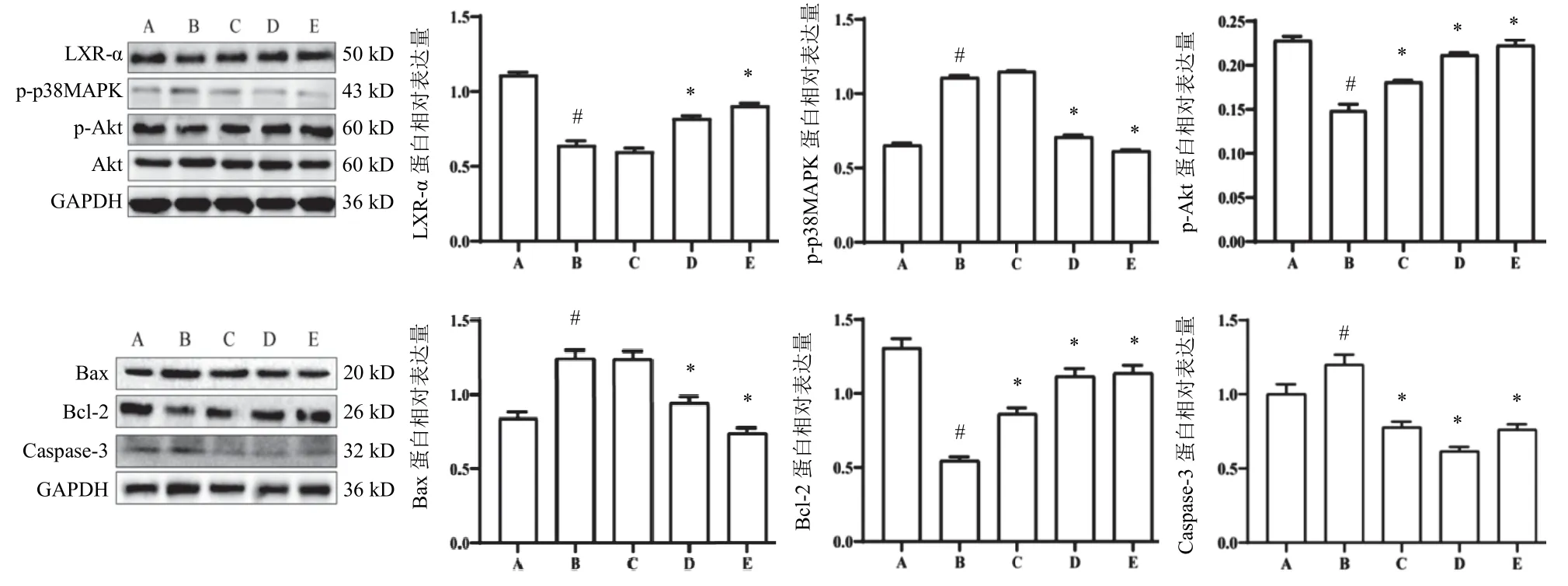
图6 各组H9c2细胞LXR-α、p-p38MAPK、p-Akt、Bax、Bcl-2、Caspase-3 蛋白表达比较(,n=3)
3 讨论
缺血再灌注损伤主要是氧供应的恢复和ROS爆发,氧化应激造成细胞结构损伤和线粒体功能代谢障碍,进而引起凋亡[18]。其病理变化是MIRI发病机制中的重要环节。因此,寻找可同时减少氧化损伤和MIRI诱导细胞凋亡的有效靶点及物是挽救受损心肌细胞的关键策略。
LXRs是机体抗MIRI 的重要防御因子。在心血管系统中LXR-α 对心肌缺血、动脉粥样硬化和心肌肥厚等病理生理过程均具有调控作用。研究显示,LXRs激动剂GW3695可减轻大鼠脑缺血/再灌注损伤[19],Akt 在细胞存活和凋亡中起重要作用,MAPK通路是转导胞外信号至胞内效应的重要级联通路,LXR-α 可通过激活PI3K/Akt/eNOS途径改善内皮祖细胞功能及血管损伤后的内皮再生和修复[20],白僵菌素抑制cAMP-PKA-CREB 信号传导并上调LXR-α 的表达,从而抑制p38MAPK[21]。此外,H/R 处理后,氧化应激状态被认为是启动细胞损伤的主要因素[22]。
基于以上机制,本研究采用体外培养大鼠心肌细胞H9c2,通过糖氧剥夺再复糖复氧建立H/R 模型。结果显示,模型组细胞ROS 含量高于对照组,表明建模成功。给予田蓟苷干预后,发现给药组细胞活力显著提升,ROS 含量减少,MMP 升高,同时细胞凋亡率降低,且呈剂量依赖性,表明田蓟苷对H/R 诱导H9c2 细胞具有显著的保护作用。本实验结果显示,田蓟苷可外源性激活LXR-α 蛋白,继而使Akt 磷酸化并抑制p-p38MAPK 及其通路下游Bax 的表达降低ROS 含量,提高MMP 并抑制心肌细胞凋亡。
综上,田蓟苷可能通过激活LXR-α/Akt 通路,调节p-p38MAPK 凋亡通路蛋白而发挥抑制线粒体介导的内源性细胞凋亡程序,保护心肌细胞。考虑到心肌H/R 损伤机制较为复杂,田蓟苷对LXR-α 及凋亡通路p-p38MAPK/p-Akt 上下游影响的具体机制尚不完全明确,今后将进一步深入研究。
