超声内镜和腹部CT在胃间质瘤诊断及内镜下黏膜剥离术相关并发症预测方面的应用
2021-03-21夏素芹陈若余李莉费素娟赵燕超孟闫凯阚倩
夏素芹,陈若余,李莉,费素娟,赵燕超,孟闫凯,阚倩
胃肠道间质瘤(gastrointestinal stromal tumors,GISTs)起源于Cajal细胞,在胃肠道间叶肿瘤中占比70%[1],在所有胃肠道恶性肿瘤中占比1%~3%[2],以胃间质瘤(gastric stromal tumors,GSTs)最常见,约占50%~60%[3]。确诊GSTs依赖病理组织学检查与免疫组织化学染色,免疫组化多表达CD117和DOG1阳性,大多数瘤体CD34表达阳性,同时显示Cajal细胞分化。GSTs生物学行为不定,且与肿瘤危险度分级密切相关,危险度分级越高,肿瘤复发和转移的风险越大,因此早期诊断与治疗GSTs极为重要,其中超声内镜(endoscopic ultrsonography,EUS)可通过病变直径大小、病变部位、回声是否均匀、回声起源、边界是否清晰以及血管分布情况等特征对肿瘤的类型和良恶性作出初步判断[4]。多年来,随着消化内镜设备和操作技术的进步,内镜下切除较大直径GSTs,在临床上得到越来越广泛的应用[5],相对于外科手术,内镜下黏膜剥离术(endoscopic submucosal dissection,ESD)在“创伤小、花费少、恢复快”等方面极具优势,其安全性得到广泛报道。但仍有部分患者术后会发生出血、穿孔及发热等并发症,EUS对GSTs患者ESD相关并发症是否有预测作用尚缺乏相关研究佐证。本研究旨在通过回顾性收集95例胃间质瘤患者的一般临床资料、内镜及影像学特征,探讨EUS和腹部电子计算机断层扫描(computed tomography,CT)对GSTs的诊断率及ESD相关并发症的预测价值。
1 资料与方法
1.1 一般资料
本研究纳入徐州医科大学附属医院2017年1月至2020年5月经ESD术后病理及免疫组织化学染色确诊的95例GSTs患者,全部患者术前均行EUS和腹部CT检查,其中EUS和腹部CT初步诊断GSTs患者47例。临床表现包括上腹胀痛不适、恶心呕吐、反酸嗳气或无症状等。纳入标准:①心肺功能评估良好,无全麻禁忌症;②无复杂手术史,无严重腹腔粘连;③ESD术前均行EUS和腹部CT检查;④ESD术后病理确诊为GSTs;⑤患者临床及内镜资料完整。排除标准:①合并消化道其他肿瘤;②有常规内镜治疗禁忌症者;③ESD术前一周内曾服用阿司匹林;④围手术期有其他手术史者。所有患者均于术前签署了手术知情同意书。本研究方案经徐州医科大学附属医院伦理审查委员会批准(受理号:XYFY2021-KL002-01)。
1.2 术前准备
通常电子胃镜发现胃内隆起灶后,进一步行EUS检查明确病变大小及浸润深度,继而行腹部CT(平扫或增强)明确瘤体生长方式(腔内或混合生长)和有无转移等。术前需完善血、尿、粪三大常规、肝肾功能、凝血四项、常规心电图及胸部CT平扫等检查以排除全身麻醉禁忌。如术前曾口服抗血小板药物,则需停用7 d,术前均需禁食8 h。
1.3 检查方法
所有纳入患者ESD术前均接受EUS和腹部CT检查。
1.3.1 EUS资料 采用超声小探头系统(日本FUJINON公司生产,型号:sp702)。每位患者均由具有10年及以上ESD操作经验的内镜医师按标准方法操作完成,由两位内镜专家独立审阅每位患者的EUS图像,两位专家对所有患者的一般资料及GSTs的病理恶性潜能均不知晓。对于每个瘤体,记录以下EUS特征:病变部位、病变最大直径(cm)、回声高低、回声性质、生长方式。如有分歧,则由第三位内镜专家审阅图像后决定(注:腔内生长指>50%的瘤体向腔内隆起;混合生长指<50%的瘤体向腔内隆起[6]。低回声指病变起源于固有肌层或黏膜肌层;混合回声是指大部分病变起源于固有肌层或黏膜肌层,仅小部分病变起源于黏膜下层或浆膜层)[7]。
1.3.2 腹部CT资料 CT扫描采用飞利浦Brilliance iCT 128层螺旋CT机,扫描参数:管电压120 kV,自动管电流,准直器宽度1.2 mm,采集螺距0.2,球管转速0.33 r/s。增强扫描者采集动脉期、静脉期图像。首先由一位影像科研究生进行图像重建和审阅,再经一位影像科专家审核。两位医师对所有患者的一般资料及GSTs的病理恶性潜能均不知晓。对于每个病灶,均记录以下影像学特征:病变部位、肿瘤最大截面径(cm)、形态、边界、生长方式、密度(HU)、表面是否溃疡、有无钙化、坏死情况、周围脂肪间隙评估、临近组织侵犯征象。
1.4 并发症定义
1.4.1 出血 患者术中发生反复动脉出血或术后48 h内发生呕血或黑便,或术后胃肠减压管引流出血性液体,或术后血红蛋白下降>20 g/L,或术后血压下降>20 mmHg,需要内镜介入或外科手术止血;
1.4.2 穿孔 患者在术中或术后48 h内出现腹膜刺激征,或术中内镜下可见黄色大网膜及腹腔内组织(排除术中主动穿孔);
1.4.3 发热 患者在术中或术后48 h内出现腋温≥38.5 ℃,且白细胞≥10.0×109/L,同时排除其他因素引起的发热[8]。
1.5 统计学分析

2 结果
2.1 临床病理特征
本研究共纳入95例患者,所有患者术前EUS均初步诊断为GSTs,仅47例患者术前腹部CT初步诊断为GSTs,即:共47例患者术前EUS和CT检查均初步诊断为GSTs。其中包括男性17例(36.2%),女性30例(63.8%),年龄29~80岁,中位年龄57岁,≤60岁者28例(59.6%),>60岁者19例(40.4%)。根据有无基础疾病(包括高血压、糖尿病等慢性病),将47例患者分为有基础疾病者17例(36.2%),无基础疾病者30例(63.8%)。术后病理所示病变最大直径<2.0 cm共29例(61.7%),≥2.0 cm共18例(38.3%),病变位于贲门和胃底共37例(78.7%),位于胃底体交界、胃体和胃窦共10例(21.3%)。
2.2 EUS和腹部CT表现
47个瘤体EUS下表现为类圆形、椭圆形、梭形、不规则等,绝大多数表面光滑,仅1个瘤体表面稍粗糙,2个瘤体可见顶端溃疡形成,周围黏膜糜烂。EUS所示病变约39例(83.0%)位于胃底和贲门,仅8例(17.0%)位于胃底体交界、胃体和胃窦;EUS所示瘤体中位最大直径为1.5 cm,<2.0 cm共33例(70.2%),≥2.0 cm共14例(29.8%);EUS所示多数病变呈低回声,共39例(83.0%),余8例(17.0%)病变呈混合回声;回声均匀25例(53.2%),回声不均匀22例(46.8%);约28例(59.6%)瘤体呈腔内生长,仅19例(40.4%)瘤体呈混合生长。
47例腹部CT重建图像显示1例瘤体形状不规则,3例边界不光滑,4例有溃疡形成,2例瘤体内部可见囊变。腹部CT所示病变中位最大截面径为1.5 cm,病变最大截面径<2.0 cm约30例(63.8%),≥2.0 cm约17例(36.2%);位于贲门和胃底31例(66.0%),胃底体交界、胃体和胃窦共16例(34.0%);41例(87.2%)瘤体表面无钙化,仅6例(12.8%)瘤体表面有钙化;瘤体多呈腔内生长,约34例(72.3%),13例瘤体呈混合生长(27.7%)。所有瘤体均无血管、淋巴结侵犯以及邻近侵袭。其中有25例患者进一步行腹部CT增强检查。
2.3 诊断准确率研究


2.4 ESD相关并发症研究
2.4.1 单因素分析 根据47例患者ESD术中及术后发生的并发症将其分别分组,根据并发症定义标准,所有纳入的GSTs患者可分为出血组12例,无出血组35例;穿孔组18例,无穿孔组29例;发热组6例,无发热组41例。在12例发生ESD相关出血的患者中,包括1例发生术中出血的患者,内镜下止血效果差,转入外科手术治疗,其余患者均成功接受内镜下处理。依次分析患者的基线资料、术前EUS和腹部CT特征与ESD相关出血、穿孔和发热之间的关系,单因素分析结果显示:两组患者在年龄、性别和有无基础疾病等基线资料方面,差异无统计学意义(P>0.05)。EUS和腹部CT所示病变最大直径≥2.0 cm均是预测ESD相关出血的影响因素(P<0.05),EUS和腹部CT所示病变混合生长均是预测ESD相关穿孔的影响因素(P<0.01),见表1。
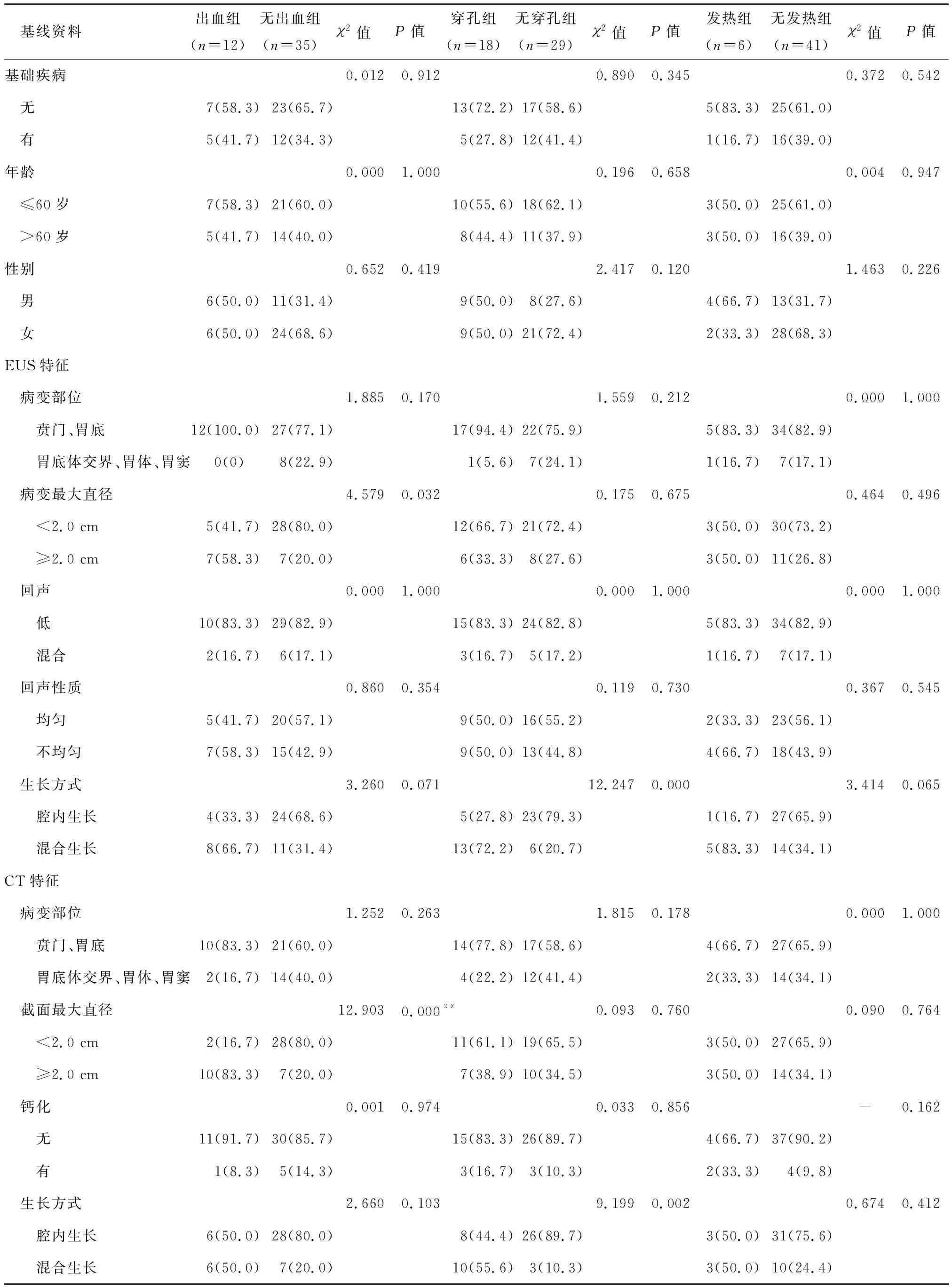
表1 47例胃间质瘤患者的基线资料、EUS特征和CT特征预测ESD相关并发症的单因素分析 [n(%)]
2.4.2 二元Logistic回归分析 排除混杂因素,对上述有统计学意义的指标进一步行二元Logistic回归分析,结果表明可以认为腹部CT所示病变最大截面径≥2.0 cm是预测GSTs发生ESD相关出血的独立危险因素(P<0.01),见表2。EUS和腹部CT所示病变混合生长是预测GSTs发生ESD相关穿孔的独立危险因素(P<0.01),且腹部CT的预测价值略优于EUS,见表3。

表2 预测胃间质瘤发生ESD相关出血的多因素非条件Logistic回归分析结果
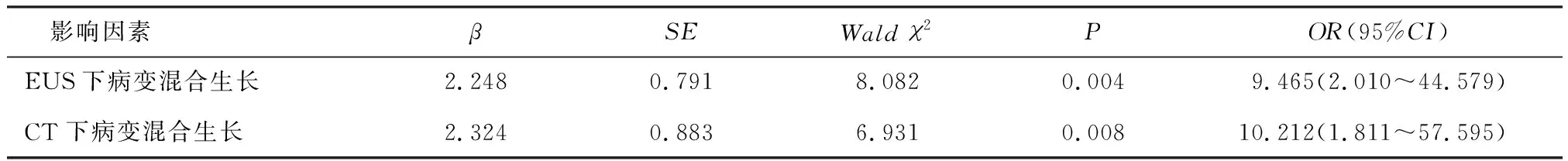
表3 预测胃间质瘤发生ESD相关穿孔的多因素非条件Logistic回归分析结果
以发生ESD相关出血为状态变量,腹部CT所示病变最大截面径为检验变量作ROC曲线,结果显示,曲线下面积为0.923,95%CI为0.836~1.000,P<0.01,灵敏度=83.33%,特异性=85.71%,截断值=2.2 cm(图1)。即腹部CT所示病变最大直径≥2.2 cm是预测GSTs患者发生ESD相关出血的独立危险因素且预测效能较高。
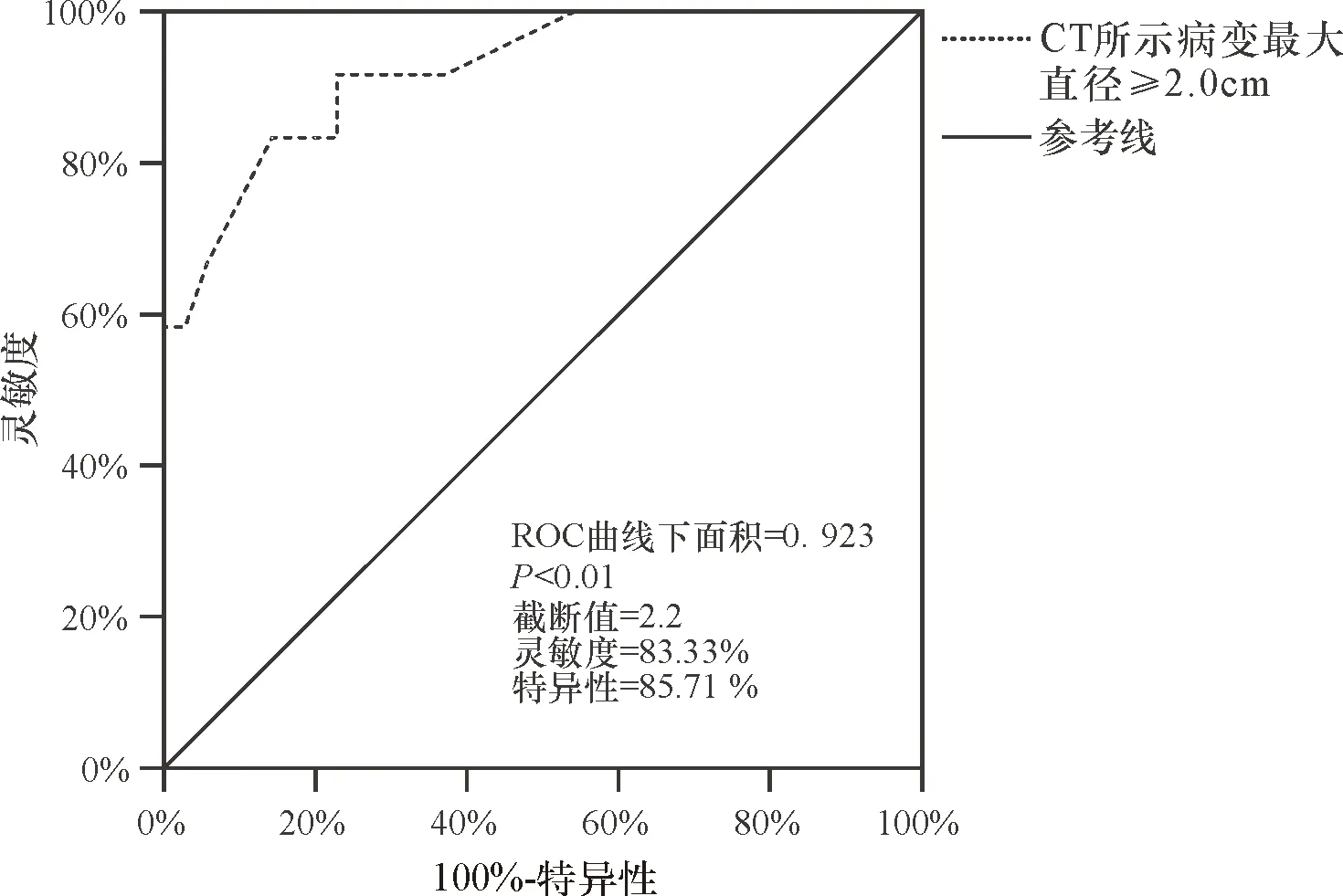
图1 腹部CT所示病变最大直径≥2.0 cm预测胃间质瘤患者发生ESD相关出血的ROC曲线
以发生ESD相关穿孔为状态变量,EUS和腹部CT所示病变生长方式为检验变量作ROC曲线,结果显示,EUS、腹部CT和二者联合预测曲线下面积分别为0.758,0.726,0.828,灵敏度分别为72.22%、55.56%、83.33%,特异度分别为79.31%、89.66%、68.97%(图2)。即EUS和腹部CT所示病变混合生长均可用于预测GSTs患者发生ESD相关穿孔,且预测效能均较好,尤其当二者联合预测时,预测能力最佳,灵敏度较单独指标显著升高。
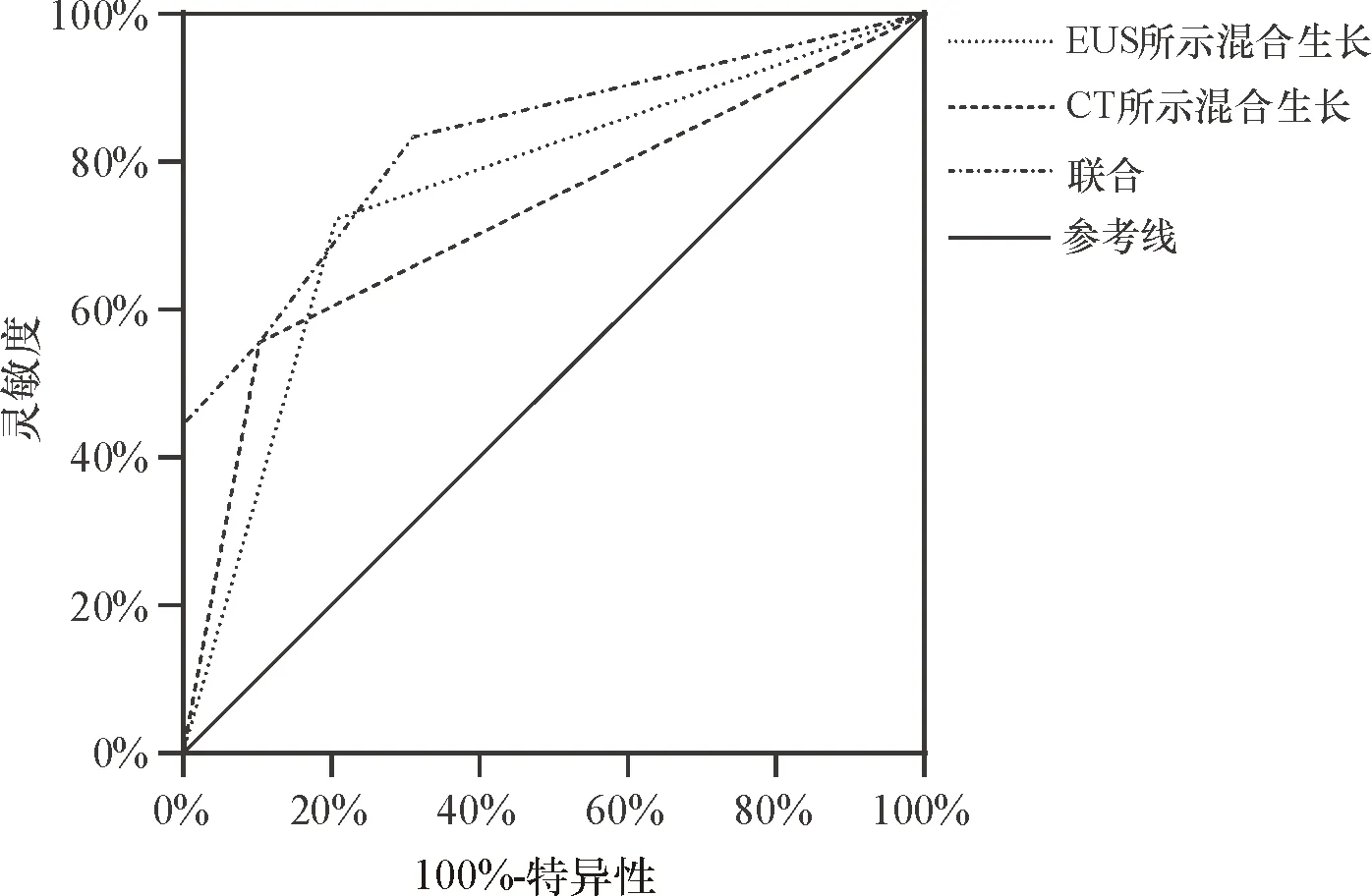
图2 EUS和腹部CT所示病变混合生长预测胃间质瘤患者发生ESD相关穿孔的ROC曲线
3 讨论
临床上,GSTs通常起病隐匿,有相当一部分患者可无明显腹痛、腹胀和恶心等症状,多于体检或行其他手术时偶然发现,近年来,随着内镜技术的普及,GSTs的诊出率较前大幅度提高。张琪等[8]研究认为,EUS所示GSTs大多起源于固有肌层(低回声层),少部分瘤体起源于黏膜肌层(低回声层),极少部分瘤体起源于黏膜下层和浆膜层(高回声层),这与本研究所纳入的GSTs回声情况基本符合。Meng等[9-10]研究认为,ESD与腹腔镜术治疗小GSTs(<2.0 cm),所致并发症无显著性差异,而ESD组在住院天数和手术时间短,术中出血量少等方面极具优势。Chen等[11]认为,ESD是一种可行、安全、有效、微创的大GSTs(LGSTs,≥3.0 cm)切除方法。Li等[12]总结认为,通常大部分GISTs起源于固有肌层,生长方式各异,肿瘤与邻近组织界限不清,内镜下对病变进行根治并不容易,此外,出血、穿孔、肿瘤细胞植入等并发症的发生率较高,不建议将内镜切除作为GISTs的常规治疗方法。也有学者研究认为[13],内镜手术倾向于治疗直径<2.0 cm的GSTs。综合来说,鉴于内镜手术在住院天数和手术时间等方面的优势,术前早期评估ESD相关并发症发生的风险提高内镜治疗的安全性显得尤为重要。
朱兰平等[14]研究表明,EUS对GSTs的定性诊断准确率达91.85%;周祥荣等[15]研究显示,EUS和三期增强CT对GSTs的定位诊断准确率分别达95.65%和80.43%;杨兴益等[16]研究认为,多层螺旋CT平扫+增强对其定性和定位诊断准确率达75.00%和70.59%。本研究结果显示EUS对GSTs的定性和定位诊断准确率分别为100.0%和91.5%,而多层螺旋CT对其定性和定位诊断准确率仅为49.5%和72.3%,无论是从定性还是定位诊断准确率方面而言,EUS均高于腹部CT。本研究结果中多层螺旋CT对GSTs的定性诊断准确率明显低于前人所得结果,可能与本研究所纳入的患者中仅有25例(53.2%)进一步行增强CT检查,且瘤体直径多数<2.0 cm,明显小于前人纳入的瘤体大小有关。正如王珂等[17]研究表明,当GSTs直径较小时,CT平扫多表现为圆形或类圆形肿块,且密度均匀、边界清晰,特异性不高,增强扫描有助于进一步诊断。
Ohta等[18]研究认为,病变直径>2.0 cm与病变位于上部胃体均为预测ESD术中穿孔的独立危险因素。另外,付启超等[19]研究显示,病变直径≥2.0 cm与病变位于贲门和胃底部均为预测ESD术中穿孔的独立危险因素。而本研究认为,EUS和腹部CT所示病变呈混合生长是预测ESD相关穿孔的独立危险因素,可能是呈混合生长的GSTs瘤体倾向于凸向腔外,故剥离瘤体时更容易发生穿孔。
Oda等学者[20]研究报道ESD治疗GISTs的出血率为0~15.6%,ESD早期出血(术后不超过24 h)的危险因素包括年龄≤65岁、瘤体直径≥3.0 cm、手术时间超过20 min和病变位于胃下三分之一,ESD术后迟发性出血(术后超过24 h)的独立危险因素为病变直径>40 mm。本研究收集的47例GSTs中有1例明确发生术中出血,且内镜下止血效果差,转入外科行手术治疗。另11例出血患者及18例穿孔患者均经内镜下治疗成功,6例感染患者经抗感染保守治疗后好转。本研究认为腹部CT所示病变最大直径≥2.2 cm是预测GSTs发生ESD相关出血的独立危险因素。尽管术者ESD操作水平因人而异,但ESD属于四级手术,术者均为具有10年及以上ESD操作经验的内镜医师,且均按照标准方法操作完成,水平差异可忽略不计。从理论上讲EUS操作水平因人而异,且部分EUS图像质量清晰度不够,都有可能影响对GSTs的观察,从而影响最终的结果,但我们在选择纳入人群时已尽量避免这种误差。尽管在本研究条件下,腹部CT和EUS均可用于辅助评估ESD相关并发症,仍有5例(10.6%)患者腹部CT所示病变最大直径≥2.2 cm而最终并未发生出血;6例(12.8%)患者EUS下瘤体呈混合性生长而最终并未发生穿孔。这说明根据术前评估瘤体直径大小和生长方式判断手术相关并发症的风险是不够准确的,但其对临床仍有一定的指导意义,可为临床医生手术治疗前早期采取防范措施提供参考依据。
本研究属于单中心临床回顾性研究,且样本量有限,存在一定的局限性:①选择偏倚,本研究所纳入的GSTs患者均接受我院EUS和腹部CT检查,且均接受ESD治疗,未纳入外院检查和治疗的患者;②主观因素,虽然EUS和腹部CT均由有资质的高年资医师实施检查,且图像均由有经验的内镜和影像学专家采用盲法原则进行分析,但在某种程度上有一定的主观性。
综上所述,对于直径相对较小的GSTs而言,术前更倾向于行EUS检查,其定性和定位诊断准确率均较腹部CT高。EUS和腹部CT均有助于预测ESD相关并发症,二者联合预测ESD相关穿孔能力最佳。且腹部CT可独立预测ESD相关出血。
