联合益生菌根除幽门螺杆菌对胃蛋白酶原、胃泌素-17的影响
2021-03-21彭卫斌叶东雯黄晓雯沙卫红杨元生容海鹰聂玉强
彭卫斌,叶东雯,黄晓雯,沙卫红,杨元生,容海鹰,聂玉强
幽门螺杆菌(Helicobacterpylori,H.pylori)全球感染率大约为50%,被世界卫生组织列为I类致癌因子,是慢性胃炎、消化性溃疡、胃癌等疾病的主要病因[1-2]。国内外研究[3-6]已明确益生菌能提高H.pylori的根除率及减少不良反应,尽管观察到了益生菌在根除H.pylori过程中的积极作用,但关于益生菌根除H.pylori治疗的效果评价,目前国内外研究都仅停留在H.pylori的根除率上,评价标准较为局限,并不能全面反映益生菌的临床疗效,探索新的评价标准已成为该领域的研究重点及难点。H.pylori与胃癌的发生及发展有关,血清学标志物PG Ⅰ、PG Ⅱ、G-17作为胃癌前病变的“血清学活组织检查”,在传统疗法根除治疗H.pylori后,胃蛋白酶原(pepsinogen,PG)、胃泌素-17(gastrin-17,G-17)均发生了一定的变化[7-9],而联合益生菌根除治疗H.pylori的同时,对血清PG、G-17是否也有影响,目前缺乏这方面的研究。本研究在标准四联疗法的基础上联合益生菌根除H.pylori治疗,并观察治疗前后PG、G-17的变化,初步探讨益生菌治疗H.pylori的临床疗效评价标准。
1 资料与方法
1.1 研究对象
选取2020年12月至2021年10月于广州新海医院门诊或住院患者137例为治疗组,将治疗组入选者按随机数字表法随机分为四联疗法组及联合益生菌疗法组。另随机选取同期120例健康体检者为健康对照组,分为H.pylori阳性组和H.pylori阴性组。健康体检人群中,H.pylori阳性56例,阳性率46.67%,H.pylori阴性64例,阴性率53.33%。四联疗法组患者69例,男43例,女26例,平均年龄(44.8±15.6)岁;联合益生菌疗法组患者68例,男40例,女28例,平均年龄(48.2±15.8)岁;健康对照组120例,男68例,女52例,平均年龄(43.5±16.1)岁。三组患者年龄、性别之间的差异均无明显统计学意义(P>0.05)。本研究属于前瞻性病例对照研究。患者及健康者均意识到风险及益处,所有入选者均签订知情同意书,本研究经医院伦理委员会审核批准。
1.1.1 纳入标准
治疗组纳入标准:①经胃镜确诊为慢性胃炎;②14C尿素呼气试验(14C-UBT)和胃黏膜组织快速尿素酶试验(RUT)均为阳性;③具有上腹痛、反酸、腹胀、嗳气等临床表现;④年龄18~70岁。
健康者纳入标准:①完成14C尿素呼气试验(14C-UBT)检查;②来自体检中心的健康志愿者,无任何消化系症状;③年龄18~70岁。
1.1.2 排除标准 ①过去4周内服用过胃黏膜保护剂、铋剂、PPI、H2受体拮抗剂或抗生素等可能影响疗效的药物;②长期使用抗凝药物或抗血小板药物或存在凝血功能障碍,以致无法进行内镜活检;③对本研究中使用的任何药物有禁忌症/过敏;④肿瘤、消化性溃疡出血;⑤上消化道手术;⑥患有严重心脏、肝脏或肾脏功能不全等系统性疾病;⑦妊娠或哺乳;⑧不能遵守治疗方案的个体;⑨资料不全者。
1.2 分组及给药方法
将治疗组入选者按随机数字表法随机分为两组:
1.2.1 四联疗法组 雷贝拉唑胶囊(珠海润都制药股份有限公司产品)10 mg+枸橼酸铋钾胶囊(丽珠制药厂,0.3 g相当于铋剂0.11 g)0.6 g+克拉霉素片(上海雅培制药有限公司产品)500 mg+阿莫西林胶囊(珠海联邦制药有限公司产品) 1 000 mg,均每日2次;
1.2.2 联合益生菌疗法组 在上述标准四联治疗基础上加用双歧杆菌乳杆菌三联活菌片(Bifidobacterium>107cfu/g,内蒙古双奇药业股份有限公司产品)2 000 mg,每日3次。
两组患者均用药14 d。雷贝拉唑胶囊、枸橼酸铋钾、双歧杆菌乳杆菌三联活菌片用药为餐前(与抗菌药物服用间隔时间至少2 h),阿莫西林胶囊及克拉霉素片用药为餐后。治疗组所有患者使用阿莫西林胶囊前均做青霉素皮试,青霉素皮试均阴性。
1.3 观察指标及疗效判断标准
1.3.1H.pylori根治率 治疗结束4周后采用14C 尿素呼气试验复查H.pylori,阴性认为H.pylori被根除。H.pylori根除率计算,我们采用意向性分析(intention-to-treat, ITT)和符合方案分析(per-protocol, PP)相结合的方法进行评估。ITT分析,包括所有入选患者,失访者和中途终止试验者均按根除失败统计。PP分析,剔除失访者和中途终止试验者。
1.3.2 胃黏膜炎症评估 治疗组通过标准胃镜检查观察胃黏膜,于胃窦、胃体取病理活检,胃黏膜的慢性炎按2017年中国慢性胃炎的诊断标准评分[10]。
1.3.3 血清PG Ⅰ、PG Ⅱ、G-17检测 治疗前及治疗14 d后分别采取受试者晨起空腹静脉血,离心后分离血清,置于-20 ℃冰箱中保存备用。采用双抗体夹心酶联免疫吸附法对受试者血清PGⅠ、PGⅡ、G-17水平进行检测,并计算胃蛋白酶原比值(pepsinogen ratio, PGR=PG Ⅰ/PG Ⅱ)。
1.4 统计学方法

2 结果
2.1 H.pylori根除率比较

2.2 治疗前各组血清PG Ⅰ、PG Ⅱ、PGR及G-17水平的比较
四联疗法组、联合益生菌疗法组、H.pylori阳性健康对照组与H.pylori阴性健康对照组比较,PG Ⅰ、PG Ⅱ及G-17水平明显升高,PGR水平显著下降,差异有统计学意义(P<0.05);而四联疗法组、联合益生菌疗法组与H.pylori阳性健康对照组比较,差异无统计学意义(P>0.05),见表1。
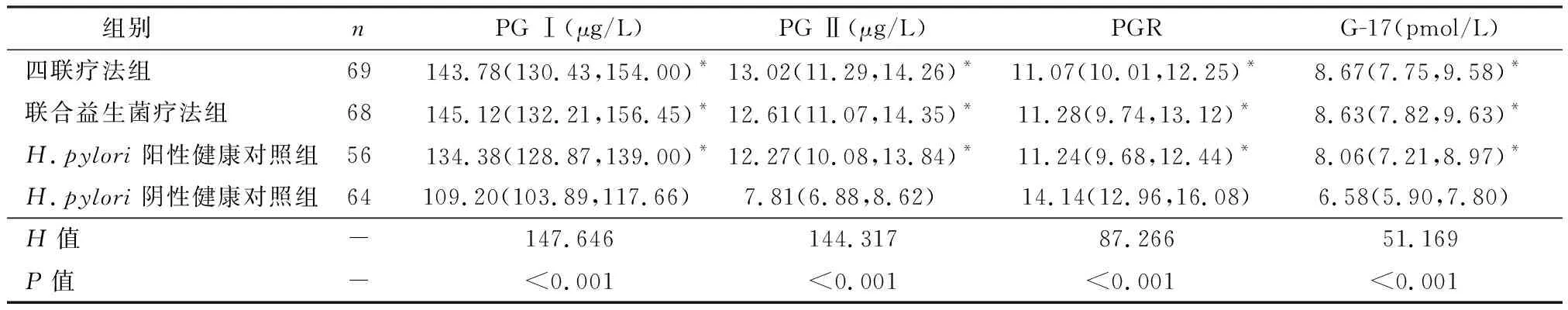
表1 各组血清PG Ⅰ、PG Ⅱ、PGR及G-17水平的比较 [M(Q1,Q3)]
2.3 两组患者治疗前后血清PG Ⅰ、PG Ⅱ、PGR及G-17水平变化的比较
四联疗法组完成治疗59例,联合益生菌疗法组完成治疗64例。与治疗前比较,治疗后四联疗法组与联合益生菌疗法组患者血清PG Ⅰ、PG Ⅱ及G-17水平明显下降,PGR水平明显升高,差异均有统计学意义(P<0.05);与四联疗法组比较,联合益生菌疗法组治疗后PG Ⅰ、PG Ⅱ、PGR及G-17水平变化更明显,差异有统计学意义(P<0.05),见表2。
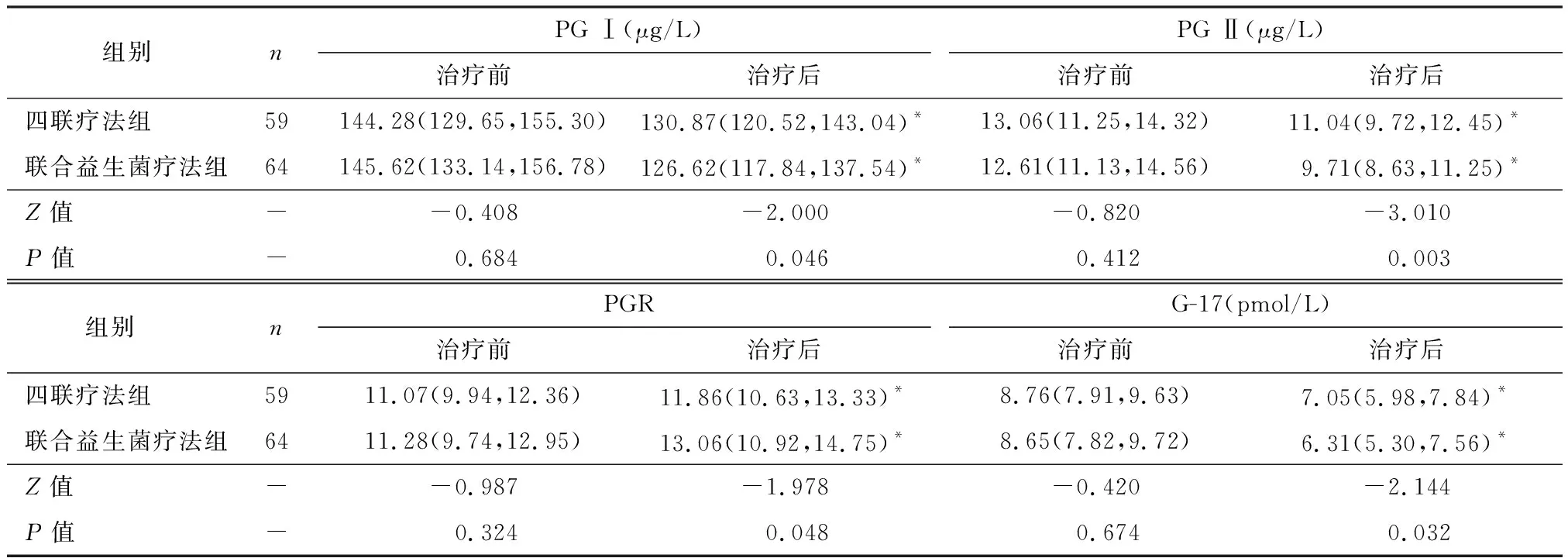
表2 两组患者治疗前后血清PG Ⅰ、PG Ⅱ、PGR、G-17水平的比较 [M(Q1,Q3)]
2.4 H.pylori慢性胃炎不同炎症程度血清PG Ⅰ、PG Ⅱ、PGR及G-17的水平变化
在所有慢性胃炎患者中,不同炎症程度慢性胃炎所占的比率分别是轻度42.34%(58/137)、中度34.50%(50/137)、重度21.17%(29/137)。随着慢性胃炎炎症程度的逐渐加重,血清PG Ⅰ、PG Ⅱ及G-17的水平也逐渐升高,各组间比较,差异均有明显统计学意义(P<0.05),而PGR 水平下降不明显,各组间比较,差异均无统计学意义(P>0.05),见表3。
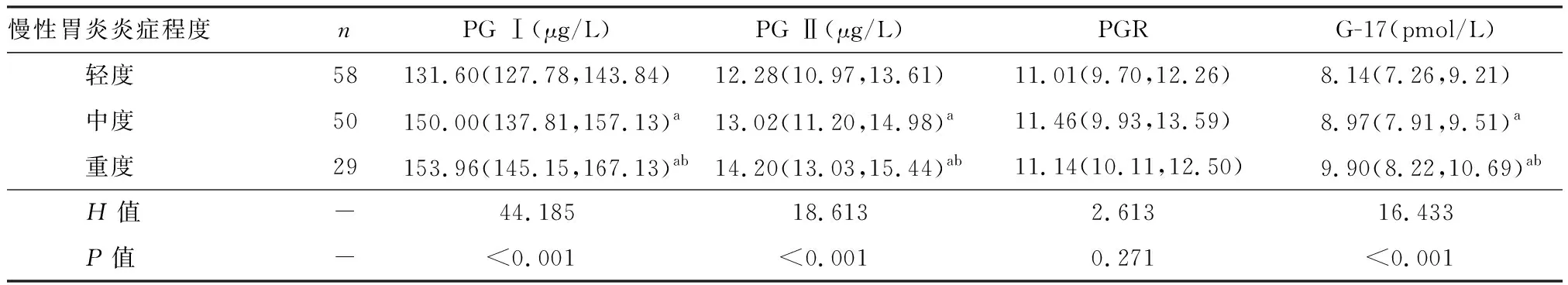
表3 慢性胃炎不同炎症程度血清PG Ⅰ、PG Ⅱ、PGR及G-17水平的比较 [M(Q1,Q3)]
2.5 两组患者H.pylori根除对PG Ⅰ、PG Ⅱ、PGR及G-17水平的影响
四联疗法组完成治疗59例,H.pylori阳性9例,H.pylori阴性50例;联合益生菌疗法组完成治疗64例,H.pylori阳性5例,H.pylori阴性59例。与H.pylori阳性患者比较,四联疗法组与联合益生菌疗法组H.pylori阴性患者PG Ⅰ、PG Ⅱ及G-17水平下降明显,PGR水平明显升高,差异有统计学意义(P<0.05),且联合益生菌疗法组PG Ⅰ、PG Ⅱ、PGR及G-17水平的变化更明显,差异有统计学意义(P均<0.05),见表4。

表4 两组患者H.pylori根除对血清PG Ⅰ、PG Ⅱ、PGR、G-17水平的影响 [M(Q1,Q3)]
3 讨论
因细菌耐药性的出现导致H.pylori根除率逐年降低,益生菌辅助根除H.pylori疗法也越来越受到重视,联合益生菌可提高H.pylori治疗过程患者的耐受性,减少不良反应,从而提高H.pylori的根除率,然而仅仅依靠H.pylori根除率及不良反应的评价,存在一定的局限性,并不能全面反映益生菌根除H.pylori的作用,联合益生菌根除H.pylori治疗后,胃黏膜病变是否也得到了改善?目前缺乏相关性的研究,寻求新的疗效评价标准也成为了该领域研究的重点及难点。因此,我们尝试从新的视觉来探讨益生菌根除H.pylori临床评价标准。
PG已被广泛认为是胃黏膜的生物标志物,PG可分为两种类型,PG Ⅰ和PG Ⅱ。PG Ⅰ主要由胃底腺的主细胞和颈黏液细胞分泌,PG Ⅱ则由全胃腺(包括胃贲门腺、胃底腺、幽门腺)和十二指肠Brunner腺细胞分泌,约有1%的PG通过胃黏膜毛细血管进入血液循环,进入血液循环的PG较稳定[11]。G-17主要由胃窦的G细胞分泌,受到胃酸的反馈调节,通常胃体黏膜萎缩时G-17升高[12-13]。在胃黏膜出现炎症时血清PG Ⅰ和PG Ⅱ水平增加,而在胃黏膜萎缩时,随着胃底腺黏膜的丢失和主细胞数量的减少,PG Ⅰ和PG Ⅱ水平下降,且PG Ⅰ下降更为明显,因此血清PG Ⅰ/Ⅱ比值(PGR)降低。PG和G-17 联合检测已被证实可用于筛查胃黏膜萎缩,包括胃窦或胃体黏膜萎缩,因而被称为“血清学活组织检查”[14-16]。胃黏膜萎缩特别是胃体黏膜萎缩者是胃癌发生高危人群,非侵入性血清学筛查与内镜检查结合,有助于提高胃癌筛查效果[17-20]。H.pylori与胃癌的发生及发展有关,益生菌在治疗H.pylori的同时,胃癌前病变的血清学标志物PG、G-17发生了哪些变化,其可能的机制仍未明确。
我国目前H.pylori的感染率40%~60%[21-22]。本研究结果显示,120例健康受检者中,H.pylori阳性56例,阳性率为46.67%,这也与流行趋势一致,但本研究样本量小,且为单中心研究,筛选过程中只统计了健康人群的H.pylori感染率,并未把患病人群纳入统计,从而低估普通人群的感染率,未来将以更大规模的研究统计,有助于全面对H.pylori感染的风险评估。研究还发现,H.pylori阳性的患者及健康者与H.pylori阴性健康者比较,PG Ⅰ、PG Ⅱ、G-17水平升高明显,这说明H.pylori感染后,胃黏膜出现炎症时血清PG Ⅰ、PG Ⅱ、PG-17的分泌增加,也反映H.pylori感染性胃炎胃酸的分泌、胃的黏膜功能处于异常状态,H.pylori感染与PG Ⅰ、PG Ⅱ、PG-17的水平是否存在正相关性仍需大样本的进一步研究。
胃黏膜的慢性炎症程度与H.pylori感染相关,所有H.pylori感染者几乎均存在慢性活动性胃炎[23]。本研究发现,随着慢性胃炎炎症程度的逐渐加重,血清PG Ⅰ、PG Ⅱ、G-17的水平也逐渐升高,各组之间比较均有显著性差异(P<0.05)。而G-17的水平升高没有PG Ⅰ、PG Ⅱ升高的明显,说明G-17分泌受到一定的抑制,这可能是随着H.pylori感染后胃酸分泌增加,受到胃酸的反馈,机体的自我调节。PGR 水平下降不明显,各组之间比较差异无明显统计学意义(P>0.05),说明随着慢性胃炎炎症程度的加重,PG Ⅰ升高并没有PG Ⅱ升高得明显,这可能和慢性胃炎的部位、范围、萎缩及肠化生有关。根除H.pylori治疗后,慢性胃炎的恢复是否与PG Ⅰ、PG Ⅱ、G-17水平有关仍需进一步的研究证实。
本课题小组进一步的研究发现,根除H.pylori治疗后,四联疗法组及联合益生菌疗法组血清中的PG Ⅰ、PG Ⅱ、G-17含量减少,而PGR明显升高,且联合益生菌疗法组的PG Ⅰ、PG Ⅱ、G-17的变化更显著,这也提示根除H.pylori有利于调整胃功能,且联合益生菌疗法组效率更加明显。此外,治疗后H.pylori根除患者的PG Ⅰ、PG Ⅱ、G-17水平下降,及PGR水平升高更加明显,说明根除H.pylori治疗在促进胃黏膜炎症恢复方面起重要作用,且联合益生菌疗法组与四联疗法组比较差异有统计学意义,提示了益生菌疗法更有利于胃黏膜炎症的修复,这也需要内镜的进一步明确。在H.pylori的根除率比较中,按ITT分析,联合益生菌组根除率为86.76%,传统的四联疗法组根除率为72.46%,差异有明显统计学意义(P<0.05),而按PP分析,联合益生菌组根除率与传统四联疗法组比较,差异无统计学意义(92.19%vs84.75%,P>0.05),体现了联合益生菌可以减轻根除H.pylori治疗过程中的不良反应,提高患者的依从性,从而提高H.pylori的根除率,结果与Wang及汪慧霞等[24-25]相似,提示H.pylori根除率与PG Ⅰ、PG Ⅱ、G-17水平变化可能存在着一定的相关性,这仍需后期的研究证实。
综上所述,本研究发现四联疗法联合益生菌治疗H.pylori慢性胃炎,不仅能提高H.pylori的根除率,同时还影响血清中PG Ⅰ、PG Ⅱ、PGR、 G-17水平的变化,对胃黏膜炎症的恢复更有利,血清PG Ⅰ、PG Ⅱ、PGR、G-17有望成为联合益生菌根除治疗H.pylori新的临床评价标准,但在益生菌治疗不同类型H.pylori相关性胃病的疗效与血清PG Ⅰ、PG Ⅱ、PGR、G-17的变化是否一致、与H.pylori根除率是否相关等问题尚有待研究。
