不同时间离心运动对大鼠比目鱼肌和趾长伸肌损伤的影响及炎性机制研究
2021-03-19侯改霞李腾冲蒋昊圻梁学三李露豪薛俊杰付素焕
侯改霞李腾冲蒋昊圻梁学三李露豪薛俊杰付素焕
(河南大学体育学院,河南开封 475001)
骨骼肌损伤是运动损伤中最常发生的一种软组织创伤,占运动损伤的40%以上[1]。在骨骼肌损伤治疗的研究中,骨骼肌损伤动物模型的可靠性、适用性和可行性与实验结果的科学性密切相关。下坡跑(离心运动)骨骼肌损伤模型常常被用以研究骨骼肌运动性损伤[2]。在复制下坡跑(离心运动)骨骼肌损伤模型时,动物跑台坡度一般采用-16°,但运动时间及模型的取材部位等问题还存在争议。已有研究认为,1 周连续的离心运动与1 次离心运动相比,骨骼肌损伤无积累现象[3],但金其贯等[4]研究则认为短时间内连续大强度的离心运动可造成骨骼肌损伤的累积。关于取材部位,有的研究在比目鱼肌[5],有的研究在趾长伸肌[6]。因此,复制下坡跑(离心运动)骨骼肌损伤模型的方法还有待于进一步的验证和考究,为骨骼肌运动损伤研究的开展提供模型基础。
本课题拟通过不同时间的大鼠离心运动,复制大鼠骨骼肌损伤模型,通过检测骨骼肌损伤大鼠的血清和骨骼肌的相关指标,来观察、对比不同方法复制的大鼠骨骼肌损伤模型的特点,为骨骼肌运动损伤的研究提供可靠、实用的动物模型。
1 材料和方法
1.1 实验动物
雄性Wister 大鼠24 只(SPF 级,8 周龄,体重290~320 g),购自北京斯贝福生物技术有限公司[SCXK(京)2019-0010]。大鼠饲养于河南大学体育学院运动人体科学实验室专用动物房内[SYXK(豫)2016-0006],大鼠分笼喂养,每笼4 只,自然昼夜节律变化,自由进食。室温(23±2)℃,相对湿度40%~60%。普通饲料喂养,饲料由北京斯贝福生物技术有限公司配制。本实验方案通过河南大学生物医学科研伦理委员会审核批准(HUSOM -2019044),在实验的过程中严格遵循实验动物的3R 原则。
1.2 主要试剂与仪器
乳酸脱氢酶(LDH)(批号20190617)和肌酸激酶(CK)(批号20191007)均购自南京生物工程研究所;试剂盒RNA 提取液、QRT-PCR 引物、HE 染液均购自武汉赛维尔生物科技公司;三氯甲烷、异丙醇、无水乙醇、中性树胶均购自国药集团化学试剂有限公司;D3024R 台式高速冷冻型微量离心机(DragonLab);Stepone plus 荧光定量PCR 仪(ABI)、JJ-12 J 脱水机与JB-P5 包埋机(武汉俊杰电子有限公司);RM2016病理切片机(上海徕卡仪器有限公司);Nikon Eclipse E100 正置光学显微镜(日本尼康)。
1.3 实验方法
1.3.1 动物分组及训练方法
参照文献[6]方法并稍加改进建立骨骼肌损伤模型,采用动物跑台运动,下坡跑(离心运动),跑台坡度-16°。雄性Wister 大鼠适应性喂养1 周后,随机分为3 组:安静对照组(A 组)、一次离心运动损伤组(1T 组)、一周离心运动损伤组(1 W 组),每组8 只。A 组饲养条件与运动组相同,不运动。1 W组先进行1 周适应性训练,再进行1 周正式训练。1周适应性训练方案为:第1、2 天,跑台坡度为0°,速度为16 m/min,每天训练10 min;第3、4 天,跑台坡度为-5°,速度为16 m/min,每天训练15 min;第5、6天,跑台坡度为-10°,速度为16 m/min,每天训练30 min;第7 天休息。1 周正式训练方案为:第1、2 天,跑台坡度为-16°,速度为20 m/min,每天训练60 min;第3~4 天,跑台坡度为-16°,速度为20 m/min,每天训练90 min;第5~6 天,跑台坡度为-16°,速度为20 m/min,每天训练120 min;第7 天,跑台坡度为-16°,速度为22 m/min,训练120 min。1T 组训练方案为:第1~6 天训练方法同1 W 组的适应性训练方案;第7 天,跑台坡度为-16°,速度为22 m/min,训练120 min。
1.3.2 动物取材和指标检测
最后一次训练结束后24 h,所有大鼠过夜禁食12 h 后,称重,腹腔麻醉,取材。腹主动脉采血,3000 r/min 离心20 min,取血清置于-80℃冰箱保存以备LDH、CK 检测。取各组大鼠右下肢同一部位比目鱼肌、趾长伸肌置于4%多聚甲醛中固定以备HE 染色切片的制作。取各组大鼠左下肢同一部位趾长伸肌、比目鱼肌置于-80℃冰箱保存以备各指标荧光定量PCR(QRT-PCR)的检测。
1.3.3 骨骼肌HE 染色切片的制作及观察
固定好的比目鱼肌和趾长伸肌经过脱水、浸蜡、包埋、切片4 μm;石蜡切片脱蜡至水,苏木素染色,伊红染色,依次脱水,中性树胶封片;光学显微镜观察,图像采集分析。骨骼肌细胞核呈蓝色、细胞质呈红色。
1.3.4 荧光定量PCR(QRT-PCR)检测
分别取0.1 g 比目鱼肌和0.1 g 趾长伸肌,进行总RNA 抽提,检测RNA 纯度与浓度。按Real-time qPCR 试剂盒说明书进行Real-time qPCR。采用Primer 5.0 设计目的基因,Blast 软件检测引物特性,Oligo 7.37 选择最佳引物。具体引物信息如表1。PCR 扩增:预变性(95℃,10 min),循环(40 次)(95℃,15 s→60℃,60 s),熔解曲线(60℃→95℃,每15 s 升温0.3℃)。GAPDH 作为内参,根据公式2-△△CT计算目的基因的相对表达量。

表1 各指标qRT-PCR 引物信息Table 1 qRT-PCR primer information of each index
1.4 统计学方法
2 结果
2.1 离心运动对各组大鼠血清LDH、CK 水平的影响
由表2 可知,与A 组相比,1T 组和1 W 组大鼠血清CK、LDH 水平均显著升高(P<0.05 或P<0.01);1 W 组大鼠血清CK、LDH 水平显著低于1T组(P<0.05 或P<0.01)。
2.2 离心运动对各组大鼠比目鱼肌和趾长伸肌TLR4 mRNA、MyD88 mRNA 表达的影响
如图1 所示,A 组大鼠的比目鱼肌和趾长伸肌TLR4 mRNA、MyD88 mRNA 表达水平无差异(P>0.05);1T 组大鼠的比目鱼肌TLR4 mRNA、MyD88 mRNA 表达水平显著高于A 组大鼠的比目鱼肌(P<0.01);1T 组大鼠的趾长伸肌TLR4 mRNA 表达水平显著高于A 组大鼠的趾长伸肌(P<0.01),MyD88 mRNA 表达水平显著低于1T 组大鼠的比目鱼肌(P<0.01);1 W 组大鼠的比目鱼肌TLR4 mRNA、MyD88 mRNA 表达水平显著高于A 组大鼠的比目鱼肌(P<0.01),TLR4 mRNA 表达水平显著低于1T组大鼠的比目鱼肌(P<0.05);1 W 组大鼠的趾长伸肌TLR4 mRNA 表达水平显著高于A 组大鼠的趾长伸肌(P<0.01),显著低于1T 组大鼠的趾长伸肌(P<0.01);1 W 组大鼠的趾长伸肌MyD88 mRNA 表达水平显著低于1 W 组大鼠的比目鱼肌(P<0.01)。
2.3 离心运动对各组大鼠比目鱼肌和趾长伸肌NF-κB mRNA、NLRP3 mRNA 表达的影响
如图2 所示,A 组大鼠的比目鱼肌和趾长伸肌的NF-κB mRNA、NLRP3 mRNA 表达均无差异(P>0.05);1T 组大鼠的比目鱼肌NF-κB mRNA、NLRP3 mRNA 表达均显著高于A 组大鼠的比目鱼肌(P<0.05 或P<0.01);1T 组大鼠的趾长伸肌NF-κB mRNA、NLRP3 mRNA 表达显著低于1T 组大鼠的比目鱼肌(P<0.01);1 W 组大鼠的比目鱼肌NLRP3 mRNA 表达显著高于A 组大鼠的比目鱼肌(P<0.01),1 W 组大鼠的趾长伸肌NF-κB mRNA 表达显著低于A 组大鼠的趾长伸肌和1 W 组大鼠的比目鱼肌(P<0.05),1 W 组大鼠的趾长伸肌NLRP3 mRNA 表达显著低于1 W 组大鼠的比目鱼肌(P<0.01)。
2.4 离心运动对各组大鼠比目鱼肌和趾长伸肌TNF-α mRNA、IL-1β mRNA 表达的影响
如图3 所示,A 组大鼠的比目鱼肌和趾长伸肌的TNF-α mRNA、IL-1β mRNA 表达均无差异(P>0.05);1T 组大鼠的比目鱼肌TNF-α mRNA、IL-1β mRNA 表达均显著高于A 组大鼠的比目鱼肌(P<0.05);1T 组大鼠的趾长伸肌IL-1β mRNA 表达显著高于A 组大鼠的趾长伸肌(P<0.05)。
2.5 离心运动对各组大鼠比目鱼肌和趾长伸肌显微结构的影响
如图4 所示,骨骼肌细胞HE 染色细胞核呈蓝色,细胞质呈红色。各组大鼠比目鱼肌中毛细血管数量多于趾长伸肌。与A 组相比,1T 组大鼠的比目鱼肌和趾长伸肌肌细胞间有稍许炎症浸润,细胞间间隙增大,但这种变化比目鱼肌更明显。与A 组相比,1T 组大鼠的比目鱼肌和趾长伸肌的显微结构变化不大。
3 讨论
3.1 不同离心运动时间对大鼠血清指标的影响
研究表明[7-9],骨骼肌损伤会导致机体血清肌酸激酶(CK)、乳酸脱氢酶(LDH)活性的急剧升高。本研究结果显示,与A 组相比,1T 组和1 W组大鼠血清CK、LDH 水平均显著升高(P<0.05 或P<0.01);1 W 组大鼠血清CK、LDH 水平显著低于1T 组(P<0.05 或P<0.01)。提示,与一次大强度离心运动相比,一周的离心运动虽也造成了骨骼肌细胞膜的通透性增大,骨骼肌内CK、LDH 向外逸流增多,但对大鼠骨骼肌损伤并没有表现出叠加作用。本结论与Chen 等[3]的研究结果一致,原因可能与肌肉对离心运动的“适应效应”最早可能发生在第一次离心运动后24 h,持续强化的离心训练对肌肉的损伤和炎症没有加重作用。但金其贯等[4]研究则认为连续的离心运动可使骨骼肌纤维的损伤产生一定的累加作用。因此,关于不同离心运动时间对骨骼肌损伤的影响及其机制还需进一步的研究。
表2 离心运动对各组大鼠血清LDH、CK 水平的影响()Table 2 Effects of eccentric exercise on serum LDH and CK levels of rats in each group

表2 离心运动对各组大鼠血清LDH、CK 水平的影响()Table 2 Effects of eccentric exercise on serum LDH and CK levels of rats in each group
注:与安静组A 组比较,∗P<0.05,∗∗P<0.01;与一次离心运动组(1T 组)比较,#P<0.05,##P<0.01。Note.Compared with Group A,∗P<0.05,∗∗P<0.01.Compared with Group(1T),#P<0.05,##P<0.01.
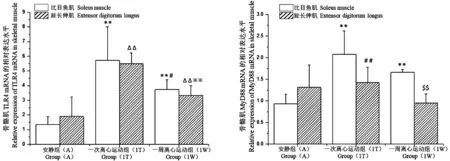
图1 离心运动对各组大鼠比目鱼肌和趾长伸肌TLR4 mRNA、MyD88 mRNA 表达的影响Note.The indexes of soleus muscle and extensor digitorum longus of rats in the same group were compared.The indexes of soleus muscle of rats in different groups were compared.The indexes of extensor digitorum longus between different groups were compared.Compared with soleus muscle of Group A,∗P<0.05,∗∗P<0.01.Compared with extensor digitorum longus of Group A, ΔP<0.05,ΔΔP<0.01.Compared with soleus muscle of Group(1T),#P<0.05,##P<0.01.Compared with extensor digitorum longus of Group(1T),※P<0.05,※※P<0.01.Compared with soleus muscle of Group(1 W), $P<0.05, $ $P<0.01.The same as below.Figure 1 Effects of eccentric exercise on TLR4 mRNA and MyD88 mRNA expression in soleus and extensor digitorum longus in each group

图2 离心运动对各组大鼠比目鱼肌和趾长伸肌NF-κB mRNA、NLRP3 mRNA 表达的影响Figure 2 Effects of eccentric exercise on the expression of NF -κ B mRNA and NLRP3 mRNA in soleus and extensor digitorum longus in each group

图3 离心运动对各组大鼠比目鱼肌和趾长伸肌TNF-α mRNA、IL-1β mRNA 表达的影响Figure 3 Effects of eccentric exercise on the expression of TNF-α mRNA and IL-1β mRNA in soleus and extensor digitorum longus in each group

图4 离心运动对各组大鼠比目鱼肌和趾长伸肌显微结构的影响Figure 4 Effects of eccentric exercise on the microstructure of soleus muscle and extensor digitorum longus in each group
3.2 不同时间的离心运动对大鼠比目鱼肌和趾长伸肌TLR4/MyD88 信号通路及其下游相关炎症因子的影响
Toll 样受体4(Toll-like receptor 4,TLR4)是Toll样受体家族的重要成员之一,TLR4 及其信号通路可激活机体固有免疫系统。TLR4/MyD88(myeloid differentiation factor-88)是TLR4 的主要信号通路。基本途径如下[10-13]:TLR4 被激活后,首先形成LPS/TLR4/MD2 复合物,然后招募接头蛋白MyD88,从而进一步激活NF-κB(nuclear factor-κB,NF-κB),刺激炎症细胞合成和释放 IL-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等前炎性因子的表达,进一步引起机体的炎症反应和组织损伤。
Nod 样受体蛋白3(Nod-like receptor protein 3,NLRP3)也是机体固有免疫系统的识别受体,是一种重要的炎症调节因子。TLR4 属于膜表面受体,NLRP3 是胞质内受体。TLR4/MyD88 信号通路激活NF-κB 后,介导无活性IL-1β 前体(pro-IL-1β)的产生,NLRP3 活化可将pro-IL-1β 剪切为活化的IL-1β,从而介导炎症反应[14]。同时也有研究证明,NF-κB信号通路具有调节NLRP3 炎症小体活化的作用[15]。由此可见,NLRP3 与TLR4/MyD88/NF-κB 介导的炎症反应之间存在反馈调节网络,它们相互协作,共同发挥作用。
本研究结果表明,一次离心运动和一周离心运动对大鼠骨骼肌均造成了一定程度的损伤与炎症。相对于一周离心运动来说,一次大强度离心运动对大鼠骨骼肌造成的损伤更严重,炎症因子的表达水平更高,且大鼠比目鱼肌的损伤程度比趾长伸肌更大。一次离心运动组(1T)比目鱼肌TLR4、MyD88、NF-κB、NLRP3、TNF-α、IL-1β 基因表达均显著上升,而且比目鱼肌相关炎症因子的表达显著高于趾长伸肌。研究表明,骨骼肌炎症与TLR4/MyD88 信号通路激活有密切关系。Kwon 等[16]将小鼠后肢去负荷14 d,野生型(WT)小鼠的骨骼肌表现为葡萄糖摄取受损、肌肉胰岛素信号异常,同时骨骼肌TLR4、NF-κB、炎症因子表达上升,而MyD88(-/-)小鼠却没表现出此现象。离心运动会引起人体骨骼肌相关炎性因子表达的变化[17-19],这可能与离心运动可激活机体TLR4/MyD88 信号通路相关。研究表明[20-21],急性的离心运动会激活男、女外周血单核细胞(peripheral blood mononuclear cells,PBMC)TLR4/MyD88 信号通路,引起NF-κB、IL-1、TNF-α 的表达增多。过度的离心运动也会导致短暂的下丘脑炎症,可导致过度运动小鼠的体重和摄食的减少[22]。老年人髋部骨折引起的股四头肌炎症同样与TLR4/MyD88 信号通路的激活有关,3 个月的运动康复训练,能够降低TLR4/MyD88 信号通路的活性,降低与骨骼肌炎症相关的基因表达[23]。同样,离心运动会导致大鼠骨骼肌中TLR4、MyD88 表达增多,NF-κB、TNF-α、IL-1β 等炎性因子的表达上升,抗炎药的使用可以改善离心运动大鼠骨骼肌的炎症状态[24]。因此,本研究所采用的离心运动方式造成的大鼠骨骼肌的损伤和炎症,可能与TLR4/MyD88 信号通路的激活密切相关,至于同样的离心运动方式,却对大鼠比目鱼肌和趾长伸肌的损伤和炎症因子表达的影响不同,具体机制还需要进一步的研究。
