一种SD 大鼠高血脂模型建立方法的验证以及造模时长对相关指标的影响探讨
2021-03-19易吉平余晓巍
蔡 拓 张 慈 易吉平 余晓巍∗
(1.湖南省职业病防治院,长沙 410007;2.中南大学湘雅护理学院,长沙 410013)
高脂血症又称为血脂异常或脂代谢紊乱,是引起心脑血管疾病的重要危险因素之一。其中以低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)增高、血清总胆固醇(total cholesterol,TC)增高、甘油三酯(triglyceride,TG)增高或高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)降低为特点的血脂异常是动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)重要的危险因素[1-3]。
高脂血症预防及治疗药物研究有希望减轻ASCVD 给人类带来的痛苦,降低疾病负担。建立理想的降血脂评价体系是研究降血脂药物首要且重要的一环。常用的降血脂效果评价体系包括建立降血脂动物模型和降血脂体外评价体系[4]。高脂饲料喂养建立的高血脂动物模型符合人类高血脂症形成特点[5],同时选取SD 大鼠作为模型动物具有成本低、易于操作、稳定性好、取血量大等优点[6],故用高脂饲料喂养SD 大鼠常用于高血脂动物模型的建立。
王燕萍等[7]研究探讨了通过高脂饮食喂养SD大鼠4~8 周成功构建高血脂模型,发现造模过程中大鼠血脂水平出现“升高-适应-升高”的内调节过程,4~8 周的高脂饮食不会引起主动脉结构改变但可以诱发大鼠出现中度至重度脂肪肝,但该方法造模时间较长,不适宜大规模推广。2012年,国家食品药品监督管理局发布的“辅助降血脂评价方法”[8]中提出:建议使用高脂饲料喂养大鼠1~2 周建立高血脂模型,郑立新等[9]报道使用该方法推荐的饲料喂养大鼠7 d 后可成功建立混合型高脂模型,由于不同实验系统环境差别较大、在该方法推荐的时间范围构建的动物模型血液指标可能存在波动、且存在用该方法构建的高脂模型是否会引起动物组织器官出现病理性改变等问题,本研究旨在通过使用高脂饲料喂养SD 大鼠两次建立高脂血症模型,比较不同造模时间动物血液检测指标及肝形态的变化规律,初步探讨模型的建立原理,为现行“辅助降血脂评价方法”推广及应用提供证据支持。
1 材料和方法
1.1 实验动物
SPF 级雄性SD 大鼠,8 周龄共144 只,体重(200±20)g,购自湖南斯莱克景达实验动物有限公司[SCXK(湘)2016-0002]。实验动物的饲养和实验过程均在湖南省职业病防治院的屏障环境中完成[SYXK(湘)2017-0001]。动物饲养环境:温度22℃~26℃,相对湿度56%~70%,12 h 明暗交替。研究方案经湖南省职业病防治院GLP 毒理实验室实验动物福利与伦理委员会审核通过(JZ03020180008),实验过程中按照实验动物使用的3R 原则给予人道关怀。
1.2 主要试剂与仪器
血清总胆固醇检测试剂盒(批号0119011)、甘油三酯检测试剂盒(批号1218071)、高密度脂蛋白-胆固醇检测试剂盒(批号1018072)购自四川新健康成生物股份有限公司;低密度脂蛋白-胆固醇检测试剂盒(批号1806071119),购自美康生物试剂。日立-7600 全自动生化分析仪;湘鹰TD6-WS 离心机;德国蔡司Axio Lab.A1 系统显微镜。
1.3 实验方法
1.3.1 饲料
维持饲料、模型饲料均由北京科澳协力饲料有限公司提供。模型饲料配方[10]:49.3%维持饲料、20.0%蔗糖、15%猪油、12.5%酪蛋白、1.2%胆固醇、1.3%磷酸氢钙、0.5%石粉、0.2%胆酸钠。
1.3.2 实验动物分组
大鼠于屏障系统下喂饲维持饲料观察5 d。造模两次,每次造模选用72 只动物,使用随机数字法将大鼠分成模型组和对照组,模型组60 只动物,对照组12 只。动物按组别群养,4 只/盒,自由进食及饮水。本文将实验动物分组当天定义为第0 天。
1.3.3 饲料给予
模型组大鼠给予模型饲料,对照组大鼠给予维持饲料,饲料不限量。
1.3.4 动物体重测量
第一次造模于第0 天,第7 天对动物进行称重;第二次造模于第0 天、第7 天、第13 天对动物进行称重。计算动物体重增长率(体重增重/实验结束时体重×100%)。
1.3.5 血液生化指标测定
两次造模分别于给予模型饲料后第8 天及第14 天进行不禁食采血。采血前使用大鼠固定板对动物进行固定,使用一次性注射器(2.5 mL)经颈静脉窦采血。全自动生化分析仪测定血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白-胆固醇(LDL-C)、高密度脂蛋白-胆固醇(HDL-C)。
1.3.6 组织病理学检查
股动脉放血处死动物,取肝用福尔马林溶液固定,用刀片切取3~5 mm 边缘齐整的组织经梯度乙醇脱水、二甲苯透明、石蜡包埋、组织切片、常规脱蜡、HE 染色、脱水及封片后,在光学显微镜下观察、摄像。
1.4 统计学方法
采用SPSS(V20.0)对各项检测数据绘制Q-Q图、计算偏度值、峰度值和标准误,判断其是否服从正态分布。计算Pearson 相关系数r并进行分级。当r的绝对值大于等于0.7 时,两变量为高度相关;当r的绝对值大于等于0.4,小于0.7 时,两变量为中度相关;当r的绝对值小于0.4 时,为低度相关[11]。计量资料采用平均数±标准差()表示,组间差异采用t检验进行比较。检验水准α=0.05。
2 结果
2.1 正态性分析
通过绘制Q-Q 图以及综合各组数据分布的偏度值、峰度值和标准误对数据资料进行正态性分析,动物实验前后体重、体重增长率及血液生化指标测定结果(TC、TG、LDL-C、HDL-C)均服从正态分布。
2.2 体重及血液生化指标的测定
记录第一次造模第0 天和第7 天以及第二次造模第0 天、第7 天和第13 天动物体重,计算造模结束时动物体重增长率,检测造模结束后大鼠血脂水平并进行统计,结果详见表1、表2。
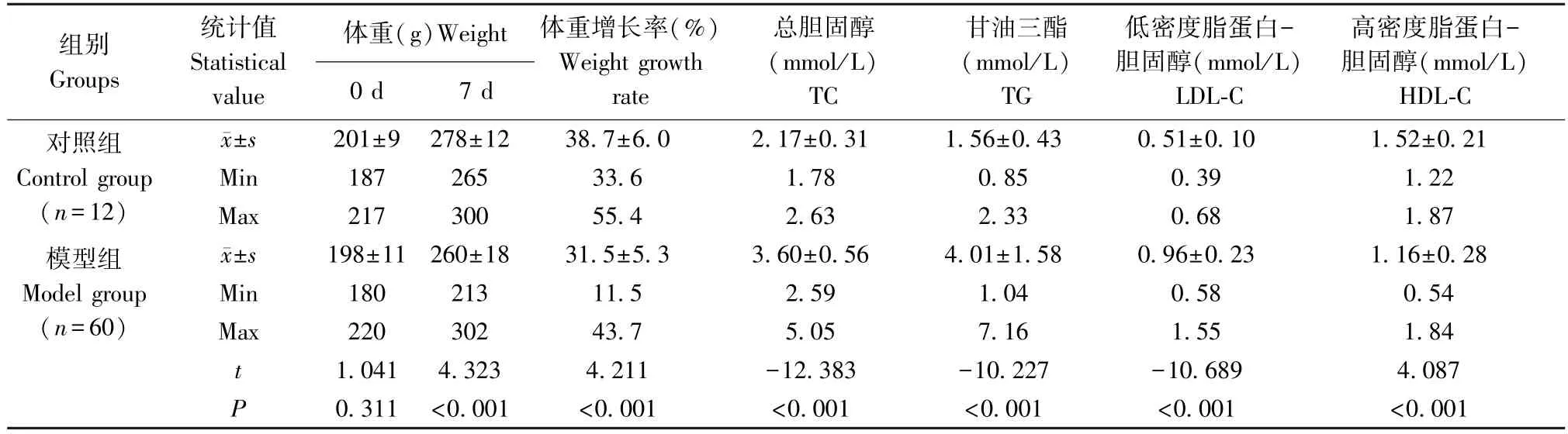
表1 第一次造模(8 d)动物体重及血液生化指标测定结果Table 1 Results of body weight and blood biochemical indexes in the first modeling (8 days)
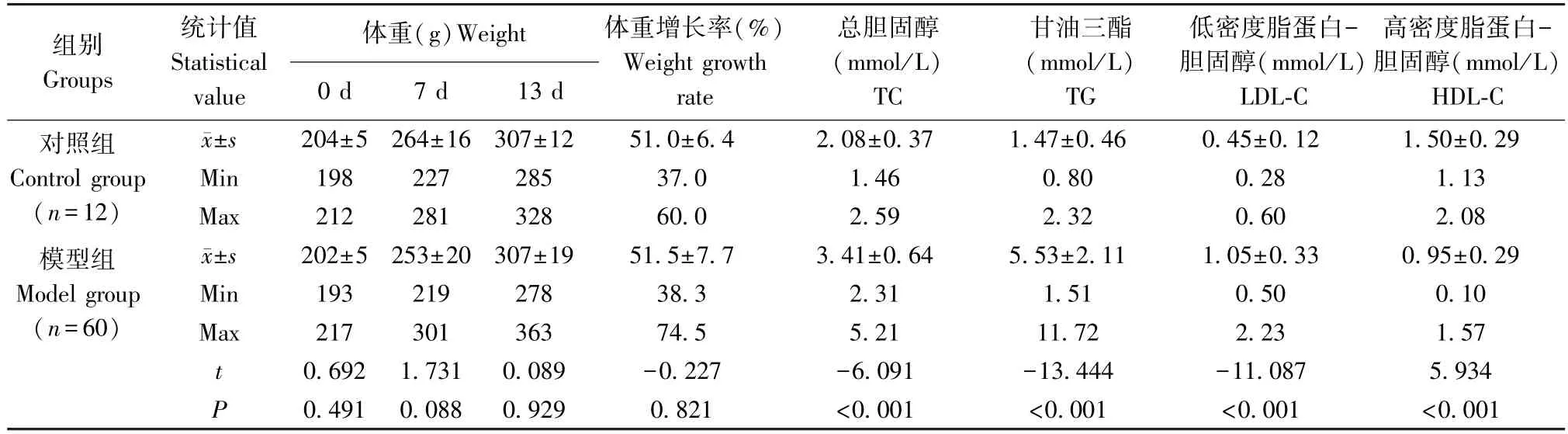
表2 第二次造模(14 d)动物体重及血液生化指标测定结果Table 2 Results of body weight and blood biochemical indexes in the second modeling (14 days)
2.3 单次造模模型组与对照组数据比较
第一次造模,模型组与对照组动物第0 天体重差异无统计学意义(P>0.05)。造模第7 d,模型组动物体重低于对照组,差异有统计学意义(P<0.01);模型组TC、TG、LDL-C 值均高于对照组,模型组HDL-C 值低于对照组,差异均有统计学意义(P<0.01)。
第二次造模,模型组与对照组动物体重不同时间点比较差异均无统计学意义(P>0.05);模型组TC、TG、LDL-C 值均高于对照组,模型组HDL-C 值低于对照组,差异均有统计学意义(P<0.01)。
2.4 两次造模模型间数据比较
两次造模对照组之间TC、TG、LDL-C、HDL-C 值差异均无统计学意义(P>0.05)。两次造模模型组之间TC、LDL-C 差异无统计学意义(P>0.05);造模14 d 模型组TG 均值为造模8 d 模型组均值的137.8%,造模14 d 模型组HDL-C 均值为造模8 d模型组均值的81.5%,差异有统计学意义(P<0.01)。
2.5 各项检测指标相关性分析
结果显示:两次造模对照组动物TC/LDL-C、TC/HDL-C、LDL-C/HDL-C 均呈正相关(P<0.01);模型组动物TC/TG、TC/LDL-C、TG/LDL-C、TG/体重增长率均呈正相关(P<0.05 或P<0.01),TG/HDL-C 均呈负相关(P<0.01)。其余检测指标无相关性(P>0.05)。相关程度详见表3、表4。
2.6 肝组织病理学检查结果
正常对照组可见肝组织结构正常,肝窦清晰可见,肝索排列整齐,肝细胞核位于细胞中央,细胞质丰富。
给予模型饲料8 d 后,肝出现弥漫性水样改变,肝窦受压,肝索尚正常,肝细胞胞浆肿大疏松化。
给予模型饲料14 d 后,肝出现弥漫性水样改变伴轻度脂肪变性(脂变程度小于1/3),肝窦变窄,肝索排列紊乱,肝细胞胞浆肿大疏松化、出现小脂滴。详见图1。
3 讨论
近年来,我国对于化学物质诱导形成高血脂动物模型的研究有诸多报道,研究发现不同的动物品系、年龄、体重、饲养环境,不同高脂饲料配方以及采用不同检测方法等影响因素对建模成功时间以及检测指标结果有较大影响[12-15]。因此,对于保健品和药物研发者而言,针对各种研究及实践的需要筛选出合适的高血脂动物模型,并依此在国内制定完善的标准非常必要且迫切。对于第三方检测实验室而言,掌握模型的特点和变化规律,及时建立规范化的历史背景值参考体系,对于准确评估实验结果,得出正确的实验结论有重要意义。
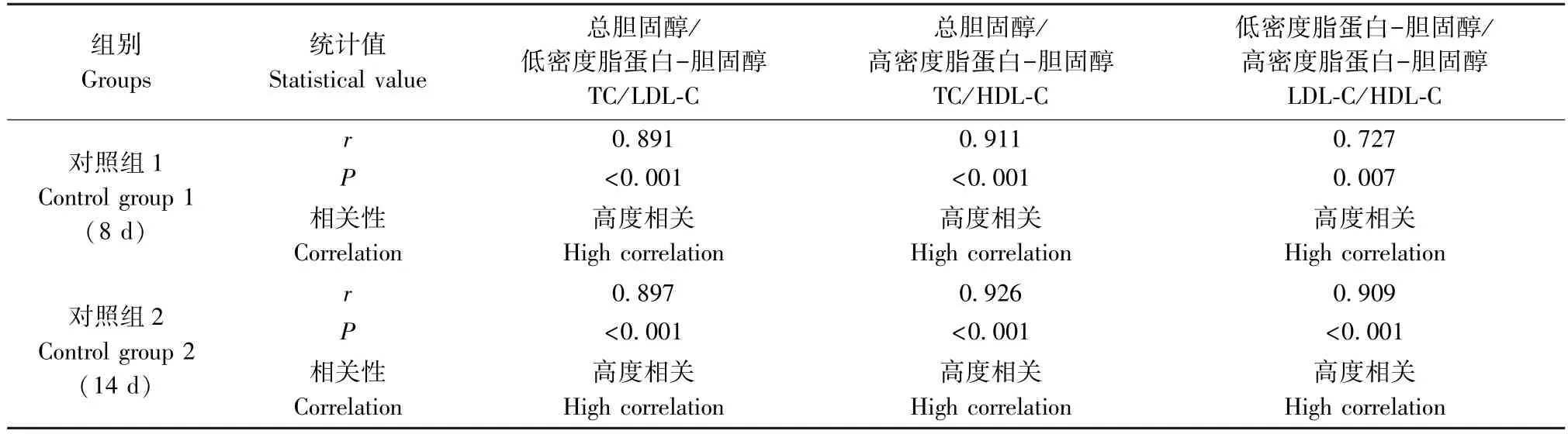
表3 两次造模对照组动物体重增长率及血液生化指标相关性分析Table 3 Correlation analysis of body weight growth rate and blood biochemical indexes in two control groups
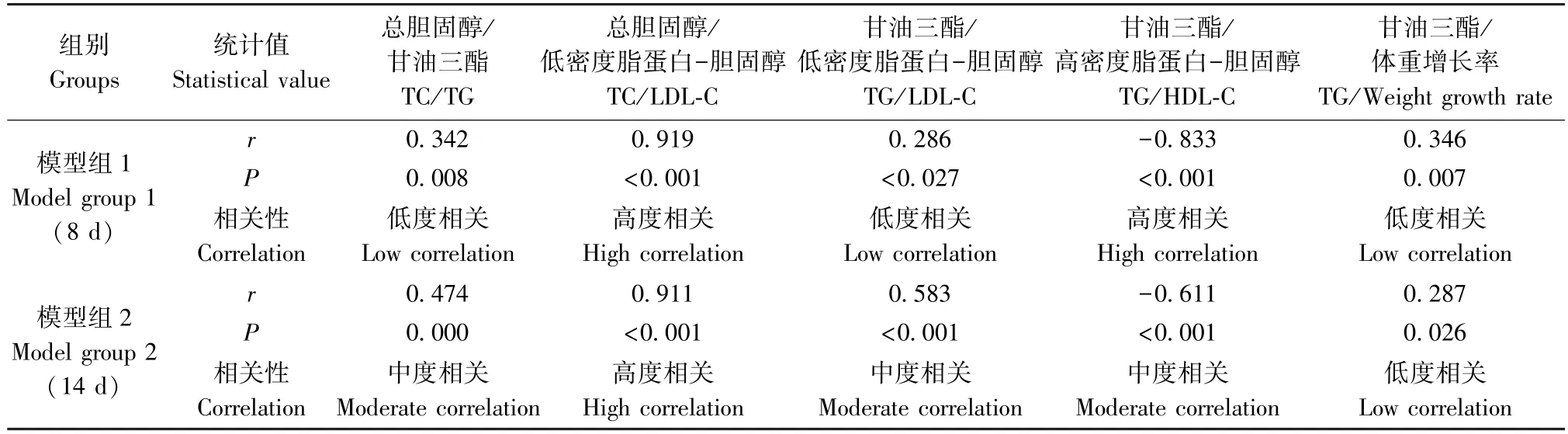
表4 两次造模模型组动物体重增长率及血液生化指标相关性分析Table 4 Correlation analysis of body weight growth rate and blood biochemical indexes in two modeling groups
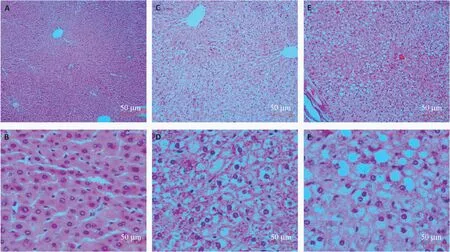
图1 大鼠肝组织病理学检查结果Note.A,Control group.B,Control group.C,Modeling for 8 days.D,Modeling for 8 days.E,Modeling for 14 days .F,Modeling for 14 days.Figure 1 Histopathological examination of rat liver
本研究比较了短期内依照相同标准在相同环境条件下进行的两次造模,除动物批次及造模时间不一致,其余研究因素均相同。研究的主要目的在于检验在1~2 周时间内,本实验室是否可以依据标准建立稳定可靠的降血脂大鼠模型,为建立实验室历史背景值提供参考。
据报道,当TG>4.52 mmol/L 时,Friedewald 公式计算法、改良Friedewald 公式计算法及新公式计算法均不能准确估算LDL-C 值[16]。本研究中,两次造模模型组TG>4.52 mmol/L 的动物数量分别占总数的31%和47%,故高血脂模型LDL-C 值一律采用直接测定法获得。
两次造模模型组动物血清TC、TG、LDL-C 值均高于对照组,模型组HDL-C 值均低于对照组;造模时间延长,TG 水平增高,HDL-C 水平降低。以上结果表明两次造模SD 大鼠高脂血症模型均建立成功,且均为混合型高脂血症模型[7]。
本研究中模型组与对照组动物TC 及LDL-C 结果基本平行,且两个指标在模型组和对照组中均体现出较强的相关性。摄入高脂饲料后,模型组动物TG 与TC、LDL-C、HDL-C、体重增长率出现不同程度相关,可能因为TG 值较其它指标更易受饮食或时间等因素影响;而模型组HDL-C 与TC、LDL-C 相关性消失,或可部分归因于高TG 血症与HDL-C 降低的相关性,有待进一步研究;经比较,两次造模各项指标相关性趋势高度一致。以上结果与诸骏仁等[2]的报道基本相符。结果显示,模型组动物体重增长率仅与TG 值存在相关性且呈弱相关,说明该方法所用饲料可明显改变动物血脂水平,但对动物体重影响较小。
当造模时间为8 d 时,模型组动物第7 天体重低于对照组,差异有统计学意义(P<0.01);当造模时间为14 d 时,模型组与对照组动物体重不同时间点比较差异虽无统计学意义(P>0.05),但第7 天体重绝对值低于对照组(P=0.088)。基于此现象,如果研究中动物体重为模型应用阶段重要分析指标,研究者可通过在造模阶段增加动物数、造模结束后将体重纳入筛选指标等手段,尽可能消除因造模产生的动物体重差异。郑立新等[9]认为动物体重波动可能因为动物脂代谢紊乱、形成脂肪肝从而影响动物摄食所致;而胡慧明等[17]提出因饲料具有高糖、高脂的特点,从而导致短期内部分动物不适应产生厌食。如果模型组动物的饮水量、摄食量低于对照组,说明短时间内可能因为饲料口感等原因导致动物的摄食量降低从而影响动物生长;如果模型组动物的饮水、摄食情况与对照组比较无差异,说明该饲料并不会引起动物厌食,动物体重波动可能来自代谢紊乱。因本研究未对动物饮水及进食情况进行监测,故无法准确判断动物体重波动原因。
病理组织学结果表明,使用高脂饲料喂养动物8 d 和14 d 均可诱发肝病理性改变,且病变程度与造模时间呈正相关。证明短时间内大量使用含有胆固醇、蔗糖、猪油、胆酸钠的饲料喂养动物可诱发急性肝损伤从而形成脂代谢紊乱。
综上所述,本研究所用的造模方法在8~14 d内均可建立SD 大鼠混合型高脂血症模型,该方法建立的模型具有造模时间短、关键指标稳定以及重现性好的特点。可广泛应用于饮食因素对血脂影响的研究、辅助降血脂功能保健食品以及调血脂药物的开发应用。本研究结果既可为本实验室相似研究提供依据,又可为将来制定参考值范围以及相关标准提供参考。
