hsa_circ_0005692 吸附miR-625-5p 调节CXXC4 的表达而抑制胃癌的转移
2021-03-19包和婧邓天伟
张 力 包和婧∗ 邓天伟 张 寒 李 刚
(1.重庆大学附属三峡医院(三峡中心医院)肿瘤分院肿瘤消化科,重庆 404000;2.重庆大学附属三峡医院(三峡中心医院)消化内科,重庆 404000)
胃癌是胃肠道恶性肿瘤中最常见的恶性肿瘤之一,是全球死亡率最高的癌症之一[1-2]。胃癌早期不易诊断,且复发率和侵袭率高,造成胃癌发病率与病死率极高[3-4]。随着临床诊断与治疗的发展,胃癌的发病率和死亡率已稳步降低,但患者的总生存率仍低于29%[5-6]。因此,探究胃癌的发病机制对降低患者死亡率,提高生存率具有非常重要的指导意义。环状RNA(circRNA)是新近发现的内源性非编码RNA,其长度为数百甚至数千个碱基,具有共价封闭的结构[7-8]。大量研究表明,circRNA可调控多种癌症有关的生物学过程,包括细胞增殖、侵袭和转移等过程[9-11]。circRNA 在哺乳动物体内广泛存在,含量稳定,是目前肿瘤学等领域研究的热点之一[12],但hsa_circ_0005692作为circRNA成员之一,目前研究极少。经过查阅文献,我们仅发现一篇文献报道此circRNA。陈鑫等[13]认为hsa_circ_0005692 在胃癌组织和细胞中表达下调,且能抑制胃癌细胞增殖、迁移和侵袭。但hsa_circ_0005692 在胃癌发生中的调控关系,下游的调控网络等目前尚无研究报道。我们通过生信网站查询发现hsa_circ_0005692 和miR-625-5p 之间存在结合位点。miR-625-5p 在结直肠癌、胃癌、胶质细胞癌等恶性肿瘤的发生均具有调控作用,但miR-625-5p 在不同癌症中具有相反的表达趋势[14-16]。miR-625-5p 在胃癌中的表达调控机制目前尚无定论。此外,我们通过starbase 网站筛选miR-625-5p 的下游靶基因发现,miR-625-5p 和CXXC4 之间存在结合位点。且目前暂无研究报道miR-625-5p 和CXXC4 是否具有靶向调控关系。有研究报道CXXC4 可促进卵巢癌细胞化疗敏感性[17]。且有研究报道CXXC4 可能作为新的胃癌抑制因子,可通过诱导胃癌细胞凋亡,抑制胃癌发展[18]。
在本研究中,我们通过培养胃癌细胞,并进行相应处理,旨在探究hsa_circ_000569 在胃癌中的调控关系。
1 材料和方法
1.1 实验细胞
人胃癌细胞系SNU-1、BGC-803、NCI-N87、HS-746T 和胃黏膜上皮细胞GES-1(购于上海中乔新舟生物科技有限公司),在37℃,5% CO2条件下培养进行后续实验。
1.2 主要试剂
10%胎牛血清(批号:10100139C,美国Gibco 公司);链霉素(100 mg/mL)和青霉素(100 U/mL)的RPMI-1640 细胞培养液(批号:A1049101,美国Gibco 公司);Lipofectamine 2000(批号:11668-019,美国Invitrogen 公司);质粒(上海吉玛生物公司)。
1.3 实验方法
1.3.1 双荧光素酶实验
生物学预测网站进行miR-625-5p 的结合位点分析,验证是miR-625-5p 可结合hsa_circ_0005692和CXXC4,人工合成hsa_circ_000569 和CXXC4 3'UTR 基因片段构建到pMIR-reporter 中,在hsa_circ_000569 和CXXC4 野生型上设计种子序列的互补序列突变位点,构建到pMIR-reporter 报告质粒中。将测序正确的荧光素酶报告质粒WT、MUT 分别与miR-625-5p 共转染至SNU-1 细胞(上海北诺生物科技有限公司) 中。转染48 h 后,使用Dual-Luciferase Reporter Assay System (型 号:promegaE1910,美国Promega 公司)检测荧光素酶活性。
1.3.2 MTT 实验
各组SNU-1 细胞转染培养48 h 后,收集各组细胞进行细胞计数:以每孔5×103个细胞接种于96孔板中,培养箱中培养。24 h、48 h、72 h 时每孔加20 μL 5 mg/mL MTT 溶液,继续37℃孵育2 h 后终止培养;吸弃孔内培养上清液,每孔加150 μL DMSO;在酶联免疫检测仪570 nm 处读取各孔吸光度值(optical density,OD)值。
1.3.3 Transwell 实验检测细胞迁移和侵袭能力
细胞转染48 h 后用无血清的RPMI-1640 培养基重悬。迁移:取100 μL 细胞密度为3×105/mL 的细胞悬液加入24 孔transwell 小室的上室。侵袭:上室预先加入50 μL 基质胶,室温下风干4 h,取100 μL 细胞密度为3×105/mL 的细胞悬液加入24 孔transwell 小室的上室。24 孔transwell 下室每孔添加500 μL 含10% FBS 的RPMI-1640 培养基,放置于37℃、5% CO2培养箱24 h 后,用PBS 洗两遍,甲醇处理10 min,结晶紫处理10 min。取下小室纤维膜,封片,每组细胞取6 个随机视野在显微镜下拍照并计数。
1.3.4 流式细胞术检测细胞凋亡率
Annexin V-FITC/PI 双标染色检测细胞凋亡,将处理好的细胞置于37℃、5% CO2培养箱中培养48 h,收集细胞,PBS 溶液洗涤2 次后离心将细胞重悬于200 μL 结合缓冲液中,加入10 μL Annexin VFITC(批号:ab14085,英国Abcam 公司)和5 μL PI轻轻混匀,避光室温反应15 min,加入300 μL 结合缓冲液,用流式细胞仪以激发波长488 nm 检测细胞凋亡情况。实验重复3 次。
1.3.5 RIP 实验
采用RIP 试剂盒(型号:MAGNARIP02,美国millipore 公司)检测hsa_circ_0005692 与AGO2 蛋白结合情况。收集胃癌细胞后裂解,细胞提取液与抗体孵育进行共沉淀,取50 μL 磁珠清洗后重悬于100 μL RIP Wash Buffer 中加入5 μg 抗体AGO2(批号:ab32381,1 ∶50,英国Abcam 公司),IgG(1 ∶100,批号:ab109489,英国Abcam 公司)孵育。磁珠-抗体复合物经清洗后与重悬于900 μL RIP Wash Buffer,加入100 μL 细胞提取液4℃孵育过夜。样品经蛋白酶K 消化后提取RNA,qRT-PCR 检测hsa_circ_0005692 表达水平。
1.3.6 RNA pull-down
转染WT 生物素化的和MUT 生物素化的miR-625-5p 的胃癌细胞48 h 后,细胞裂解液(批号:ab95401,英国Abcam 公司)裂解,将裂解物与预涂了RNase-free 和酵母tRNA 的M-280 链霉亲和素磁珠(批号:112-06D,美国Invitrogen 公司)4℃,孵育3 h,然后用冷裂解液洗涤两次,用低盐缓冲液和高盐缓冲液分别洗3 次和1 次,结合的RNA 通过TRIzol 纯化,qRT-PCR 检测hsa_circ_0005692 表达水平。
1.3.7 Western blot 检测
收集细胞,RIPA 裂解液(批号:AR0105-30,武汉博士徳公司)进行裂解,然后用BCA 蛋白定量试剂盒(70-PQ0012,MultiSciences,中国杭州)进行蛋白浓度的测定。蛋白溶于2×SDS 上用10% SDSPAGE 分离,转移至PVDF 膜,5%脱脂奶粉室温封闭1 h,PBS 冲洗2 min,将PVDF 膜与稀释的一抗CXXC4(1 ∶1000,批号:ab105400,英国abcam 公司),N-cadherin(1 ∶1000,批号:ab76057,英国abcam公司),MMP9(1 ∶1000,批号:ab38898,英国abcam公司),GAPDH(1 ∶2000,批号:ab 9485,英国abcam公司)4℃过夜,TBST 洗涤3 次每次5 min,1 ∶100 稀释的 HRP 标记二抗羊抗鼠 IgG 抗体(批号ab 205719;1 ∶2000;英国Abcam 公司)孵育1 h。取ECL 荧光检测试剂盒(批号:BB -3501,英国Ameshame 公司)中等量的A 液和B 液,暗室中混匀,将其滴加膜上,放入凝胶成像仪中曝光成像。用Bio-Rad 图象分析系统(型号:Gel Doc XR+,美国BIO-RAD 公司)照相,GAPDH 作为内参,用Quantity One v4.6.2 软件分析。
1.3.8 qRT-PCR 检测
使用TRIzol 试剂盒(批号:15596026,美国Invitrogen 公司)提取总RNA,按照PrimeScript RT reagent Kit(批号:RR047 A,日本TaKaRa 公司)说明书将总的RNA 反转录成cDNA,对合成的cDNA 用Fast SYBR Green PCR 试剂盒(批号:BL705A,Biosharp 公司)与ABI PRISM 7300 RT-PCR 系统(型号:ABI7300,美国ABI 公司)进行qRT-PCR 检测,每个孔均设置3 个重复。本实验中用U6 作为miR-625-5p的内参,GAPDH作为其他基因的内参,采用相对定量法(2-△△CT法)计算hsa_circ_0005692、miR-625-5p和CXXC4 的相对转录水平:△△Ct=△Ct实验组-△Ct对照组,△Ct=Ct(目的基因)-Ct(内参),目的基因的相对转录水平=2-△△Ct。每次实验重复3 次。引物设计如表1 所示。
1.4 统计学方法
采用SPSS 21.0 版本(IBM 公司,USA)用于统计分析。计量数据采用平均数±标准误差(¯x±s¯x)表示,两组间比较采用非配对t检验。多组间数据比较采用One-way ANOVA,Tukey’s 进行事后检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 胃癌细胞中hsa_circ_0005692 和CXXC4 呈低表达,而miR-625-5p 呈高表达
qRT-PCR 检测人胃癌细胞系BGC-803、SNU-1、NCI-N87、HS-746T 和胃黏膜上皮细胞GES-1 中hsa_circ_0005692、miR-625-5p和CXXC4 mRNA 表达,Western blot 检测CXXC4 蛋白表达,结果显示(图1):与胃黏膜上皮细胞GES-1 相比,人胃癌细胞系BGC-803、SNU-1、NCI-N87、HS-746T 中hsa_circ_0005692、CXXC4 mRNA 和蛋白表达均降低,而miR-625-5p的表达均增加(P<0.05),其中SNU-1中hsa_circ_0005692 表达最低,选为后续细胞学实验验证的细胞。
2.2 hsa_circ_0005692 吸附miR-625-5p 调控CXXC4
https://circinteractome.nia.nih.gov/index.html和http://starbase.sysu.edu.cn/index.php 分别预测hsa_circ_0005692 和miR-625-5p 及miR-625-5p和CXXC4 的结合位点(图2A、2B),双荧光素酶报告如图2C、2D 显示:与NC mimic 组比较,miR-625-5p mimic 组中hsa_circ_0005692 野生型和CXXC4野生型与miR-625-5p 特异结合区域的荧光素酶活性均受到抑制(P<0.05),而hsa_circ_0005692 突变型和CXXC4 突变型的荧光素酶活性无明显的变化(P>0.05),说明miR-625-5p 可分别与hsa_circ_0005692 和CXXC4 结合。RNA-pull down 实验如图2E 所示,相比于MUT-miR-625-5p 和Bio-NC 组,WT-miR-625-5p 结合的hsa_circ_0005692 表达量明显增加(P<0.05),表明miR-625-5p 可直接结合hsa_circ_0005692。RNA 免疫共沉淀(RIP)实验结果显示(图2F):在SNU-1 细胞内,抗AGO2 的抗体可将hsa_circ_0005692 沉淀下来,表明hsa_circ_0005692 可与AGO2 形成复合物,从而竞争性结合miR-625-5p。上述结果表明,在胃癌中hsa_circ_0005692 可能通过吸附miR-625-5p 从而调控CXXC4 基因的表达。
2.3 过表达hsa_circ_0005692 或沉默miR-625-5p 抑制胃癌细胞增殖
在胃癌细胞SNU-1 中,对hsa_circ_0005692 进行过表达或者对miR-625-5p 进行沉默处理,或在过表达hsa_circ_0005692 的细胞中上过表达miR-625-5p 或者沉默CXXC4 基因,从而来研究hsa_circ_0005692 可能通过吸附miR-625-5p 调控CXXC4对胃癌细胞生物学活性的影响。MTT 检测各组细胞增殖情况,结果表明(图3):与pcDNA-NC 组相比,在48 h 和72 h 时pcDNA-hsa_circ_0005692 组胃癌细胞SNU-1 的增殖能力下降(P<0.05);与NC inhibitor 相比,在48 h 和72 h 时miR-625-5p inhibitor 组胃癌细胞SNU-1 的增殖能力显著受到抑制(均P<0.05);与pcDNA-hsa_circ_0005692 组相比,在48 h 和72 h 时pcDNA-hsa_circ_0005692 +miR-625-5p mimic 组和pcDNA-hsa_circ_0005692 +si-CXXC4 组胃癌细胞SNU-1 增殖能力显著增加(均P<0.05)。以上结果表明过表达hsa_circ_0005692 或沉默miR-625-5p 抑制胃癌细胞增殖,而miR-625-5p 的过表达或CXXC4 的沉默可逆转hsa_circ_0005692 过表达对胃癌细胞增殖的抑制作用。
2.4 过表达hsa_circ_0005692 或沉默miR-625-5p 抑制胃癌细胞迁移侵袭能力
Transwell 实验检测各组细胞迁移和侵袭能力,结果表明(图4):与pcDNA-NC 组相比,pcDNA-hsa_circ_0005692 组胃癌细胞SNU-1 的迁移和侵袭数目下降(P<0.05);与NC inhibitor 相比,miR-625-5p inhibitor 组胃癌细胞SNU-1 的迁移和侵袭数目减少(P<0.05);与pcDNA-hsa_circ_0005692 组相比,pcDNA-hsa_circ_0005692+miR-625-5p mimic组和pcDNA-hsa_circ_0005692+si-CXXC4 组胃癌细胞SNU-1 的迁移和侵袭数目明显增加(P<0.05)。以上结果表明过表达hsa_circ_0005692 或沉默miR-625-5p 抑制胃癌细胞迁移和侵袭能力,而miR-625-5p 的过表达或CXXC4 的沉默可逆转hsa_circ_0005692 过表达对胃癌细胞迁移和侵袭的抑制作用。
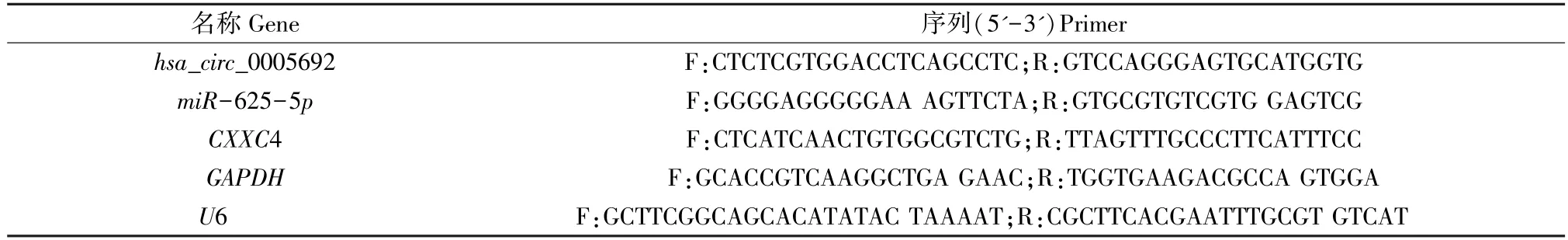
表1 引物序列Table 1 Primer sequence
2.5 过表达hsa_circ_0005692 或沉默miR-625-5p 促进胃癌凋亡
流式细胞术实验检测各组细胞凋亡情况,结果表明(图5):与pcDNA-NC 组相比,pcDNA-hsa_circ_0005692 组胃癌细胞SNU-1 的凋亡率增加(均P<0.05);与NC inhibitor 相比,miR-625-5p inhibitor组胃癌细胞SNU-1 的凋亡率增加(均P<0.05);与pcDNA-hsa_circ_0005692 组相比,pcDNA-hsa_circ_0005692+miR-625-5p mimic 组和pcDNA-hsa_circ_0005692+si-CXXC4 组胃癌细胞SNU-1 的凋亡率显著降低(均P<0.05)。以上结果表明过表达hsa_circ_0005692 或沉默miR-625-5p 促进胃癌细胞凋亡,而miR-625-5p 的过表达或CXXC4 的沉默可逆转hsa_circ_0005692 过表达对胃癌细胞凋亡的促进作用。
2.6 hsa_circ_0005692 吸附miR-625-5p 调节CXXC4 的表达而抑制胃癌的转移

图1 hsa_circ_0005692、CXXC4 和miR-625-5p 在胃癌细胞中表达Note.A,hsa_circ_0005692 and miR-625-5p expression as well as the mRNA expression of CXXC4 in SNU-1,BGC-803,NCI-N87,HS-746T and GES-1 cells determined by qRT-PCR.B/C,Western blot detected the expression of CXXC4 protein in human gastric cancer cell lines SNU-1,BGC-803,NCI-N87,HS-746T and gastric mucosal epithelial cell GES-1.Compared with the GES-1 group,∗P <0.05.Figure 1 Expression of hsa_circ_0005692,CXXC4 and miR-625-5p in gastric cancer cells

图2 hsa_circ_0005692 吸附miR-625-5p 调控CXXC4 Note.A,Binding sites between hsa_circ_0005692 and miR-625-5p.B,Binding sites between CXXC4 and miR-625-5p.C,Binding relationship between hsa_circ_0005692 and miR-625-5p verified by dual-luciferase assays.D,Binding relationship between CXXC4 and miR-625-5p verified by dual-luciferase assays.Compared with NC mimic group,∗P<0.05.E,Binding relationship between hsa_circ_0005692 and miR-625-5p validated by RNA pull-down.Compared with Bio-NC group,∗P <0.05.F,hsa_circ_0005692 binding to AGO2 protein verified by RIP assays.Figure 2 hsa_circ_0005692 adsorbed miR-625-5p to regulate CXXC4

图3 MTT 检测细胞增殖情况Note.Compared with pcDNA-NC group,∗P<0.05.Compared with NC inhibitor group,#P <0.05.Compared with pcDNA-hsa_circ_0005692 group,&P<0.05.Figure 3 Cell proliferation was detected by MTT
qRT-PCR 检测hsa_circ_0005692、miR-625-5p和CXXC4 mRNA 的表达,Western blot 检测CXXC4和迁移侵袭相关因子N-cadherin 和MMP9 蛋白表达,结果显示(图6A、6B):与pcDNA-NC 组相比,pcDNA-hsa_circ_0005692 组胃癌细胞中hsa_circ_0005692、CXXC4 mRNA 和蛋白表达显著增加,miR-625-5p 表达及迁移侵袭相关因子N-cadherin 和MMP9 蛋白表达量均明显降低(均P<0.05);与NC inhibitor 相比,miR-625-5p inhibitor 组胃癌细胞中hsa_circ_0005692 表达无显著变化(P>0.05),miR-625-5p 表达显著减少,CXXC4 mRNA 和蛋白表达显著增加,N-cadherin 和MMP9 蛋白表达量均明显降低(均P<0.05);与pcDNA-hsa_circ_0005692 组相比,pcDNA-hsa_circ_0005692+miR-625-5p mimic 组胃癌细胞中hsa_circ_0005692 表达无显著变化(P>0.05),miR-625-5p 表达显著增加,CXXC4 mRNA 和蛋白表达显著减少,N-cadherin和MMP9 蛋白表达量均明显增加(均P<0.05);与pcDNA-linc 00261 组相比,pcDNA-hsa_circ_0005692+si-CXXC4 组胃癌细胞hsa_circ_0005692 和miR-625-5p 变化无显著差异(均P>0.05),CXXC4 mRNA 和蛋白表达显著减少,N-cadherin 和MMP9蛋白表达量均明显增加(P<0.05)。
以上结果表明hsa_circ_0005692 通过吸附miR-625-5p,从而负调控CXXC4 基因,进而抑制胃癌细胞的迁移和侵袭。

图4 Transwell 实验检测细胞迁移和侵袭能力Note.A/B,Representative images and statistical analysis of SNU-1 cell migration.C/D,Representative images and statistical analysis of SNU-1 cell invasion.Compared with pcDNA-NC group,∗P <0.05.Compared with NC inhibitor group,#P <0.05.Compared with pcDNA-hsa_circ_0005692 group,&P<0.05.Figure 4 The ability of migration and invasion detected by Transwell
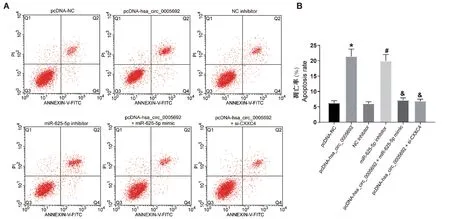
图5 流式细胞术检测细胞凋亡率Note.Compared with pcDNA-NC group,∗P <0.05.Compared with NC inhibitor group,#P <0.05.Compared with pcDNA-hsa_circ_0005692 group,&P<0.05.Figure 5 The apoptosis rate was detected by flow cytometry
3 讨论
胃癌是常见的恶性肿瘤,具有致死率高、复发率高和远处转移率高等特点[19]。阐明胃癌的发病机制对治疗胃癌具有非常关键的作用。越来越多的研究表明,哺乳动物中丰富的circRNA 与神经系统疾病、心血管疾病、骨科疾病和各种癌症关系密切[20-21]。和线性RNA 不同的是,circRNA 形成了一个不含5’-3’极性或聚腺苷酸末端的闭环连续环结构。circRNA 在人体细胞中存在广泛表达,对基因转录后水平表达的调控具有重要作用[22-24]。仅有一篇文献表示hsa_circ_0005692 可促进胃癌增殖、迁移和侵袭[13]。而目前尚无研究报道hsa_circ_0005692 在胃癌中的调控机制。在本研究中,我们首先通过培养胃黏膜上皮细胞GES-1 和人胃癌细胞系BGC-803、SNU-1、NCI-N87、HS-746T,检测hsa_circ_0005692 在正常胃黏膜上皮细胞和胃癌细胞系中的表达情况,结果显示hsa_circ_0005692 在胃癌细胞中表达下调。且hsa_circ_0005692 可抑制胃癌细胞增殖、迁移和侵袭,并促进细胞凋亡。这与陈鑫等[13]研究结果一致。
circRNA 在癌症中发挥关键的调控作用,大多数研究表明circRNA 具有组织和发育阶段的特异性表达,且充当microRNA 的sponge RNA 来隔离microRNA,从而影响影响靶mRNA 的稳定性并动态调节mRNA 的翻译[25-26]。为此,我们通过Circular RNA Interactome 筛选发现hsa_circ_0005692 与miR-625-5p 之间存在结合位点。miR-625-5p 在癌症中的调控作用并无明确定论,有研究表明,miR-625-5p 在肿瘤中发挥抑癌作用,抑制癌症增殖、迁移和侵袭。但另外也有研究表明miR-625-5p 发挥促癌作用[27-28]。在本研究中,我们发现hsa_circ_0005692可作为sponge RNA,竞争性结合miR-625-5p。而miR-625-5p 沉默后会抑制胃癌细胞增殖、迁移和侵袭能力,并促进细胞凋亡。且我们研究证实miR-625-5p 过表达可阻断hsa_circ_0005692 对胃癌细胞增殖、迁移和侵袭的抑制作用。这表明miR-625-5p 有可能作为促癌因子,在胃癌中发挥促癌作用。
为进一步探究miR-625-5p 在胃癌中的调控机制,我们通过生信网站筛选miR-625-5p 下游的可能靶基因。我们发现CXXC4 和miR-625-5p 之间存在结合位点,双荧光素酶报告实验也证实miR-625-5p 和CXXC4 之间具有靶向调控关系。CXXC4是CXXC 指蛋白,研究表明CXXC4 可能是一个新的胃癌抑制因子[29]。CXXC4 在上皮性卵巢癌、口腔鳞状细胞癌等多种恶性肿瘤中均表达下调[30-31]。我们研究也表明CXXC4 沉默后会阻断hsa_circ_0005692 对胃癌细胞增殖、迁移和侵袭的抑制作用。
综上所述,我们发现hsa_circ_0005692 在胃癌细胞中表达下调,并且可通过吸附miR-625-5p,从而上调miR-625-5p 靶基因CXXC4 的表达,进而抑制胃癌细胞增殖、迁移和侵袭,并促进其凋亡。本研究我们探究hsa_circ_000569 在胃癌中的调控机制,进一步完善胃癌的发病机制,为探究胃癌中的发病机制提供了新的研究方向,为临床治疗提供了新的理论指导。但我们目前暂未进行动物实验,无法进一步证实hsa_circ_0005692 在体内的调控机制。且是否适用于临床治疗,仍需更多实验探究。

图6 hsa_circ_0005692 吸附miR-625-5p 调节CXXC4 的表达而抑制胃癌的转移Note.A,hsa_circ_0005692 and miR-625-5p expression as well as the mRNA expression of CXXC4 in cells after transfection determined by qRTPCR.B,The protein expression of CXXC4 in cells after transfection determined by Western blot.Compared with pcDNA-NC group,∗P <0.05.Compared with NC inhibitor group,#P <0.05.Compared with pcDNA-hsa_circ_0005692 group,&P<0.05.Figure 6 hsa_circ_0005692 adsorbed miR-625-5p to regulate the expression of CXXC4 and inhibit the metastasis of gastric cancer
