脐静脉内皮细胞外泌体对炎症因子刺激下前软骨细胞凋亡的影响
2021-03-19杨润泽许文宁郑火亮蒋盛旦
杨润泽,许文宁,郑火亮,蒋盛旦
上海交通大学医学院附属新华医院脊柱中心,上海200092
骨关节炎(osteoarthritis,OA)是全球较常见的关节疾病。据报道,约10%的男性和13%的女性在60 岁以上会发生膝关节OA[1]。由于人口老龄化和肥胖症的增多,OA 的发病率也不断增加[2]。OA 患者常伴有关节软骨进行性破坏、关节积液、行动能力丧失等[3]。软骨细胞是软骨中唯一的细胞类型,在OA 发病过程中会发生多种变化,例如增殖和分泌能力的改变[4]。软骨细胞的异常凋亡、炎症反应等与OA 中软骨降解有关[5-6]。因此,探讨软骨细胞功能障碍的机制有助于OA 的诊断和治疗。OA常常伴随有不同程度炎症的发生,在其炎症发展的过程中,白细胞介素-1β(interleukin-1β,IL-1β)发挥着重要的作用,可通过促进炎症介质前列腺素E2(prostaglandin E2,PGE2)及一氧化氮(nitric oxide,NO)等的释放激活炎症反应[7]。外泌体作为细胞内吞过程中主动分泌的直径为50~100 nm的囊泡,具有脂质双层膜结构,可以从不同的细胞类型中释放,并已被证明在细胞通信中起到重要作用。外泌体可以在血液及关节滑液中稳定存在[8]。越来越多的证据[9]表明,外泌体参与OA、类风湿关节炎等关节疾病的发展。外泌体分泌或摄取失调可以导致急慢性炎症,继而引起软骨变性和关节破坏[10]。血管内皮细胞在人体内广泛分布,其分泌的外泌体对多种疾病的发生发展有重要作用,例如骨质疏松、糖尿病等[11-12],但血管内皮细胞分泌的外泌体在OA中的作用未有详细报道。本研究利用IL-1β 刺激前软骨细胞建立OA 体外模型,探究血管内皮细胞分泌的外泌体对于OA的影响。
1 材料与方法
1.1 主要试剂
DMEM 高糖细胞培养液购自美国Hyclone公司,胎牛血清(fetal bovine serum,FBS)购自美国Gibco 公司,IL-1β 购自上海达科为生物技术公司,活性氧(reactive oxygen species,ROS)检测试剂盒购自上海翊圣生物科技公司,RIPA 裂解液、BCA 试剂盒、电化学发光(electrochemiluminescence,ECL)显影试剂、4%多聚甲醛固定液、Annexin V-FITC 细胞凋亡检测试剂盒、C1090 一步法末端脱氧核糖核酸转移酶介导的dUTP 缺口末端标记法(TdT mediated dUTP nick end labeling,TUNEL)细胞凋亡检测试剂盒、羊抗兔二抗和羊抗鼠二抗购自上海碧云天生物技术公司,白细胞分化抗原9(cluster differentiation 9,CD9; 20597-1-AP)、 凋 亡 相 关 基 因2 互 作 蛋 白X(apoptosis linked gene-2-interacting protein X,Alix;12422-1-AP)、肿瘤易感基因101(tumor susceptibility gene 101,Tsg101;14497-1-AP)、裂解的半胱天冬酶3 (cleaved caspase-3,c-caspase-3;19677-1-AP)、B淋巴细胞瘤2(Bcell lymphoma/leukemia-2,Bcl-2;12789-1-AP)、Bcl-2相关X 蛋 白(Bcl-2 associated X protein,Bax;50599-2-Ig)、Kelch 样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1,Keap-1;10503-2-AP)、核因子E2 相关因子2(nuclear factor E2 related factor 2,Nrf-2;16396-1-AP)、βactin(66009-1-Ig)抗体购自中国Proteintech公司,血红素加氧酶1(heme oxygenase 1,HO-1;sc-390991)、还原型烟酰胺腺嘌呤二核苷酸醌氧化还原酶1(NADPH quinone oxidoreductase-like protein 1,NQO-1;sc-32793)抗体购自美国Santa Cruz 公司,总外泌体分离试剂盒购自美国Invitrogen公司。
1.2 细胞培养
人脐静脉内皮细胞 (human umbilical vein endothelial cell,HUVEC)、小鼠前软骨细胞株ATDC5 购自ATCC 公司。细胞培养于完全培养基(DMEM 高糖培养液,含10% FBS、100 U/mL 青霉素、100 U/mL 链霉素)中,在37 ℃、5% CO2环境下常规培养,培养2~3 d根据细胞生长情况换液。其中HUVEC常规培养至细胞密度达80%以上时更换为无血清DMEM 高糖培养基,继续培养48 h后收集细胞培养液。
1.3 外泌体的分离与鉴定
1.3.1 外泌体分离方法 收集2×107个HUVEC 的培养液,按照试剂盒说明书分离外泌体。4 ℃、500×g 离心5 min 后收集上清液,4 ℃、2 000×g 离心1 h 后,丢弃沉淀,吸取上清液后,与一半体积的试剂盒中的外泌体提取液混匀后,4 ℃过夜。第2日,4 ℃、10 000×g离心1 h后,去除上清液,用1 mL 无菌磷酸盐缓冲液(phosphate buffer saline,PBS)重悬沉淀,再次4 ℃、10 000×g 离心70 min 后,弃上清液,用200 μL PBS 溶解沉淀即可获得外泌体。
1.3.2 透射电镜观察外泌体形态 取新鲜提取的外泌体悬液10 μL,滴加到铜网上,室温过夜干燥后,使用乙酸双氧铀复染。随后透射电镜(美国Delong 公司)上机成像观察并拍照保存。
1.3.3 纳米颗粒跟踪分析 取100 μL外泌体悬液,用1×PBS 稀释10 倍后,置于比色皿中后放入粒度仪(新西兰Izon Science公司)中检测外泌体粒径分布。
1.3.4 Western blotting 检测外泌体标志物 向200 μL 外泌体悬液中加入含有蛋白酶抑制剂的RIPA 裂解液,冰上裂解30 min 后,4 ℃、12 000×g 离心10 min,取上清液。BCA 法测定蛋白浓度后。取适量5×十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白上样缓冲液,100 ℃煮10 min 后,冷却到室温。按照每孔20 μg 蛋白样品上样,设置80 V 电压电泳约30 min,调整电压到120 V,待溴酚蓝进入到凝胶底部终止电泳。选用PVDF 膜,湿转70 min,使用5%脱脂牛奶室温封闭1 h,一抗CD9(1∶1 000)、Alix (1∶1 000)、Tsg101(1∶1 000) 4 ℃孵育过夜。二抗(1∶2 000)室温孵育1 h,ECL 反应后,曝光显影并保存图像。
1.4 外泌体摄取实验
使用稀释后的PKH26 荧光染料(美国Sigma 公司),在避光条件下对20 μL 外泌体的磷脂双分子膜染色5 min后,加入等体积10%的牛血清白蛋白(bovine serum albumin,BSA)终止染色后重悬外泌体沉淀。将染色后的外泌体加入到ATDC5 培养液中分别培养3 h 和6 h。待共培养结束后,去除细胞培养上清液后,PBS 清洗;加入4%多聚甲醛避光固定后,DAPI 染细胞核,再次PBS清洗;加入抗荧光淬灭剂,荧光显微镜(德国Leica 公司)观察拍照。
1.5 细胞分组及处理方法
将ATDC5 细胞分为空白对照(NC)组、IL-1β 组、IL-1β+50 μg 外泌体组、IL-1β+100 μg 外泌体组。除了NC 组外,每组均加入10 ng/mL IL-1β,模拟OA 体外模型;其中IL-1β+50 μg 外泌体组和IL-1β+100 μg 外泌体组,再分别加入50 μg及100 μg外泌体,作用24 h。
1.6 细胞内ROS水平检测
将ATDC5 细胞培养于6 孔板上,待细胞密度为60%~70%时,分别加入500 μL PBS、10 ng/mL IL-1β、10 ng/mL IL-1β+50 μg外泌体、10 ng/mL IL-1β+100 μg外泌体,作用24 h 后,弃细胞培养液,PBS 洗涤,加入2',7'-二氯二氢荧光素二乙酸酯(2',7'-dichlorofluorescein-diacetate,DCFH-DA)荧光探针避光染色30 min,PBS 洗涤后荧光显微镜检测橙色荧光。
1.7 细胞凋亡检测
1.7.1 TUNEL 检测ATDC5 细胞凋亡 使用一步法TUNEL 细胞凋亡检测试剂盒检测细胞凋亡。ATDC5细胞按上述细胞处理方法处理完毕后,去除培养液,PBS 洗涤1次,4%多聚甲醛固定细胞30 min,PBS洗涤1次后加入免疫染色强力通透液室温孵育5 min。PBS 洗涤2 次,再加入配置好的TUNEL 检测液37 ℃避光孵育60 min,孵育结束后PBS 洗涤3 次,并使用DAPI 复染细胞核,荧光显微镜观察结果。
1.7.2 流式细胞术检测ATDC5细胞凋亡 ATDC5细胞按密度为6×105个/mL接种于6孔板,除空白对照(不进行任何处理) 和Annexin V-FITC 或碘化丙啶(propidium iodide,PI)单染外,细胞分为3组:正常对照组(Annexin V-FITC 和PI 双染)、10 ng/mL IL-1β 组、10 ng/mL IL-1β+100 μg 外泌体组。孵育24 h 后,PBS 洗涤2 次,0.25%胰酶消化,终止消化后,300×g离心5 min,收集细胞;用预冷的PBS重悬后再次离心弃上清液,加入200 μL结合缓冲液悬浮细胞,加入5 μL Annexin V-FITC 和5 μL PI 混匀,室温避光孵育15 min 后,流式细胞仪(美国Beckman Coulter公司)检测细胞早期和晚期凋亡情况。
1.8 Western blotting 测定细胞中凋亡蛋白和抗氧化应激相关蛋白表达
按上述细胞处理方法分组干预24 h后收集细胞,PBS洗涤2 次,加入含有蛋白酶抑制剂的RIPA 裂解液,冰上裂解30 min 后,用细胞刮刀刮下裂解后的细胞,离心,提取细胞总蛋白,取10 μL 蛋白样品,利用BCA 法测蛋白浓度后,蛋白样品(20 μg 总蛋白)于12%SDS-PAGE凝胶上分离蛋白组分。一抗HO-1(1∶1 000)、NQO-1(1∶1 000)、Nrf-2 (1∶1 000)、Keap-1 (1∶1 000)、c-caspase-3 (1∶1 000)、Bcl-2 (1∶1 000)、Bax (1∶1 000),4 ℃孵育过夜,次日TBST 缓冲液漂洗后二抗(1∶2 000)室温孵育1 h,ECL 反应曝光显影后保存结果进行分析。
1.9 统计学分析
采用SPSS 20.0 软件对数据进行处理。定量资料以x±s 表示,多组间比较采用单因素方差分析,组间两两比较采用独立样本t检验。P<0.05认为差异有统计学意义。
2 结果
2.1 HUVEC来源外泌体的结构特征
透射电镜下可以观察到HUVEC分泌的外泌体呈现脂质双层膜包绕形成的典型茶托状形态特征(图1A)。利用Western blotting 可检测到其蛋白标志物CD9、Alix 和Tsg101 的表达(图1B)。粒度分析检测表明,HUVEC 来源的外泌体粒径主要分布在100~200 nm(图1C)。

图1 HUVEC来源外泌体的鉴定Fig 1 Identification of HUVEC-derived exosomes
2.2 ATDC5细胞对HUVEC来源外泌体的摄取
荧光显微镜观察结果显示,被PKH26荧光染料标记的外泌体与ATDC5细胞共培养6 h后,外泌体可被ATDC5细胞成功摄取至细胞质中,并在细胞核周围聚集(图2)。

图2 荧光染料PKH26标记的外泌体与ATDC5细胞共培养3 h和6 h后的摄取情况Fig 2 Uptaking of PKH26-labeled exosomes co-cultured with ATDC5 cells for 3 h and 6 h
2.3 HUVEC 来源外泌体对于IL-1β 刺激下的ATDC5 细胞ROS生成的影响
与NC 组相比,10 ng/mL IL-1β 作用ATDC5 细胞24 h后,细胞内的ROS橙色荧光增强;同时加入50 μg外泌体和10 ng/mL IL-1β 刺激24 h 后,与单纯IL-1β 刺激相比,ATDC5细胞内ROS橙色荧光强度进一步增加(图3)。

图3 ATDC5细胞内ROS检测Fig 3 Detection of ROS in ATDC5 cells
2.4 HUVEC 来源外泌体对于IL-1β 刺激下ATDC5 细胞凋亡的影响
利用TUNEL 染色和流式细胞术检测ATDC5 细胞凋亡,TUNEL 染色结果显示:与NC 组相比,10 ng/mL IL-1β 刺激24 h 组细胞凋亡率升高,同时加入50 μg 外泌体后,ATDC5细胞凋亡率进一步升高(图4A、B)。流式细胞术检测结果也显示:与NC 组相比,10 ng/mL IL-1β 刺激24 h 组ATDC5 细胞总凋亡率升高,同时加入50 μg 外泌体后,ATDC5细胞总凋亡率进一步升高(图5A、B)
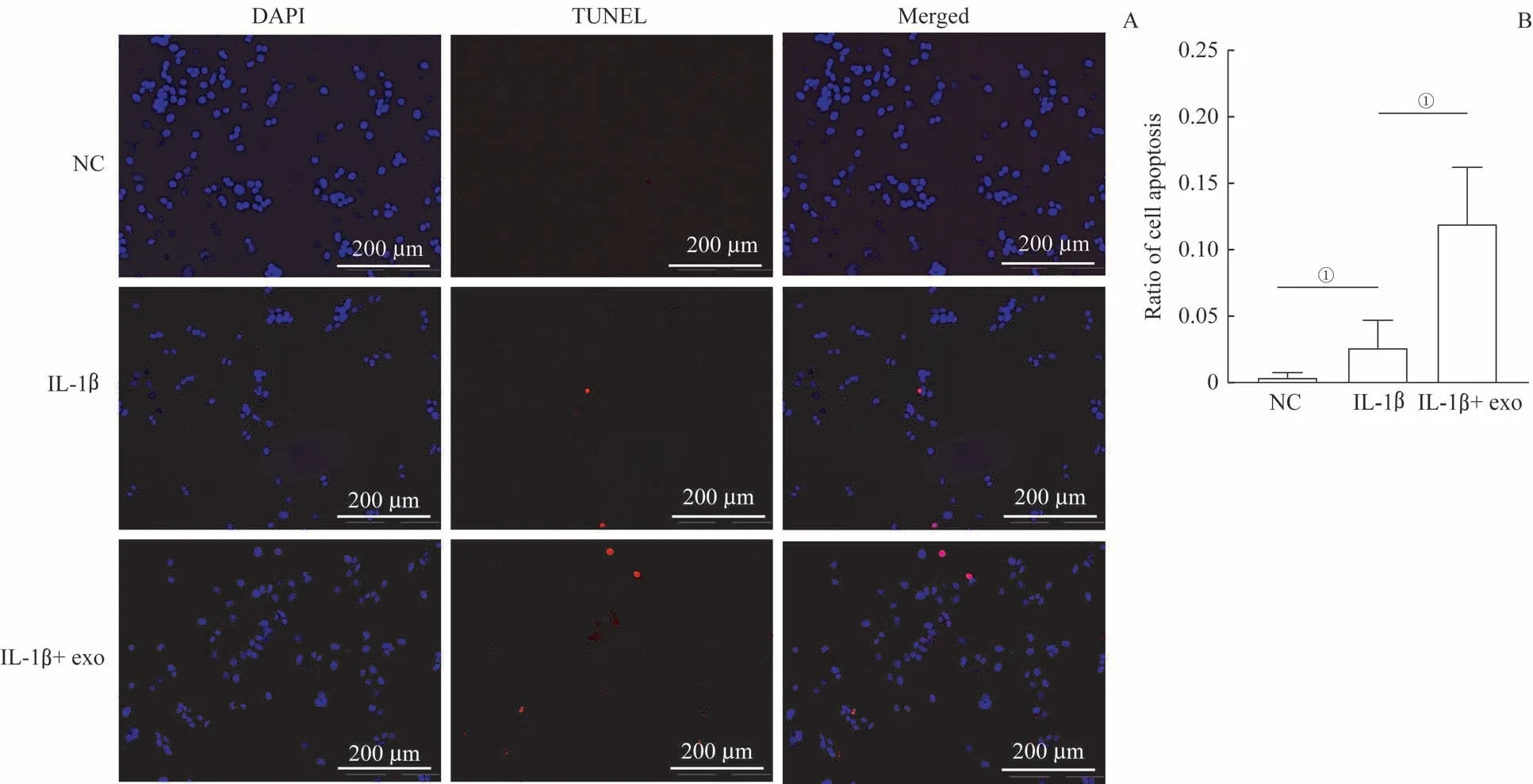
图4 TUNEL法检测ATDC5细胞凋亡Fig 4 Detection of apoptosis of ATDC5 cells by TUNEL assay
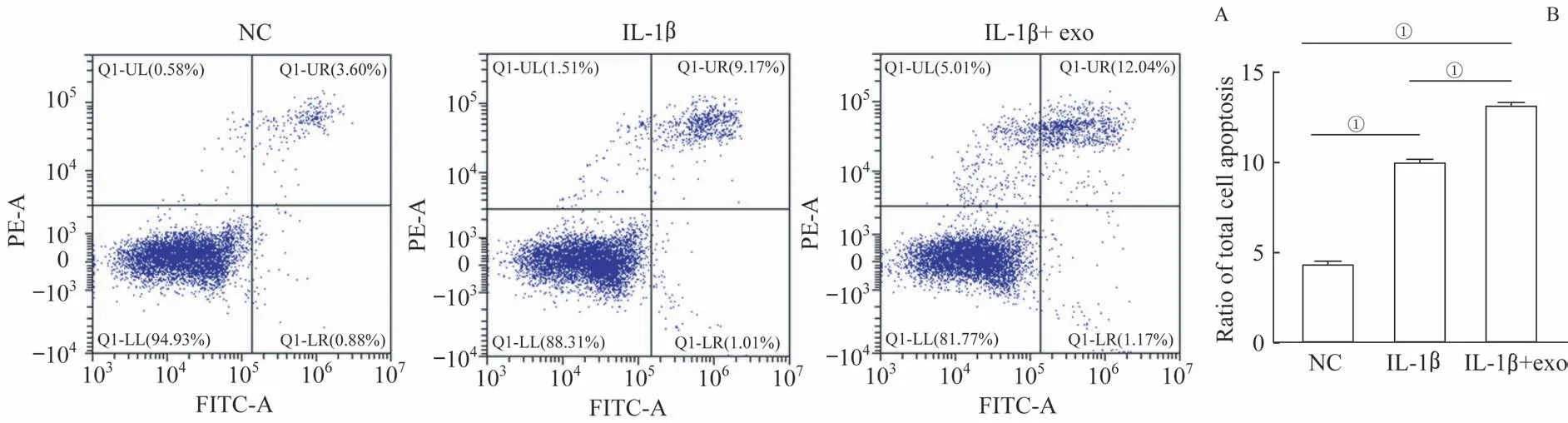
图5 流式细胞术检测ATDC5细胞凋亡Fig 5 Detection of apoptosis of ATDC5 cells by flow cytometry
2.5 HUVEC 来源外泌体对IL-1β 刺激下ATDC5 细胞凋亡和抗氧化应激相关蛋白表达的影响
Western blotting 检测结果显示,炎症因子IL-1β 处理ATDC5 细 胞24 h 的IL-1β 组,凋 亡 相 关 蛋 白Bax、c-caspase-3 表达量较NC 组明显上升,Bcl-2 表达量较NC组下降;而与IL-1β 组相比,IL-1β+50 μg 外泌体组和IL-1β+100 μg 外泌体组的Bax、c-caspase-3 表达量进一步上升,Bcl-2 的表达量逐渐下降(图6A)。按上述分组,抗氧化应激相关蛋白Nrf-2、HO-1、NQO-1的表达量逐渐下降,Keap-1表达量逐渐升高(图6B)。
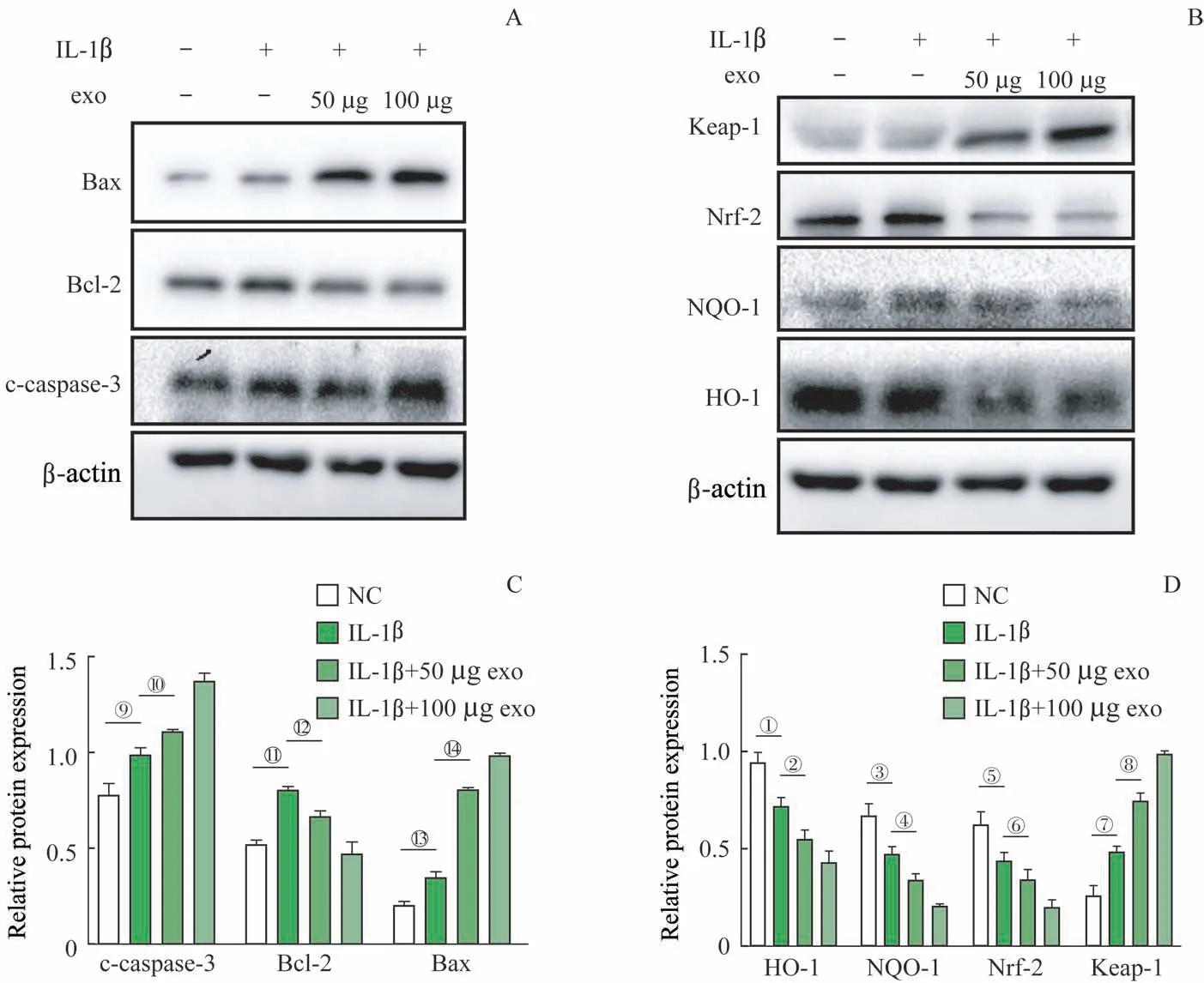
图6 Western blotting检测ATDC5细胞中凋亡及抗氧化应激相关蛋白的表达Fig 6 Detection of the expression of apoptosis-and anti-oxidative stress-related proteins in ATDC5 cells by Western blotting
3 讨论
OA 常见于中老年人群,疾病进展到后期可对患者的生活质量和身心健康产生较大影响。软骨细胞主要存在于软骨基质中,被认为是参与OA 发生和发展的主要组分,其损伤和凋亡均会直接影响OA 的进程[13]。炎症因子IL-1β 已被证实参与OA 发病中软骨细胞的损伤变性[14],故本研究使用IL-1β建立OA体外模型。
作为近年来研究热点之一的外泌体,起初被认为是细胞代谢的废弃物。后来研究[15]发现,其内容物多种多样,对细胞间信号转导起重要作用。研究[16]表明,多种细胞来源的外泌体对于骨缺损的修复有促进作用。作为体内分布广泛的血管内皮细胞,其分泌的外泌体对于OA是否有影响未见报道。
本研究拟探讨HUVEC 分泌的外泌体对于OA 是否有影响。使用试剂盒分离并鉴定外泌体后,通过荧光显微镜观察发现同时加入HUVEC来源的外泌体组比单独使用IL-1β 作用24 h 后的实验组,产生更多的ROS。既往研究[17]表明,由过多自由基(如ROS)引发的氧化应激是软骨降解和导致OA的主要原因,且氧化应激增多会导致细胞凋亡增多[18]。通过流式细胞术和TUNEL 染色观察发现NC 组、IL-1β 组、IL-1β+50 μg 外泌体组的ATDC5细胞凋亡率逐渐升高,说明HUVEC 来源外泌体对于IL-1β 刺激的ATDC5 细胞的凋亡有促进作用。据文献[19]报道,细胞的一些氧化应激反应依赖于Keap-1/Nrf-2/HO-1信号通路;通常情况下Keap-1与Nrf-2在细胞质中结合,这时处于未激活状态,若其一直未被激活,Nrf-2 会被泛素化进而被降解。在炎症、饥饿等条件刺激下,Keap-1与Nrf-2的结合变得不稳定,Nrf-2被释放出来,转移至细胞核,激活下游的过氧化物酶,从而起到抗氧化应激的作用[20]。根据既往研究[21-22],一些物质例如微RNA、糖蛋白等可以通过影响Keap-1/Nrf-2/HO-1 通路以减轻氧化应激。因此,我们猜想HUVEC来源的外泌体可以通过影响Keap-1/Nrf-2/HO-1 通路,以加重氧化应激从而导致ATDC5 细胞凋亡。Western blotting、ROS 含量检测及细胞凋亡检测结果发现:HUVEC来源的外泌体使得ROS含量进一步增加,加重IL-1β 刺激ATDC5 细胞引起的细胞凋亡,同时Keap-1表达升高,Nrf-2、HO-1、NQO-1表达下降,即细胞抗氧化应激能力下降。但HUVEC来源外泌体对ATDC5 细胞的凋亡和抗氧化应激通路产生影响的具体机制,有待于更深入的研究。
综上所述,HUVEC 来源的外泌体可能通过影响Keap-1/Nrf-2/HO-1抗氧化应激信号通路从而增加IL-1β刺激下ATDC5 细胞内的ROS 产生,使得ATDC5 细胞凋亡增加。HUVEC 来源的外泌体对于OA 不能起到治疗性作用,且会加重软骨损伤程度,这为OA的诊治提供了新的思路。因此抑制HUVEC 来源外泌体的作用可能对OA 起到治疗性作用,而若要抑制某种外泌体的作用,需要进一步揭示其中发挥作用的具体分子,并针对具体分子进行靶向抑制,这为我们下一步的研究指明了方向。
