基质金属蛋白酶响应性G4 PAMAM-IBU/GelMA水凝胶的构建及其特征研究
2021-03-19蔡传栋崔文国范存义
蔡传栋,王 非,崔文国,范存义,刘 珅
1.上海交通大学附属第六人民医院骨科,上海200233;2.上海交通大学医学院附属瑞金医院骨科,上海市伤骨科研究所,上海市中西医结合防治骨与关节病损重点实验室,上海200025
肌腱粘连是肌腱损伤及其修复术后的常见并发症,发病率可达60%,严重影响患者的肢体活动[1]。目前,肌腱粘连的治疗常常需要通过手术松解、切除粘连组织,但是术后仍有再次粘连的可能,进而形成“粘连-松解-再粘连”的恶性循环[2]。在松解治疗过程中,应用生物材料制成的防粘连膜包裹手术修复的肌腱,可以起到物理阻隔的作用,防治肌腱粘连;但是目前的生物材料防粘连膜作用单一、疗效较差且易引发炎症,限制其临床应用[3-4]。
非甾体类抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDs)可以通过抑制环氧合酶的活性,减少前列腺素2的合成,从而抑制局部白细胞的聚集,减轻炎症反应,进而达到抑制肌腱粘连的效果[5]。与罗非考昔等选择性环氧合酶-2抑制剂相比,作为NSAIDs之一的布洛芬(ibuprofen,IBU)能同时抑制环氧合酶-1 和环氧合酶-2,因而具有更好的抑制粘连的作用[6]。然而,肌腱损伤部位血供受到破坏,限制了IBU的全身用药;因此,局部使用IBU来减轻过度炎症反应,是防治肌腱粘连的一个重要方法。本课题组在前期研究中构建了载IBU防粘连膜,该膜能够减轻肌腱损伤修复过程中的炎症反应,提高防粘连效果[7]。但是该膜的IBU释放属于被动释放,不能按需精确释放药物;此外,IBU在水中的溶解度很低,限制了其在体液中的扩散,不利于IBU进入细胞[8]。因此,制备能够按需释放药物的防粘连膜,并提高IBU的溶解度,对于更好地发挥IBU抗炎、防粘连的作用尤为重要。
在防粘连膜的生物材料中,水凝胶可以有效地阻隔粘连组织,并可作为药物缓释的良好载体。水凝胶的微孔结构允许肌腱内外侧的营养物质交换,从而促进肌腱的内源性愈合[9]。近年来,生物敏感性可降解水凝胶作为一类既可用于生物治疗(载DNA、siRNA、蛋白质和多肽),又可用于药物释放的生物医用材料,日益受到人们的重视[10]。在肌腱粘连形成过程中,炎症阶段往往伴随着基质金属蛋白酶(matrix metalloproteinase,MMP)含量的上调[11],使得MMP 可以成为一个合适的引发药物响应释放的“触发器”。明胶(gelatin,Gel)是一类生物相容性较好的天然高分子[12],分子链上有可被MMP水解的位点[13];利用Gel 构建水凝胶材料可实现对疾病微环境响应性降解。基于此,本研究将IBU与第4代树枝状大分子聚酰胺-胺(generation 4 polyamindoamine,G4 PAMAM)结合后形成复合物(G4 PAMAM-IBU),包载于具有MMP 响应性的甲基丙烯酸酯明胶(methacrylate gelatin,GelMA)水凝胶中,从而形成按需给药的“疾病触发-药物释放-治疗疾病”的循环体系,然后研究该水凝胶对成纤维细胞增殖的影响,验证其防粘连作用,为防止肌腱粘连、控制炎症及促进患肢功能康复提供新的治疗方法及理论依据。
1 材料与方法
1.1 主要材料和仪器
IBU(CAS 15687-27-1)、Gel(CAS 9000-70-8)、甲基丙烯酸酐[methacrylic anhydride(MA),CAS 760-93-0]、苯基-2,4,6-三甲基苯甲酰基亚磷酸锂盐[lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP),CAS 85073-19-4]购自上海阿拉丁生化科技股份有限公司,G4 PAMAM购自威海晨源分子材料有限公司,透析袋(截留相对分子质量为1 000或3 500)购自上海源叶生物科技有限公司,MMP2(SRP3118)购自上海希格玛高技术有限公司,大鼠成纤维细胞208F购自上海生物化学与细胞生物学研究所,DMEM培养基购自美国Gibco公司,胎牛血清(C0227)、CCK-8 试剂盒(C0037)购自上海碧云天生物技术公司,活/死细胞染色试剂盒(40747ES76/80)购自上海翊圣生物科技有限公司。紫外分光度光度计(Biospectrophotometer,AG6135)购自德国Eppendorf 公司,扫描电子显微镜(简称扫描电镜,Sirion 200)购自美国FEI公司,倒置荧光显微镜(TI2-U)购自日本Nikon公司,多功能酶标仪购自美国BioTek公司。
1.2 G4 PAMAM-IBU的制备与药物释放检测
准确称量2 mg IBU 粉末,溶解于1 mL G4 PAMAM溶液(2 mg/mL) 中,密封后超声振荡8 h 使IBU 与G4 PAMAM 形成G4 PAMAM-IBU。将所得溶液用蒸馏水将IBU稀释至3、6、9、12、18、24、30 μg/mL的浓度梯度。以紫外分光光度计检测其紫外吸收光谱并绘制G4 PAMAM-IBU 浓度- 吸光度值标准曲线。 将G4 PAMAM 配成不同浓度的水溶液,分别加入足够量的IBU,密封后超声振荡8 h,将所得溶液于4 ℃高速冷冻离心机中离心5 min(5 000×g),取上清液并再次离心5 min(5 000×g),此时上清液即为相应浓度G4 PAMAM的IBU 饱和溶液。以紫外分光光度计测定其吸光度值并用G4 PAMAM-IBU标准曲线计算IBU的饱和浓度。
将含IBU 2 mg/mL 的G4 PAMAM-IBU 溶液稀释至200 μg/mL,取稀释后溶液100 μL 加入透析袋(截留相对分子质量为1 000),之后将透析袋密封,置于20 mL去离子水中,于不同时间点取透析袋外液1 mL 测定紫外吸光度值,并重新补充1 mL 去离子水。根据所测得紫外吸光度值计算G4 PAMAM-IBU 的IBU 释放质量以及累计释放率。
1.3 G4 PAMAM-IBU/GelMA水凝胶的制备与特征检测
通过Gel 与MA 的加成反应合成甲基丙烯酸酯明胶(methacrylate gelatin,GelMA)。简言之,将10 g Gel 以10%质量分数溶于磷酸缓冲盐溶液(phosphate buffer saline,PBS)中,缓慢加入5 mL MA,于60 ℃水浴锅中反应2 h,期间保持温度不变。待反应结束后,过滤溶液并放入透析袋(截留相对分子质量为3 500)中透析3 d。透析完成后冷冻干燥即可得到白色泡沫状的GelMA固体,将产物置于-20 ℃恒温冰箱中保存。
使用生物相容性较好的LAP 作为光引发剂。将GelMA、LAP 及G4 PAMAM-IBU 分 别 以5%、0.3% 及0.15%的质量分数溶解于去离子水中得到GelMA 预凝胶溶液,将此溶液暴露于365 nm 紫外光下15 s 即可得到载G4 PAMAM-IBU的GelMA水凝胶。
将所得100 μL 的水凝胶浸泡于0.1 μg/mL MMP2 溶液中48 h后取出,并与新制备的G4 PAMAM-IBU/GelMA水凝胶进行冷冻干燥。将冻干的水凝胶喷金后用加速电压5 kV 的扫描电镜观察被MMP 降解前后的G4 PAMAMIBU/GelMA水凝胶的内部微观形态。
1.4 G4 PAMAM-IBU/GelMA水凝胶的药物释放检测
取200 μL GelMA 预凝胶溶液,经紫外光交联后成胶。将所得水凝胶置入含2 mL 去离子水的透析袋中(截留相对分子质量为1 000),密封透析袋后放入18 mL 含0.1 μg/mL 的MMP2 溶液中,3 d 内于不同时间点取透析袋外液1 mL测定紫外吸光度值,并重新补充1 mL 0.1 μg/mL 的MMP2 溶液。根据所测得紫外吸光度值和IBU 浓度标准曲线计算G4 PAMAM-IBU/GelMA水凝胶中的IBU释放质量以及累计释放率。
1.5 细胞实验
1.5.1 G4 PAMAM-IBU 对细胞增殖的影响 用不同浓度的空白G4 PAMAM 培养基溶液培养细胞,观察其对细胞增殖的影响,并选择合适的浓度以排除其干扰作用。使用含10%胎牛血清的DMEM 培养基预先于96孔板中培养208F 细胞(2 000 个/孔),待细胞贴壁后更换为含不同浓度G4 PAMAM 的DMEM 培养基,并以继续使用DMEM培养的208F 细胞作为空白对照组。培养48 h 后,使用CCK-8试剂盒检测208F细胞的活力,操作按说明书进行。
选择合适的G4 PAMAM 浓度,制备G4 PAMAMIBU。用含10%胎牛血清的DMEM 培养基将G4 PAMAMIBU 按IBU 浓 度 分 别 配 置 为100、150、200、250、300 μg/mL 的含药培养基,培养已贴壁的208F 细胞;同时以含相同浓度IBU(以1%二甲基亚砜溶解)的DMEM培养基培养细胞作为对照。培养48 h 后,使用CCK-8 试剂盒检测细胞的活力。
1.5.2 G4 PAMAM-IBU/GelMA 水凝胶对细胞增殖的影响 将208F 细胞(10 000 个/孔)接种于24 孔Transwell细胞培养板下层,以含10%胎牛血清的DMEM 培养基进行培养。待细胞充分贴壁后,在Transwell 培养板上层放入200 μL 空白GelMA 水凝胶、载G4 PAMAM-IBU(G4 PAMAM 为1 mg/mL,IBU 为500 μg/mL) 或 单 独IBU(IBU 为500 μg/mL)的GelMA 水凝胶;并将3 种水凝胶分别浸于含0.1 μg/mL MMP2 的培养基(GelMA+MMP组、G4 PAMAM-IBU/GelMA+MMP 组和IBU/GelMA+MMP 组) 与不含MMP2 的培养基中(GelMA 组、G4 PAMAM-IBU/GelMA 组和IBU/GelMA 组)。将Transwell培养板上层没有水凝胶的细胞组设为对照组。
将 GelMA 组、 IBU/GelMA、 G4 PAMAM-IBU/GelMA 组、G4 PAMAM-IBU/GelMA+MMP 组 细 胞 于Transwell 细胞培养板中共培养48 h 后,移除上层小室,用PBS 充分洗涤细胞2 次,将配置好的活/死细胞染色溶液(将20 μL 钙黄绿素和40 μL 碘化丙啶加入10 mL PBS中并充分混匀) 250 μL 加入各孔中,室温避光孵育30 min 后吸除染色液并用PBS 洗涤细胞,通过倒置荧光显微镜观察。
将7 组细胞于Transwell 细胞培养板中共培养24 h 和72 h 后,移除上层小室,用PBS 洗涤细胞2 次,加入500 μL培养基和50 μL CCK-8试剂,放入37 ℃、5%CO2的培养箱中孵育2 h。随后用酶标仪检测在450 nm 下各孔的吸光度值。
1.6 统计学分析
所有实验数据均通过SPSS 25.0 软件进行分析统计,定量资料以x±s 表示,采用单因素方差分析比较组间差异,P<0.05表示差异有统计学意义。
2 结果
2.1 IBU与G4 PAMAM的结合与解离特征
G4 PAMAM 表面的树枝状氨基可以与IBU 相结合(图1A)。通过紫外分光光度计测量纯IBU 在水中的溶解度以及IBU 与G4 PAMAM 结合后在水中的溶解度。室温下IBU 溶解度约为85 μg/mL;IBU 与G4 PAMAM 结合后,随着G4 PAMAM 浓度的增加,IBU 溶解度也随之增加,其中当G4 PAMAM 浓度为5 mg/mL 时,IBU 溶解度达到3 942 μg/mL,说明G4 PAMAM 与IBU 结合可提高IBU在水中的溶解度(图1B)。
通过透析袋释放试验对G4 PAMAM-IBU 的药物释放速度进行研究。分子量较小的IBU 可以通过透析袋进入外液,而分子量较大的G4 PAMAM 则被截留于袋中。在12 h 内,超过80%的IBU 与G4 PAMAM 解离,表明IBU与G4 PAMAM 结合后,由于IBU 的溶解度提高且被包裹在G4 PAMAM 内,可以逐渐释放至溶液中,较单纯溶解的IBU相比,可以发挥缓释作用(图1C)。
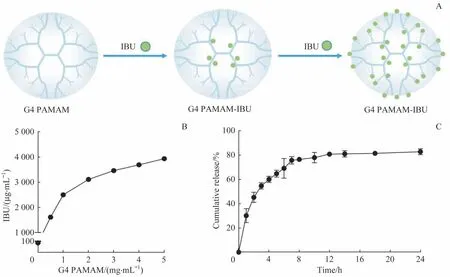
图1 IBU与G4 PAMAM的结合与解离表征Fig 1 Characterization of combination and dissociation of G4 PAMAM-IBU
2.2 MMP 响应性G4 PAMAM-IBU/GelMA 水凝胶的特征
GelMA 分子链上含有可被MMP 特异性水解的位点,因此被MMP处理后,GelMA水凝胶结构会逐渐降解(图2A)。G4 PAMAM-IBU/GelMA 水凝胶与GelMA 水凝胶冷冻干燥后经扫描电镜观察,2种水凝胶在微观结构上没有明显差别;经MMP 处理后,2 种水凝胶孔隙均增大,表明水凝胶在MMP的作用下发生了降解(图2B)。
为了研究MMP 是否可以加速G4 PAMAM-IBU/GelMA 水凝胶中IBU 的释放,我们对该水凝胶的药物释放行为进行了观察。将该水凝胶置于透析袋中,所释放的IBU 通过透析袋进入外液,未被释放的G4 PAMAMIBU 仍在袋内的水凝胶中。与未添加MMP 相比,添加MMP 可以明显加速水凝胶中IBU 的释放,在72 h 内即可完成超过70% 的药物释放, 说明MMP 可加速G4 PAMAM-IBU/GelMA水凝胶中IBU的释放(图2C)。
2.3 G4 PAMAM-IBU对成纤维细胞增殖的影响
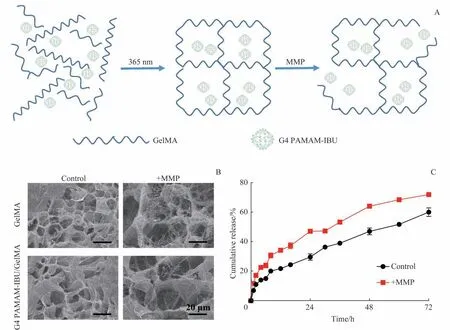
图2 MMP所致GelMA水凝胶的降解及G4 PAMAM-IBU/GelMA水凝胶中IBU的响应性释放Fig 2 MMP-induced GelMA hydrogel degradation and MMP-responsive IBU release from G4 PAMAM-IBU/GelMA hydrogel
要研究G4 PAMAM-IBU 对细胞增殖的抑制能力,首先要排除G4 PAMAM 对细胞增殖的干扰。采用不同浓度的G4 PAMAM孵育细胞48 h后,随着G4 PAMAM浓度的增加,其对细胞抑制增殖效果也随之上升。当G4 PAMAM 浓度为100 和200 μg/mL 时,其抑制增殖效果与对照组(0 μg/mL)相比差异无统计学意义(均P>0.05);当浓度达到300 μg/mL 以上,G4 PAMAM 开始显现抑制增殖的作用(均P<0.05)(图3A)。因此选用200 μg/mL G4 PAMAM进行后续实验。
与相同浓度的IBU 相比,与G4 PAMAM 结合的IBU抑制细胞增殖的作用显著提高。与空白对照组相比,单纯的IBU浓度需达到300 μg/mL才具有抑制细胞增殖的能力,而G4 PAMAM-IBU 中IBU 的浓度为100 μg/mL 时就可明显抑制成纤维细胞增殖(图3B)。
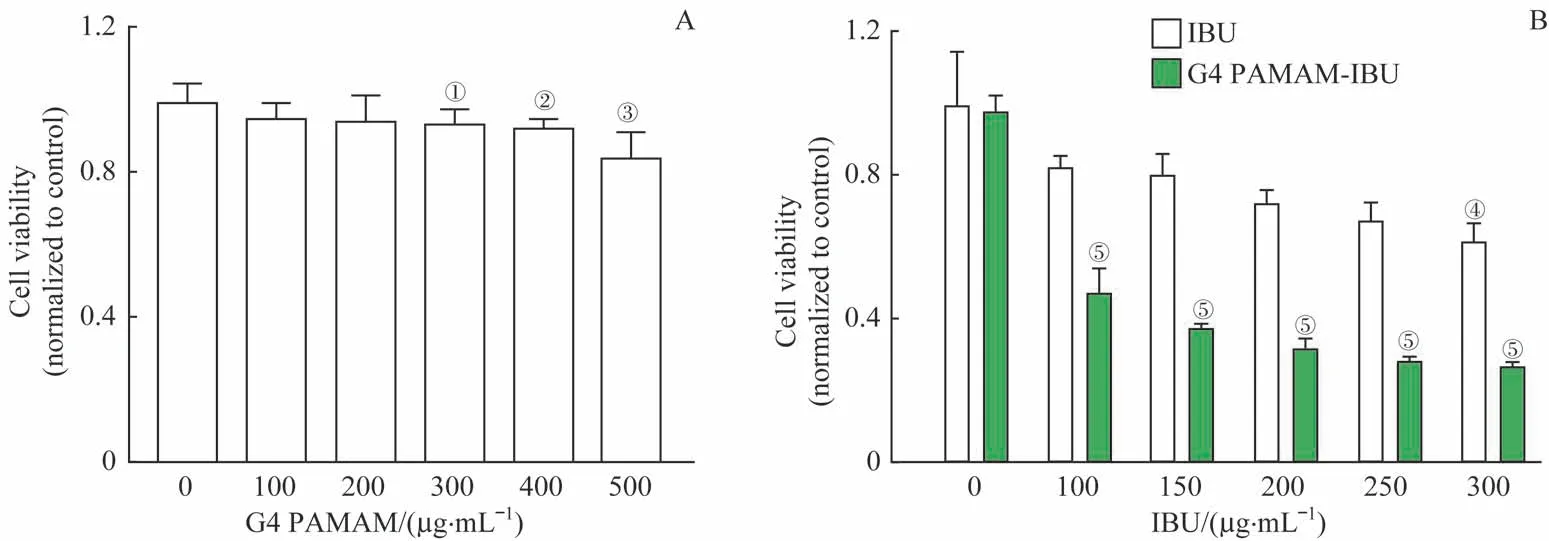
图3 G4 PAMAM与G4 PAMAM-IBU对成纤维细胞增殖的抑制作用Fig 3 Inhibitory effects of G4 PAMAM and G4 PAMAM-IBU on cell proliferation
2.4 G4 PAMAM-IBU/GelMA 水凝胶对成纤维细胞增殖的影响
水凝胶与成纤维细胞共培养48 h 后,GelMA 组细胞情况良好,活细胞多,几乎未见死细胞,说明GelMA 水凝胶的生物相容性较好。与IBU/GelMA 组相比,G4 PAMAM-IBU/GelMA 组活细胞数量减少,死细胞数量增多;G4 PAMAM-IBU/GelMA 组添加MMP 后,活细胞数量进一步减少,死细胞数量进一步增多(图4A),说明G4 PAMAM-IBU 的抑制细胞增殖的效果优于单纯IBU,且加入MMP 会促进G4 PAMAM-IBU/GelMA 水凝胶释放G4 PAMAM-IBU,从而更好地发挥抑制细胞增殖的作用。
使用CCK-8试剂盒定量检测G4 PAMAM-IBU/GelMA水凝胶在共培养24 h 与72 h 时抑制成纤维细胞增殖的能力,GelMA 组与GelMA+MMP 组抑制效果与对照组相比差异无统计学意义(均P>0.05)。当水凝胶载IBU 或G4 PAMAM-IBU 后,开始显现其抑制增殖的能力,且添加MMP 后,由于水凝胶内含药物释放加快,抑制效果增强。与IBU/GelMA 组相比,G4 PAMAM-IBU/GelMA 组抑制成纤维细胞增殖的能力更强(图4B)。
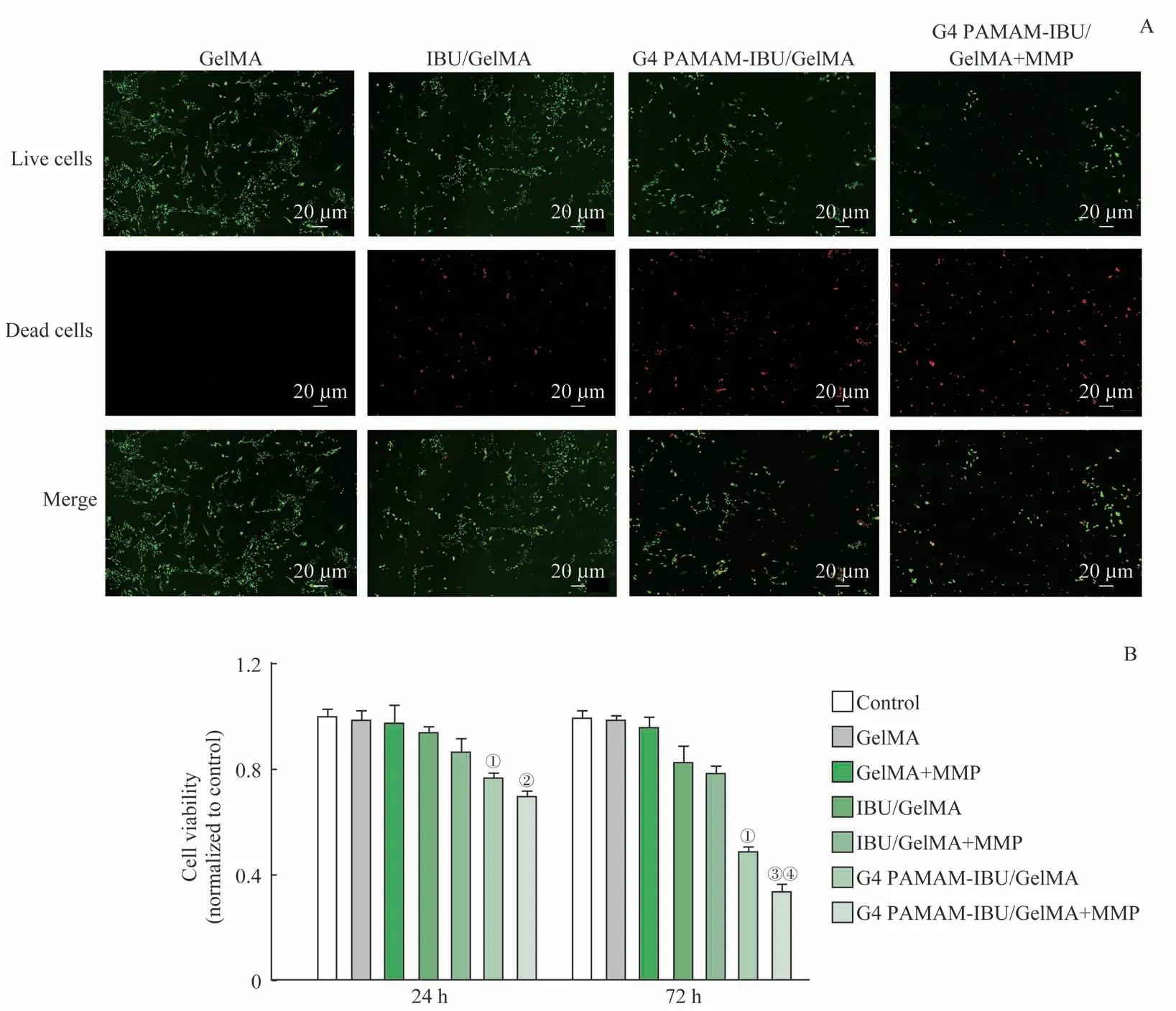
图4 MMP响应性G4 PAMAM-IBU/GelMA水凝胶对成纤维细胞增殖的抑制作用Fig 4 Inhibitory effect of MMP-responsive G4 PAMAM-IBU/GelMA hydrogel on cell proliferation
3 讨论
肌腱损伤后,为抑制肌腱周围粘连组织生成,使用IBU 来减轻过度的炎症反应是一项重要的治疗方法[14]。然而,IBU为脂溶性药物,在体液中扩散较慢,局部使用效果不佳。使用药物载体增加药物的溶解性可有效地避免此类问题。其中,树枝状大分子可将药物包裹在其内部的孔隙中,并与药物形成纳米粒子,从而显著提高药物的溶解性[15-16]。
本研究将IBU 包裹于树枝状大分子G4 PAMAM 内构成G4 PAMAM-IBU,使IBU 的溶解度显著提高;且IBU在12 h 内逐渐解离,与单纯的IBU 相比,有利于IBU 在局部缓慢释放,发挥长效作用。体外实验证明,G4 PAMAM 不仅可以提高IBU 的溶解度,还有利于IBU发挥其抑制成纤维细胞增殖的作用。当IBU 的浓度相同时,G4 PAMAM-IBU 的抑制增殖效果更强,这可能是由于G4 PAMAM 表面的氨基正电荷可与带负电的细胞膜加强接触,促进G4 PAMAM-IBU 复合物入胞并释放其包含的IBU 发挥药理作用[17];此外,有研究[18]表明,该类树枝状大分子可以降低药物的细胞内清除率,延长药物的作用时间,进一步证实了G4 PAMAM 作为药物载体的优越性。
为实现IBU 在局部的按需释放,增加IBU 局部的缓释效果,我们将G4 PAMAM-IBU 包载于具有MMP 响应性的GelMA 水凝胶中。 在MMP 存在的条件下,G4 PAMAM-IBU可在72 h从水凝胶体系内释放超过70%;因此该制剂有望实现在肌腱损伤的早期炎症期(高MMP)释放IBU 来发挥作用。之后,我们对G4 PAMAM本身的细胞毒性作用进行研究,将安全浓度的G4 PAMAM 与IBU 结合,装载至GelMA 水凝胶中。体外实验证实,G4 PAMAM-IBU/GelMA 水凝胶可以有效地抑制成纤维细胞的增殖。同时,相同IBU 浓度的情况下,与IBU/GelMA组相比,G4 PAMAM-IBU/GelMA组抑制细胞增殖作用更强,印证了之前的实验结论。此外,培养基中添加MMP 后,由于GelMA 水凝胶发生降解,所载药物释放加快,从而增强了IBU抑制增殖的效果。
综上所述,本研究构建了一种载G4 PAMAM-IBU 的GelMA 水凝胶并观察了其体外抑制成纤维细胞增殖的效果,结果发现该水凝胶可在模拟体内炎症条件下释放IBU,发挥其抑制成纤维细胞增殖的作用,在防治肌腱粘连方面具有一定的应用前景。
