好氧堆肥用枯草芽孢杆菌GX2 产芽孢工艺优化
2021-03-18李月月李秀芬齐希光任月萍王新华夏琼琼
李月月 , 李秀芬 *, 齐希光 , 李 健 , 任月萍 , 王新华 , 夏琼琼
(1.江南大学 环境科学与工程学院,江苏 无锡 214122;2.江苏省厌氧生物技术重点实验室,江苏 无锡 214122;3.江苏省水处理技术与材料协同创新中心,江苏 苏州 215009;4.江南大学 食品学院,江苏 无锡 214122;5.中国市政工程华北设计研究总院有限公司,天津300074)
好氧堆肥化是有机固体废弃物减量化、无害化及资源化的有效途径之一,是在微生物作用下通过高温发酵使有机物变成腐熟肥料的过程。 好氧堆肥不仅含有大量可被植物吸收利用的有效态氮、 磷、钾及其化合物,而且含有构成土壤肥力的重要活性物质腐殖质[1],既解决了有机固体废弃物的环境污染问题,又起到改良土壤和增加肥效的作用[2]。 在好氧堆肥过程中添加外源微生物菌剂可有效提高堆体中功能微生物的数量,加快有机物转化及堆肥进程,提高肥效[3]。 Xi 等[4]通过接种复合菌剂增加堆肥过程中细菌的多样性,可有效提高堆肥效率。 Zhao等[5]发现在堆肥过程中接种放线菌可显著提高纤维素酶活性,加速纤维素降解,提高腐殖质含量,减少温室气体排放。 微生物菌剂的应用效果与活菌数密切相关,有效活菌数是衡量微生物菌剂品质的重要指标[6],然而,随着微生物菌剂保存时间的延长,活菌数不断减少,降低菌剂的使用效果[7],同时,微生物菌剂的制备成本较高,影响了其工业化应用。
芽孢杆菌具有较强的抗逆性,能耐热、酸和碱等不良环境, 可有效保持菌剂中的微生物活性,提高菌剂质量及应用效果[8-9]。 王雪莲等[10]采用响应面法对影响枯草芽孢杆菌B579 的培养基进行了优化,为进一步提高细胞浓度和后续放大培养提供参考,同时,对其产芽孢条件进行了优化。 王法国等[11]通过单因素试验、Plackett-Burman 试验设计和响应面法对解淀粉芽孢杆菌JT84 的培养基成分和发酵条件进行了优化, 所得发酵液的芽孢含量为1.67×109CFU/mL, 与基础培养基相比, 提高了159%。 郭晓军等[8]通过对堆肥用产蛋白酶菌株的单因素、正交试验产芽孢条件优化,芽孢产率达95.0%,为解决以芽孢杆菌为主的微生物菌剂产业化生产过程中存在的活性低等问题提供了重要参考。
作者采集污泥与秸秆混合好氧堆肥样品,进行微生物初筛、复筛及分离纯化,分子鉴定后获得一株用于好氧堆肥的枯草芽孢杆菌GX2, 具有耐高温、耐酸等特点,将其应用于堆肥过程能有效缩短堆肥周期,提高堆肥品质。 针对上述枯草芽孢杆菌GX2,通过摇瓶培养条件优化,在3 L 发酵罐中通过分批补料技术进一步提高细胞浓度,并通过单因素和正交试验优化产芽孢工艺条件,可为降低其发酵及菌剂制备成本提供有益参考。
1 材料与方法
1.1 实验材料
堆肥用菌株:好氧堆肥用枯草芽孢杆菌GX2 为实验室保存菌株;种子培养基:蛋白胨10 g/L,牛肉浸膏 3 g/L,氯化钠 5 g/L,pH 为 7.2±0.2;
计数培养基:蛋白胨10 g/L,牛肉浸膏3 g/L,氯化钠 5 g/L, 琼脂 15 g/L,pH 为 7.0~7.2; 摇瓶及 3L发酵罐的基础培养基:酪蛋白胨15 g/L,大豆蛋白胨5 g/L,NaCl 5 g/L,pH 7.3,消泡剂 0.2%(体积分数);补料培养基:50 g/L 的蔗糖溶液;营养肉汤、营养琼脂、胰蛋白胨、牛肉浸膏、硫酸锰、蔗糖和硝酸钠:上海国药集团产品。
1.2 实验方法
1.2.1 菌株活化及种子液制备将4 ℃冰箱内保藏的菌株接入已灭菌的液体肉汤培养基中,摇床上45 ℃、160 r/min 活化 12 h 后,在固体营养琼脂培养基上三区平板划线,置于45 ℃培养箱中培养24 h,挑选三区单菌落传代两次后,作为发酵菌株使用。
挑取已活化的发酵菌株单菌落, 接种于装有100 mL 已灭菌的肉汤培养基250 mL 三角瓶中,置于摇床振荡培养,在温度为45 ℃,转速为160 r/min培养12 h 作为种子液。
1.2.2 摇瓶培养基及培养条件优化在摇床发酵培养基的基础上,以OD 值为指标,对菌株GX2 进行碳源种类(葡萄糖、蔗糖、淀粉)、最佳碳源质量浓度(5、10、20、30、40 g/L)、氮源种类(酵母粉、氯化铵、硝酸钠)、最佳氮源质量浓度(5、10、15、20、25 g/L)、装液量(50、100、150、200 mL)的单因素优化。 摇床培养的初始条件为温度45 ℃,转速160 r/min,装液量 100 mL(250 mL),pH 7.3。 实验在同一时间取样测定OD 值来优化培养基及其培养条件, 优化后的培养基用于发酵罐培养。 每组试验 3 次重复,结果取平均值。
1.2.3 发酵罐分批补料培养发酵罐型号为BIOTECH-3JG-3JG-9000D,上海保光公司产品。 在前期摇床培养基和培养条件优化的基础上,将发酵罐初始条件设置为工作体积1.5 L、压力0.05 MPa、搅拌转速 300 r/min、 温度 45 ℃、 接种量为 1×107CFU/mL, 通过流加 3 mol/L 的 NaOH 和 HCl 将 pH值自动控制在7.3。 将3 L 发酵罐进行灭菌,然后装入1.5 L 发酵培养基于121 ℃灭菌30 min, 取出后将温度、pH、 转速、 溶氧设置在初始条件, 以 1×107CFU/mL 的接入量接种新鲜活化的GX2 种子液。
分批发酵是在上述条件下上罐进行菌株发酵,测定发酵过程中OD 值、残糖浓度、活菌数,获得菌株在发酵罐上的补料时间和补料量。 分批补料发酵是在分批发酵的基础上,当总糖量消耗一半时[12-13],加入碳源至原浓度,继续发酵培养,当细胞浓度达到稳定时停止补料发酵。 以最大OD 值和最大活细胞数作为参考值,来分析分批发酵和分批补料发酵的效果。
在分批补料发酵的基础上,取样测定活菌数和芽孢数,绘制芽孢曲线图。 在产芽孢时开始控制条件来优化芽孢率,并在芽孢率最大时取样测定。
1.2.4 发酵罐培养条件优化
1) 单因素优化芽孢率 在发酵罐分批补料优化的基础上,分别研究培养温度、搅拌转速和pH 值对芽孢杆菌产芽孢的影响。
2) 正交试验优化芽孢率 根据单因素实验结果得到的 pH(A),温度(B)、转速(C)的基础上,设计3 因素3 水平正交试验, 并根据正交试验数据的极差分析,得到菌株产芽孢的最佳发酵条件。
3) 追加验证实验 根据正交试验分析的最佳发酵培养条件,进行追加验证实验。
1.3 分析测试项目与方法
细胞浓度:采用比色法,以空白培养基作参比,在 600 nm 处测定发酵液 OD 值[13-16]。
活细胞数:采用稀释平板培养计数法,发酵液进行10 倍稀释后,涂布平板进行活菌计数[17]。
芽孢数:将发酵液在70 ℃下处理15 min 后,冷却,采用稀释梯度平皿计数法统计活菌数[18]。
芽孢率:芽孢数占活菌数的百分数[18]。
总糖含量:采用 3,5-二硝基水杨酸(DNS)比色法[19]。
2 结果与分析
2.1 摇瓶培养条件优化
2.1.1 生长曲线绘制微生物菌株生长一般经历延滞期、对数生长期、稳定期和衰亡期4 个阶段[20]。首先是菌体生长的迟滞期,生长缓慢,细胞浓度基本不会增加;适应新环境后,微生物生长繁殖速度加快,细胞浓度快速提高,进入对数生长期;此后,随着底物不断被消耗,细胞浓度进入稳定期;底物进一步消耗殆尽,微生物生长进入衰亡期,细胞浓度明显下降。 绘制微生物菌株的生长曲线可为其培养条件优化提供重要参考,图1 给出了枯草芽孢杆菌GX2 的发酵液OD 值随培养时间的变化情况。
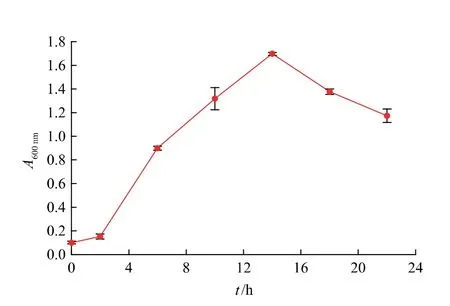
图1 菌株GX2 生长曲线Fig.1 Growth curve of strain GX2
由图1 可知,细胞浓度在前期有短暂的生长停滞期, 之后发酵液在波长600 nm 处的吸光度呈直线上升趋势,至14 h 时,细胞浓度达到最大,A600nm为1.698,之后开始下降。 通常情况下,处于对数生长期的菌株活力最强[21],细胞浓度也最高,因此,确定14 h 为枯草芽孢杆菌GX2 的最佳培养时间,并用作后续摇瓶培养条件优化研究的发酵终止时间。
2.1.2 碳源种类及其质量浓度的优化培养基是富含多种营养物质的混合物,碳源是组成培养基的主要成分之一,其主要作用是构成菌体细胞成分并为生命活动提供所需能量[22],葡萄糖、蔗糖、麦芽糖、乳糖和可溶性淀粉均是易被微生物利用的碳源[23]。作者选择价廉易得的葡萄糖、蔗糖和可溶性淀粉为碳源, 进行碳源筛选及质量浓度优化, 结果如图2所示。
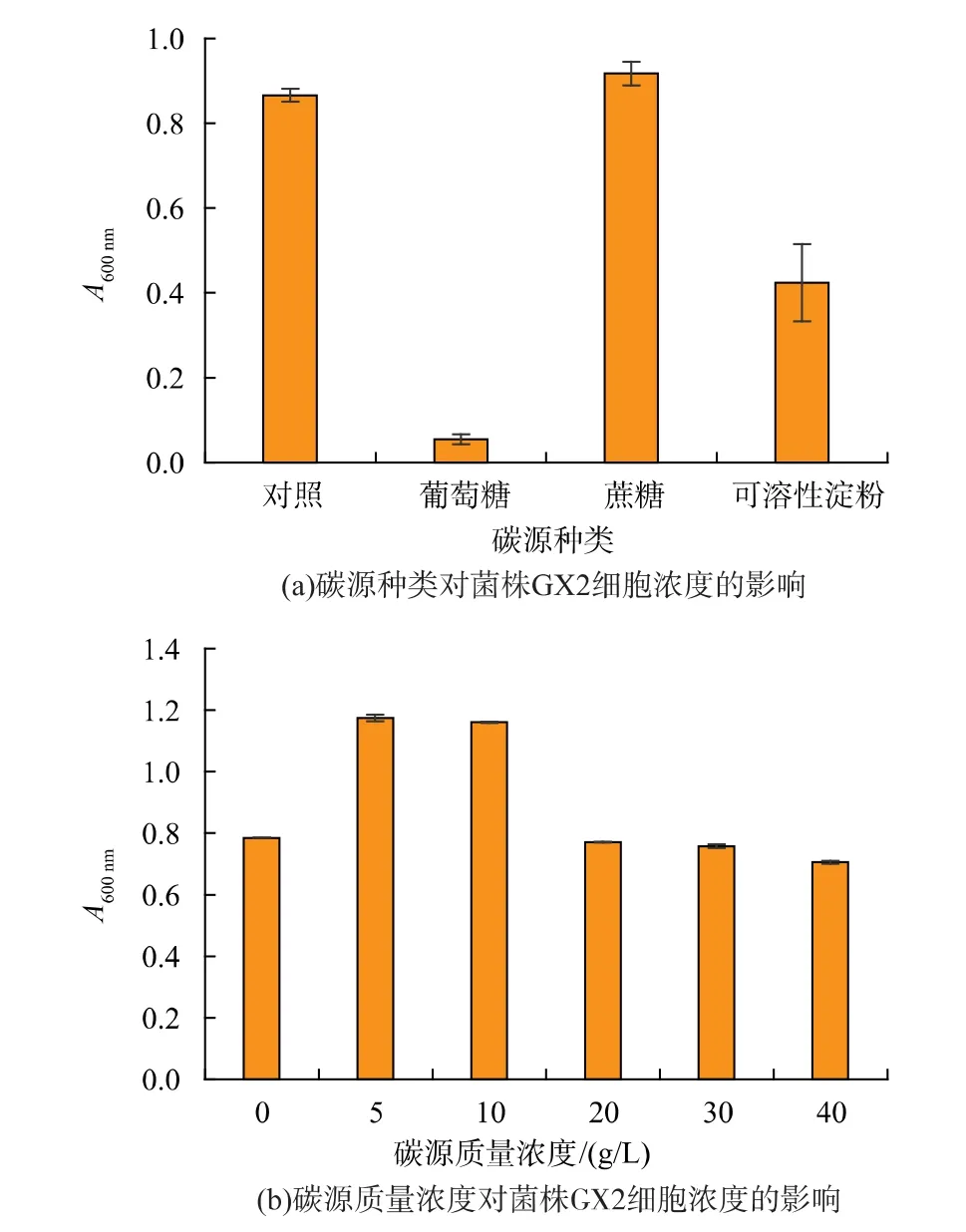
图2 碳源对菌株GX2 细胞浓度的影响Fig.2 Effect of carbon source on cell concentration of strain GX2
由图2(a)可知,与对照不添加碳源相比,添加蔗糖的细胞浓度略高,A600nm达0.917, 而其他两种碳源的细胞浓度均低于对照,说明蔗糖有利于GX2的快速繁殖。其中,葡萄糖的A 值显著低于对照,其可能是因为灭菌时会与其他物质反应生成抑制菌株生长的有毒物质,即“美拉德反应”产物[19]。 此外,随着蔗糖浓度的升高,细胞浓度先增加后降低(图2(b)),蔗糖添加量为 5 g/L 时,细胞浓度最大,发酵液的A600nm为1.175。 故确定GX2 的最佳碳源为蔗糖,添加质量浓度为5 g/L。
2.1.3 氮源种类及其质量浓度优化氮源主要用来构成微生物细胞和代谢产物的营养物质[22],常用的氮源有无机氮源和有机氮源。 无机氮源成分单一,吸收利用较快;有机氮源含有丰富的蛋白质和游离的氨基酸,可以被生物缓慢利用[23]。氮源种类及质量浓度优化结果如图3(a)和图3(b)所示。
由图3(a)可知,与不添加氮源相比,氯化铵和硝酸钠的添加更有利于GX2 细胞浓度的增加,A 值均高于对照,其中硝酸钠的细胞浓度最大,而酵母粉的添加不利于GX2 生长。 在此基础上,对硝酸钠的浓度进行了优化,结果如图3(b)所示。可见,硝酸钠质量浓度为5 g/L 时, 细胞浓度最大,A600nm为0.79,故芽孢杆菌GX2 的最佳氮源为硝酸钠,最佳添加质量浓度为5 g/L。
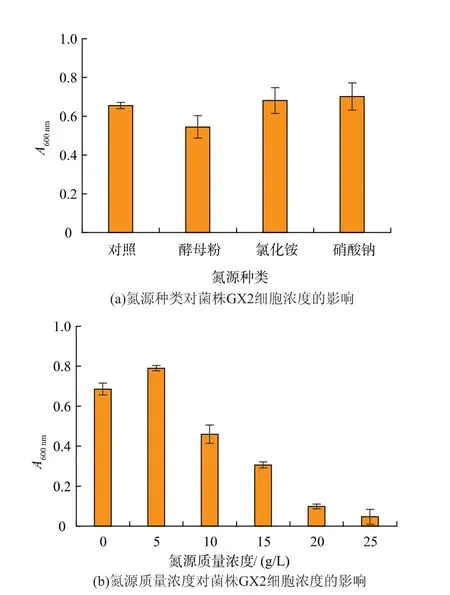
图3 氮源对菌株GX2 细胞浓度的影响Fig.3 Effect of nitrogen source on cell concentration of strain GX2
2.1.4 装液量优化溶解氧为好氧微生物生长所必需,是进行能量代谢的重要物质,供氧条件直接影响菌体生长繁殖以及细胞代谢[24]。 摇瓶培养的溶解氧浓度主要通过转速和装液量进行控制,相同搅拌转速条件下,装液量越大,溶解氧浓度越低,装液量直接影响菌体在生长过程[22]。250 mL 摇瓶中装液量分别为 50、100、150、200 mL 时,研究溶解氧对细胞浓度的影响, 结果如图4 所示。 当装液量为100 mL 时,枯草芽孢杆菌GX2 的细胞浓度最大,OD 值达1.554,比未优化前提高了44.3%。
综上,好氧堆肥用芽孢杆菌GX2 的摇瓶培养条件优化结果表明:GX2 的最佳培养基为摇瓶基础培养基,5 g/L 蔗糖和 5 g/L NaNO3, 装液量为 250 mL摇瓶装液100 mL。 通过摇床培养基及培养条件优化,可有效提高枯草芽孢杆菌GX2 的细胞浓度。
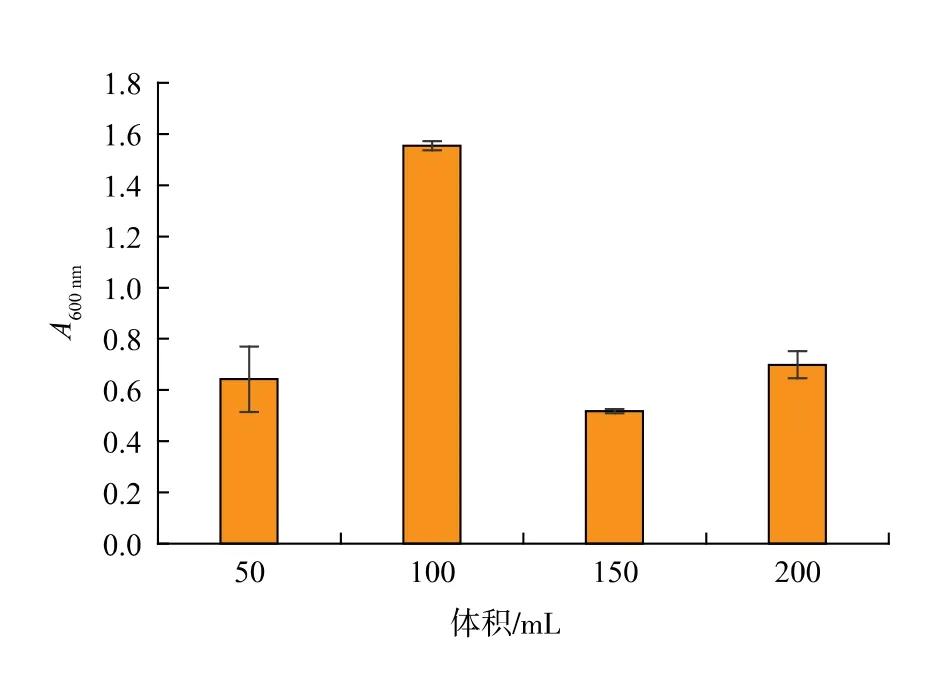
图4 装液量对菌株GX2 的细胞浓度的影响Fig.4 Effect of liquid loading on cell concentration of strain GX2
2.2 发酵罐分批补料技术研究
在实际的分批发酵过程中,连续或间隔补加限制性营养物质或新鲜培养基,称为分批补料发酵[25],可延长微生物的对数生长期和稳定期的持续时间,提高细胞浓度。 分批发酵过程在细胞浓度不断增加进而耗尽可利用底物时,细胞浓度不再增加,而分批补料发酵可有效解决这一问题[26],提高发酵效率。
2.2.1 发酵罐分批补料对细胞浓度的影响在摇瓶培养条件优化的基础上, 以3 L 发酵罐进行扩大培养,当蔗糖质量浓度低于初始质量浓度的一半以下时,补加质量质量浓度50 g/L 的蔗糖溶液至初始质量浓度, 研究发酵罐分批补料对枯草芽孢杆菌GX2 细胞浓度的影响,结果如图5 所示。
可见,与摇瓶培养不同,由于发酵罐可实现发酵条件特别是pH 的在线实时控制, 为枯草芽孢杆菌GX2 提供了良好的生长环境, 细胞繁殖速度加快,发酵至4 h 后即进入对数生长期,碳源(蔗糖)也快速被消耗, 在第8 小时时蔗糖质浓度由起始的5.0 g/L 左右降低至1.8 g/L,成为制约菌体生长的关键因素,此时,补加50 g/L 的蔗糖溶液至4.5 g/L 左右,细胞浓度再次呈快速增长趋势,在第9 小时时完成第二次补料,最终分批补料的发酵液最大A600nm达2.250,而分批发酵的A600nm为1.900,对应的活菌数分别为 1.8×1010、1.2×1010CFU/mL, 由此可见,分批补料操作可有效提高发酵液的营养细胞浓度。
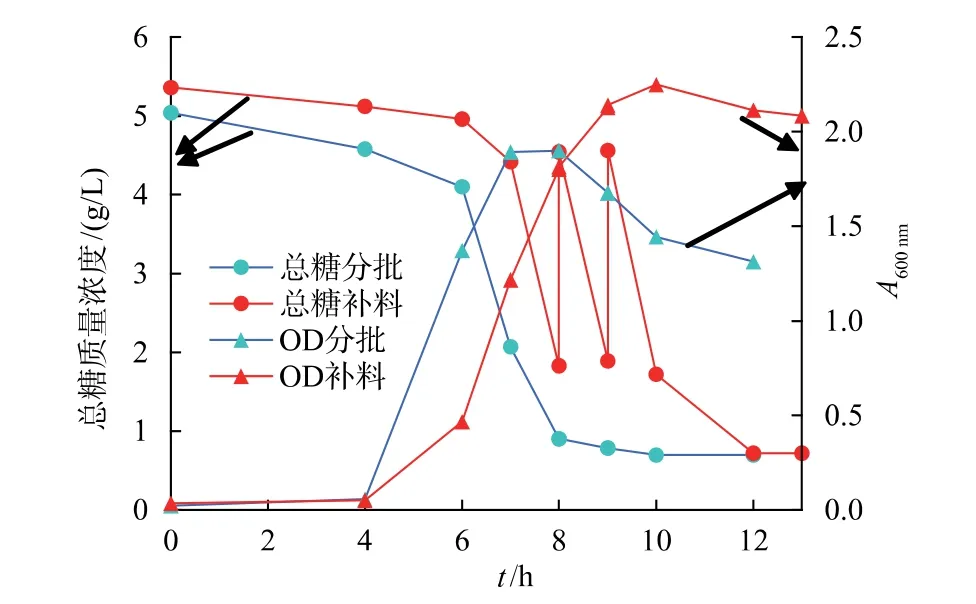
图5 菌株GX2 分批和分批补料发酵的细胞浓度及碳源消耗Fig.5 Cell concentration and carbon source consumption of batch and batch fed fermentation of strain GX2
2.2.2 发酵罐分批补料对芽孢率的影响图6 显示了枯草芽孢杆菌GX2 的芽孢发酵曲线,同时给出了活菌数和芽孢率随发酵时间的变化情况。 可见,随着发酵时间的延长,活菌和芽孢浓度和芽孢率均呈先增加后降低的变化趋势, 发酵至10 h 和11 h时,活菌和芽孢浓度达最大,分别为1.1×1010和7.2×109CFU/mL,此时,芽孢率也达最大,为 66.6%。 此后,活菌数开始下降,芽孢数也相应降低,说明发酵过程进入衰亡期。在这个基础上,发酵至9 h 时改变发酵条件,开展后续产芽孢条件优化研究。
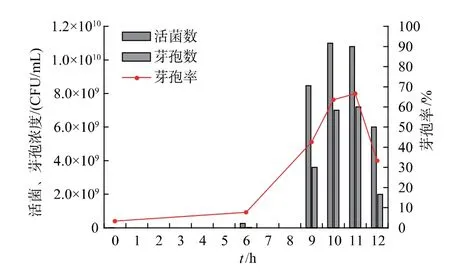
图6 菌株GX2 的芽孢发酵曲线Fig.6 Spore fermentation curve of strain GX2
2.3 发酵罐产芽孢条件优化
芽孢是产芽孢细菌在生长过程中形成的一种抗逆休眠体[27],因其具有耐热、抗辐射、耐酸碱及抗化学药物等特殊性质[28],可有效抵抗外界环境条件的变化,提高存活率,优化芽孢形成条件对微生物菌剂的制备具有一定的实践价值。 与菌体的生长繁殖相似,芽孢的形成同样受营养物质及环境条件等多因素的影响,在分批补料发酵培养提高细胞浓度的基础上,对影响枯草芽孢杆菌GX2 产芽孢的关键环境条件进行优化, 进一步提高芽孢数及芽孢率,可为提高好氧堆肥用微生物菌剂的品质及其实际应用效果奠定技术基础。
2.3.1 培养温度对枯草芽孢杆菌GX2 芽孢率的影响培养温度是影响微生物生长繁殖和芽孢形成的重要环境条件之一,它主要通过影响细胞内生物大分子酶和蛋白质的合成与活性来促进芽孢形成[14]。 作者在摇瓶实验优化的最佳培养基条件下进行培养,并采用分批补料技术,使得细胞浓度在培养9 h 时达到最大,然后调整培养温度,研究温度对芽孢杆菌GX2 芽孢率的影响, 结果如图7 所示。可见,培养温度可在一定程度上影响微生物的生长繁殖及芽孢的形成,随温度升高,活菌及芽孢浓度均呈大致增加的趋势,而芽孢率先升高后降低。 当培养温度为35 ℃时,活菌和芽孢浓度均较低,分别为 9.2×109、5.5×109CFU/mL,芽孢率为 59.8%。此后,随着培养温度升高, 活菌浓度和芽孢数逐步提高,50 ℃时,芽孢数和芽孢率均最大,分别为7.55×109CFU/mL 和70.6%。当温度进一步升高至55 ℃时,尽管活菌数和芽孢数略有升高, 但芽孢率开始下降,因此,后续产芽孢研究的培养温度采用50 ℃。
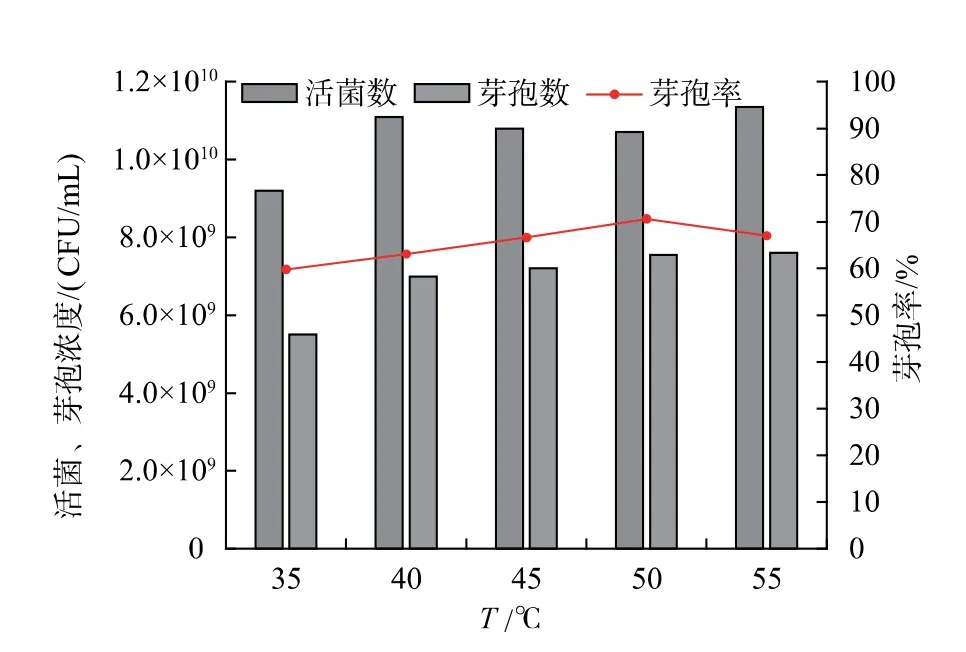
图7 培养温度对芽孢杆菌GX2 产芽孢的影响Fig.7 Effect of temperature on spore production of Bacillus GX2
2.3.2 搅拌转速对枯草芽孢杆菌GX2 芽孢率的影响好氧堆肥用枯草芽孢杆菌GX2 为好氧菌,氧气是其生长繁殖和芽孢生成的重要影响因素[29]。同时,溶解氧对发酵生产的稳定性和生产成本也具有较大影响[24]。发酵罐培养时,发酵液中的溶解氧与通气量和搅拌转速有关,当通气量一定时,可通过调整搅拌转速改变发酵液中的溶解氧浓度,进而优化发酵及产芽孢过程。搅拌转速对枯草芽孢杆菌GX2 产芽孢的影响如图8 所示。 可见,随搅拌转速的升高,活菌浓度不断下降,而芽孢浓度和芽孢率却呈先升高后降低的变化趋势。 由于发酵液中的细胞(活菌)浓度较高,约1.2×1010CFU/mL,较高的搅拌转速带来较大的剪切力,不利于细胞存活,因此,随搅拌转速升高活菌数不断下降,这与文献报道一致[30]。 同时,随搅拌转速升高,较高的剪切力使得更多营养细胞转化为芽孢,当搅拌转速为100 r/min 时,芽孢浓度和芽孢率均最大, 分别为9.7×109CFU/mL 和82.9%,进一步提高搅拌转速,芽孢率开始下降,这与较高转速下活菌数较低有关。
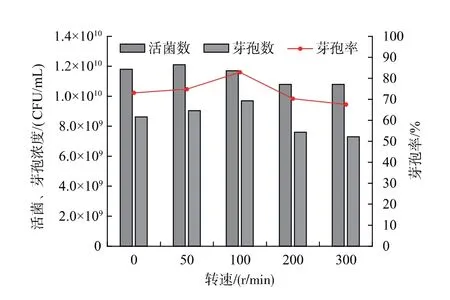
图8 搅拌转速对芽孢杆菌GX2 产芽孢的影响Fig.8 Effect of rotation speed on spore production by Bacillus GX2
2.3.3 pH 对枯草芽孢杆菌 GX2 芽孢率的影响不同微生物菌株适宜的pH 条件不同, 酸碱度影响微生物细胞膜的通透性、膜结构的稳定性以及物质的溶解性或电离性,致使微生物对营养物质的吸收和利用呈现差异[23],进而影响微生物的生长繁殖,并对芽孢杆菌的芽孢率产生影响。 由图9 可知,随pH升高,活菌数、芽孢数和芽孢率均呈先升高后降低的变化趋势。 当pH 为6.8 时, 活菌浓度最大,为1.25×1010CFU/mL。 当 pH 升高至 7.3 时,尽管活菌数开始降低,但芽孢浓度和芽孢率达最大,分别为9.7×109CFU/mL 和82.9%。进一步升高pH,活菌数、芽孢浓度以及芽孢率均明显降低。
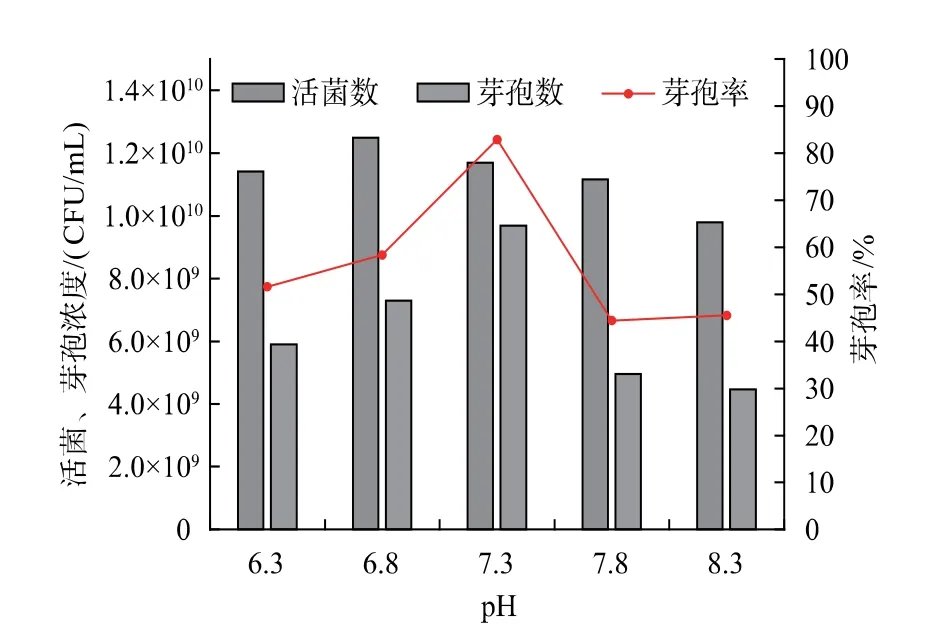
图9 pH 对芽孢杆菌GX2 产芽孢的影响Fig.9 Effect of pH on the spore production of Bacillus GX2
2.3.4 正交试验优化及验证正交试验是考察关键影响因素综合效应及进行多条件优化的研究方法之一。 这里,在单因素优化的基础上,以培养温度、搅拌转速和pH 为关键影响因素,选用正交表进行3 因素3 水平的正交试验研究,以活菌数和芽孢数为评价指标,研究关键影响因素对芽孢杆菌GX2产芽孢的综合效应, 因素水平设计如表1 所示,实验方案设计及结果如表2 所示,正交试验极差分析结果如表3 所示。结果表明,3 个影响因素对活菌数的影响主次顺序为pH>搅拌转速>培养温度, 由均值 k 得出最优组合为 A2B2C2,即 pH 为 7.3,培养温度为45℃,搅拌转速为100 r/min。 从芽孢率角度,3个影响因素的主次顺序与活菌数相似,但其最优组合不同,为 A1B3C3,即 pH 为 6.8,培养温度为 50 ℃,搅拌转速为150 r/min。
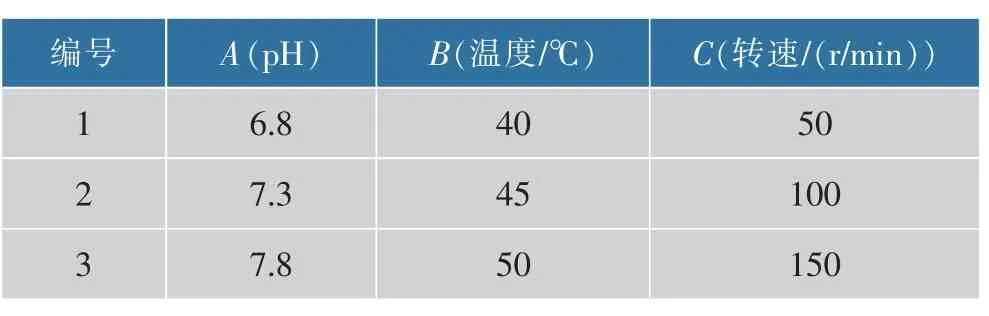
表1 正交试验因素水平Table 1 Orthogonal optimization experimental factors
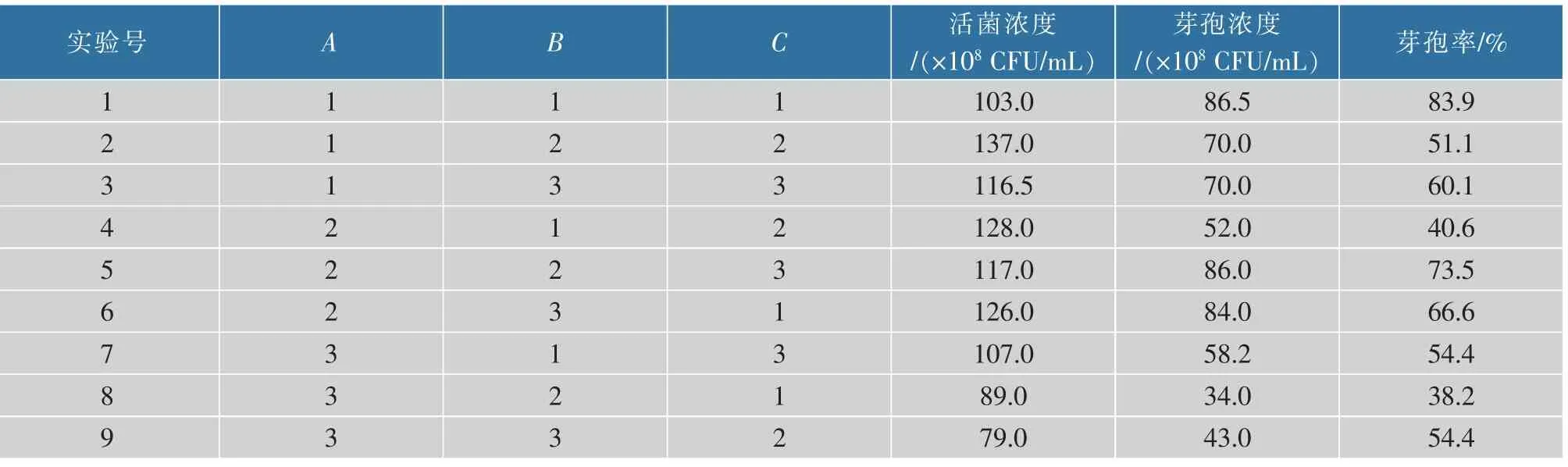
表2 正交优化设计及结果Table 2 Orthogonal optimization design and results
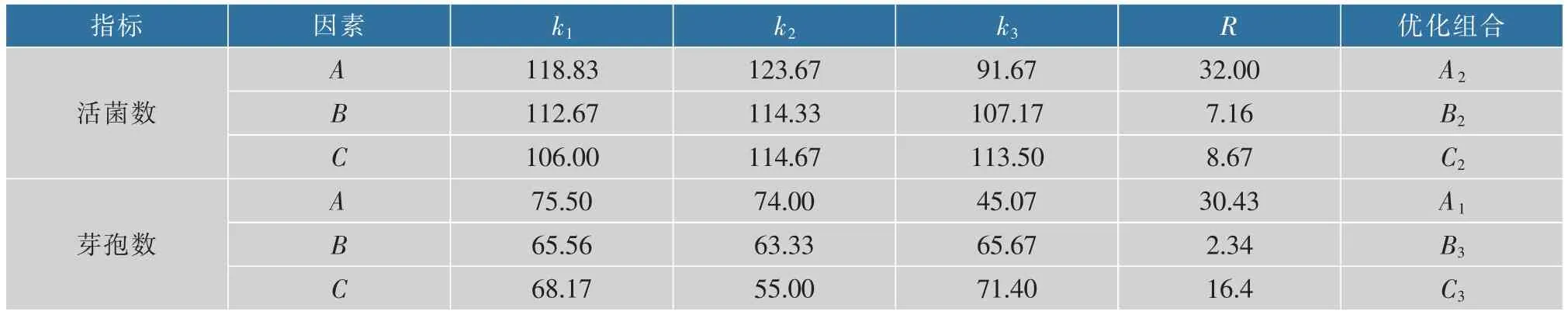
表3 极差分析Table 3 Range analysis
较高的活菌数是提高芽孢率的前提, 因此,从优化菌株生产性能,提高芽孢率的角度,选择枯草芽孢杆菌GX2 的活菌数和芽孢数均较高的培养条件和方案,确定最优方案为A1B3C3,即pH 为6.8,培养温度为50 ℃,搅拌转速为150 r/min,在此条件下进行3 L 发酵罐试验验证, 结果表明, 活菌数可达1.57×1010CFU/mL, 芽孢数达 1.32×1010CFU/mL,芽孢率为84.1%。与单因素优化相比,正交试验优化可进一步提高芽孢杆菌GX2 的芽孢率,是其工业化生产应用的重要参考。
3 讨 论
好氧堆肥过程中添加微生物菌剂已成为促进堆肥腐熟、缩短堆肥周期的重要方法之一[1]。 微生物菌剂的作用效果与活菌数密切相关,随着保存时间的延长,活菌数逐渐减少,影响堆肥效果[7]。 芽孢杆菌因其具有较强的抗逆性,能耐热、酸、碱等不良环境,有利于微生物菌剂活性的保持,提高产品质量及应用效果[31]。 Huo 等[32]通过研究多粘芽孢杆菌孢子和营养细胞在生物有机肥贮藏过程中的活性,发现纯孢子可提高储存期间的存活率和孢子形成。 优化芽孢杆菌的产芽孢条件,促进更多营养细胞转化为芽孢。
培养条件优化是产芽孢条件优化的重要前提。作者以实验室保存的堆肥用枯草芽孢杆菌GX2 为研究对象, 首先进行了摇瓶培养条件及培养基优化,在此基础上,采用分批补料策略在3 L 发酵罐上进行发酵培养, 所得发酵液的OD 值和营养细胞浓度可达 2.250 和 1.8×1010CFU/mL。 汪晶晶等[33]通过对淀粉芽孢杆菌的培养基及条件优化,发现菌体生长量有明显提高,A600nm由1.228 增加至1.6727。
目前,关于芽孢杆菌芽孢率的优化研究多是在摇床上完成的,郭晓军等[8]对堆肥用产蛋白酶的产芽孢条件进行了优化,芽孢率达95%。刘虎军等[32]对枯草芽孢杆菌进行了pH 和温度的产芽孢条件优化,生物量和芽孢数分别为 5.7×1010、5.2×1010CFU/mL,芽孢率达91%。 为实现工业化应用,发酵罐规模的产芽孢条件优化更具参考价值,为此,作者在摇瓶培养条件优化的基础上, 结合分批补料发酵技术,在3 L 发酵罐上进行了产芽孢条件优化, 经单因素及正交试验研究,获得了堆肥用枯草芽孢杆菌GX2的最佳产芽孢条件,即pH 为6.8,培养温度为50 ℃,搅拌转速为150 r/min,此时,芽孢浓度为1.32×1010CFU/mL,芽孢率为84.1%,研究结果可为芽孢杆菌在微生物菌剂中的工业化应用提供重要参考。
4 结 语
摇瓶培养条件优化结果表明, 枯草芽孢杆菌GX2 的最佳培养基为酪蛋白胨15 g/L、大豆蛋白胨5 g/L、NaCl 5g/L、蔗糖 5 g/L 和 NaNO35 g/L,最佳培养条件为pH 值7.3,250 mL 摇瓶的装液量为100 mL,培养温度为45 ℃。
在摇床培养条件优化的基础上, 在3 L 发酵罐上进行分批补料技术研究, 以进一步提高细胞浓度,结果表明,当发酵液中总糖浓度降低至起始值的一半以下时,开始补料,共补料两次,发酵液中的细胞浓度可达1.8×1010CFU/mL。
在获得较高细胞浓度后,通过单因素和正交试验,在3 L 发酵罐上对枯草芽孢杆菌GX2 的产芽孢条件进行了优化,结果表明,当pH 为6.8、培养温度为50 ℃和搅拌转速为150 r/min 时, 芽孢率可达84.1%。
