乳腺导管原位癌与乳腺导管原位癌伴微浸润的临床特征
2021-03-17汪进城许培权
汪进城,张 磊,许培权,张 杰
(1.蚌埠医学院第二附属医院肿瘤外科;2.蚌埠医学院第一附属医院肿瘤外科,安徽蚌埠 233000)
乳腺导管原位癌(ductal carcinoma in situ, DCIS)是指乳腺导管上皮恶性细胞局限于导管的基底膜内生长,也被称为零期癌或浸润前癌。随着乳腺钼靶和乳腺超声的普及,DCIS的检出数量有所增加。我国新发的DCIS在乳腺癌中的占比为10%~15%[1],而在欧美国家可以达到20%~30%[2]。美国抗癌联合会(AJCC)把浸润灶范围小于1 mm的DCIS定义为乳腺导管原位癌伴微浸润(ductal carcinoma in situ with microinvasion,DCIS-MI)。DCIS-MI在全部乳腺癌的占比为1%,在DCIS中的占比为10%~20%[3]。DCIS-MI被认为是DCIS发展成浸润性乳腺癌(invasive breast cancer,IBC)的中间阶段。当前临床上对DCIS与DCIS-MI的临床病理特点及分子分型差异的研究相对较少,基于此,本研究旨在探讨DCIS和DCIS-MI的临床病理特点和分子分型等方面的差异,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2015年12月至2018年12月蚌埠医学院第二附属医院和蚌埠医学院第一附属医院收治的92例乳腺癌患者的临床资料,根据疾病类型的不同将其分为DCIS组和DCIS-MI组。其中DCIS组患者56例,DCIS-MI组患者36例,所有患者均为女性。DCIS组患者年龄32~78岁,平均(49.3±6.5)岁;病程3个月 ~3年,平均(1.4±0.3)年;体质量指数(BMI)17.8~26.7 kg/m²,平均(22.4±0.5)kg/m²。DCIS-MI组患者年龄31~75岁,平均(49.5±6.3)岁;病程4个月 ~3年,平均(1.4±0.3)年;BMI 17.4~27.0 kg/m²,平均(22.5±0.7)kg/m²。两组患者的一般资料比较,差异无统计学意义(P>0.05),组间具有可比性。纳入标准:单侧原发性乳腺癌,且无远处转移者;组织类型是DCIS或DCIS-MI者;临床病理资料完整者。排除标准:多发病灶者;合并严重的心肺功能障碍者。本研究经蚌埠医学院第二附属医院和蚌埠医学院第一附属医院医学伦理委员会批准。
1.2 研究方法 本研究按照AJCC标准对DCIS和DCIS-MI进行诊断,所有结果均经两位副主任病理医师检测。根据世界卫生组织组织学分类标准进行组织学分级,依据核分裂象、细胞极性和是否伴有坏死分为低、中、高三级[4]。免疫组化判断标准:①参考美国临床肿瘤学会 / 美国病理学家学会建议标准[5],雌激素受体(ER)或孕激素受体(PR)阳性表达:≥ 1%的肿瘤细胞核染色;ER或PR阴性表达:<1%的肿瘤细胞核染色。②参考《乳腺癌HER2检测指南》[6],0:无着色或≤ 10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色;1+:>10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色;2+:>10%的浸润癌细胞呈现弱 - 中等强度的完整细胞膜染色或≤ 10%的浸润癌细胞呈现强而完整的细胞膜染色;3+:>10%的浸润癌细胞呈现强、完整且均匀的细胞膜染色。0-1+为阴性,3+为阳性,2+应进一步行原位杂交检测或更换标本重新检测。根据免疫组化结果本组病例分为根据ER、PR和HER-2的实验结果,将乳腺癌分为:腔面A型[Luminal-A型,ER和(或)PR阳性、HER-2阴性],腔面B型[Luminal-B型,ER和(或)PR阳性、HER-2阳性],HER-2过表达型(ER、PR均阴性、HER-2阳性)和三阴型(ER、PR、HER-2均阴性)。
1.3 随访情况 所有患者术后2年内每3个月门诊随访1次。随访内容包括体格检查、乳腺超声、腹部彩超、妇科检测及胸部正位片,根据患者有无骨痛症状决定是否行骨扫描与骨密度检测。无病生存期(DFS)定义为从确诊之日起至复发或转移的时间。
1.4 统计学分析 应用SPSS 26.0统计软件进行数据分析,计数资料以[ 例(%)]表示,行χ2检验;生存分析采用Kaplan-Meier进行分析。以P<0.05为差异有统计学意义。
2 结果
2.1 临床病理特征 DCIS组患者肿瘤直径≤ 2 cm、核分级低级、ER阳性占比均显著高于DCIS-MI组,差异均有统计学意义(均P<0.05);两组患者年龄、淋巴是否转移及PR、HER-2阳性情况比较,差异均无统计学意义(均P>0.05),见表1。
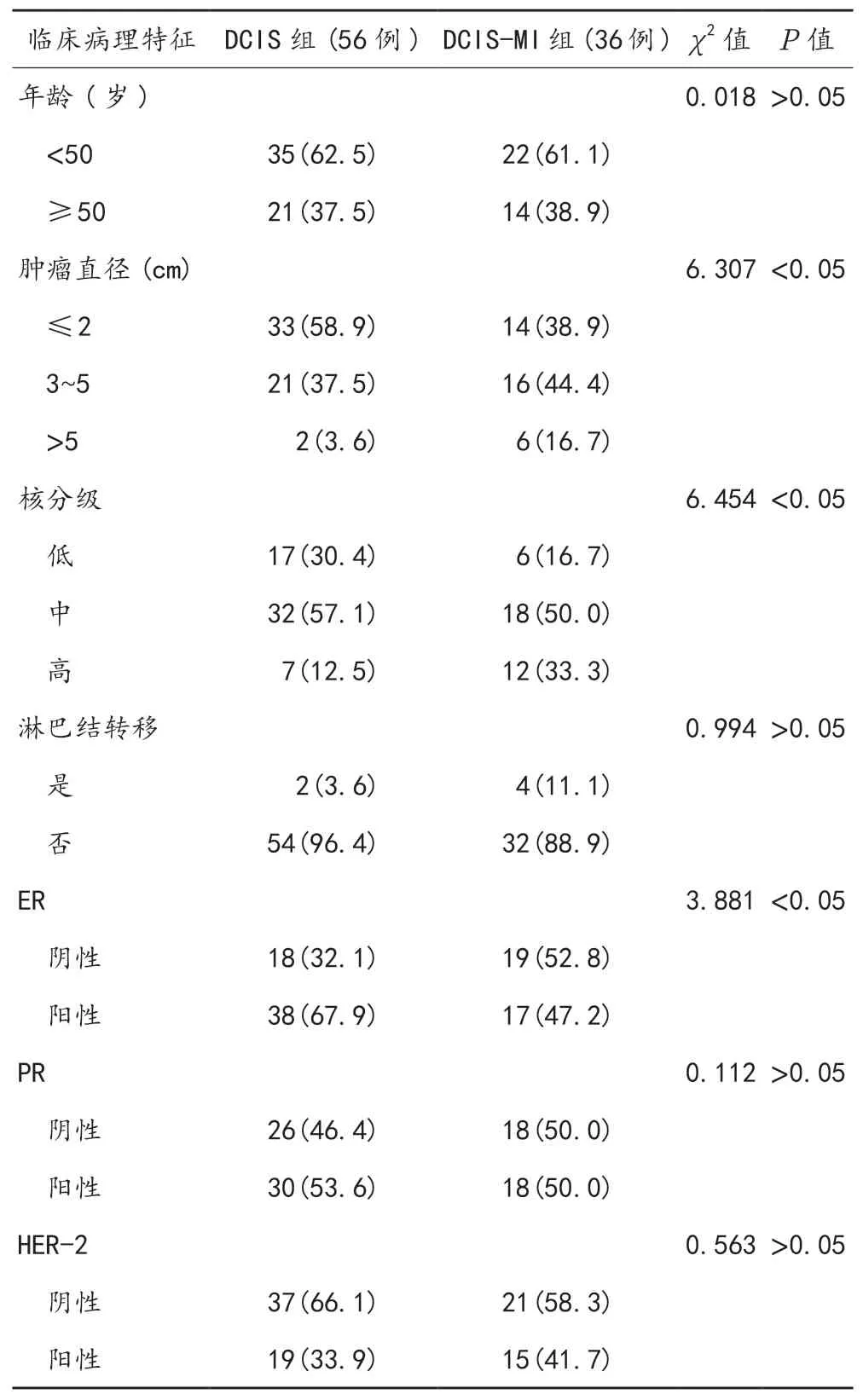
表1 两组患者临床病理特征比较[ 例(%)]
2.2 分子分型分布情况 DCIS组Luminal-A型患者占比显著高于DCIS-MI组,三阴型患者占比显著低于DCIS-MI组,差异均有统计学意义(均P<0.05),两组Luminal-B型和HER-2过表达型患者的占比比较,差异均无统计学意义(均P>0.05),见表2。

表2 两组患者分子分型分布比较[ 例(%)]
2.3 生存分析 随访中,DCIS组患者有1例复发转移,DCIS-MI组患者有2例复发转移,两组患者均未出现死亡病例。随访至2020年12月,Kaplan-Meier生存曲线分析两组患者DFS分别为98.2%和94.4%,差异无统计学意义(P>0.05)。
3 讨论
乳腺癌是严重威胁女性健康的恶性肿瘤之一。DCIS也被称为导管内癌,是指起源于乳腺末梢导管小叶单位的癌细胞克隆样增生,并在乳腺导管管腔内聚集,但尚未突破基底膜而局限在乳腺导管内的病变,被认为是乳腺癌的癌前病变[7]。临床上DCIS的预后较好,但如果不及时治疗,有20%~50%的DCIS患者最终会发展成IBC[8]。目前DCIS向IBC发展的机制尚不清楚,多种因素可能造成了DCIS向IBC的转化,包括肌上皮等肿瘤微环境改变和肿瘤细胞基因突变等[9]。由于缺乏有效的DCIS浸润转化的评价指标,临床实践中对DCIS存在治疗不足或过度治疗的现象。本研究通过比较DCIS与DCIS-MI的临床病理特点与分子分型的差异,从而研究造成DCIS浸润发展的危险因素。
研究指出,乳腺导管原位癌的肿瘤大小与是否发生微浸润或浸润存在正相关关系,随着肿瘤体积的增大,发生微浸润或浸润的概率会明显提高[10]。研究显示,50%~75%的DCIS表达ER和(或)PR,且高表达的ER和PR与低级别的DCIS相关,HER-2的表达也明显高于浸润性导管癌,达40%~60%[11]。本研究结果显示,两组患者在年龄、淋巴结状态、PR和HER-2等方面比较,差异均无统计学意义;DCIS组患者中ER阳性38例(67.9%),PR阳性30例(53.6%);DCIS-MI组ER阳性17例(47.2%),PR阳性18例(50%);两组患者在核分级和ER表达等方面比较,差异均有统计学意义,故此可以推测ER、PR的阳性表达在癌细胞向周围组织发生初始浸润中可能起到重要作用。淋巴结状态方面,由于乳腺淋巴管与导管走向一致,因此微浸润也有发生腋窝淋巴结转移的风险。而从DCIS的发生机制角度分析,一般不会发生淋巴结转移,但临床实践中发现有少量DCIS患者会发生腋窝淋巴结转移。有学者认为DCISMI患者发生淋巴结转移的概率更高,提示对淋巴结的处理十分重要[10]。但是在本次研究中,两组患者的淋巴结状态比较,差异无统计学意义,这可能与本研究病例数较少有关。HER-2的高表达一直被认为是乳腺癌发生转移和复发的重要危险因素之一,HER-2的表达水平与乳腺癌的侵袭性呈正相关,HER-2高表达提示预后不良[12]。汪雯洁等[13]指出DCIS患者与DCIS-MI患者的HER-2高表达之间存在显著差异,认为HER-2过度表达的DCIS-MI,其肿瘤细胞的生物学行为比DCIS更具侵袭性,DCIS-MI可能预示着不良预后。在本次研究结果中,HER-2在DCIS组和DCIS-MI组的表达比较,差异无统计学意义,但具有升高的趋势,由此可见,HER-2高表达在DCIS早期浸润中可能发挥重要作用,但尚需要大样本进行验证。
本研究还对比了DCIS和DCIS-MI患者的分子分型分布,结果显示,DCIS组Luminal-A型患者占比显著高于DCIS-MI组,三阴型患者占比显著低于DCISMI组。刘思吟等[14]分析乳腺导管原位癌伴微浸润的临床病理学特点显示,DCIS与DCIM-MI的分子分型差异有统计学意义,DCIS中Luminal-A型的比例明显高于DCIS-MI,与本次研究结果一致。但国内外对DCIS和DCIS-MI预后差异观点不一致,刘静等[15]研究显示,两组患者的预后差异不明显,而PU等[16]认为DCISMI具有更大的复发风险。本研究结果显示,DCIS和DCIS-MI患者预后无差异。DCIS-MI的一些生物学特征与DCIS是不同的,术前的粗针穿刺并不能涵盖全部,且术中冰冻病理检查也有一定的局限性,因此关于DCIS-MI的临床表现、影像学特征等的检查也是十分重要的。
综上,DCIS和DCIS-MI患者的临床病理特征和分子分型有差异;与DCIS相比,DCIS-MI的肿瘤体积大,病理核分级高,ER阳性率低,Luminal-A型占比低。但尚需要大样本进行临床研究,来探究其发生机制。
