雄激素受体表达在乳腺癌患者预后评估中的意义
2021-03-17王晓露
王晓露,王 婷,谢 丽*
(1.南京鼓楼医院肿瘤科;2.南京鼓楼医院病理科,江苏南京 210008)
乳腺癌是女性最常见的恶性肿瘤,该病具有十分明显的激素依赖性,雌激素受体(ER)、孕激素受体(PR)等类固醇类激素受体在其发生与发展中发挥着重要作用,但是有部分ER、PR阳性乳腺癌患者在内分泌治疗中会出现耐药,使其无法从传统的内分泌治疗中获益,只能选择不良反应更大的化疗方案[1]。雄激素受体(AR)与ER、PR同属类固醇激素受体,有研究表明,AR可与雄激素结合后活化,进入细胞核中与雄激素基因应答元件连接,引导靶基因转录,调控细胞生长分化,使乳腺癌细胞凋亡。有研究认为,AR在乳腺癌组织中表达水平较高,检测其水平可用于评估乳腺癌患者预后[2]。目前,AR在乳腺癌发病过程中的作用及其具体机制尚未阐明,是否可作为该病的潜在治疗靶点仍无定论。鉴于此,本研究主要探讨AR表达状态几期在乳腺癌患者预后评估中的意义,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2018年1月至2019年6月南京鼓楼医院收治289例乳腺癌患者的临床资料。患者年龄29~85岁,平均(55.47±6.32)岁;肿瘤直径0.9~13 cm,平均(2.71±1.25)cm;乳腺癌分子分型[3]:Luminal A型52例,Luminal B型161例,人表皮生长因子受体 -2(HER-2)过表达型33例,三阴性型43例。组织学分级[4]:Ⅰ级20例,Ⅱ级221例,Ⅲ级48例。纳入标准:符合《乳腺肿瘤学(第2版)》[5]中的相关诊断标准者;均为女性;病理组织活检确诊为浸润性乳腺癌者;临床资料完整者;均接受手术治疗者等。排除标准:出现远处脏器转移或合并其他恶性肿瘤者;合并严重基础疾病者;术前曾接受放化疗、激素或中药等治疗者等。本研究经南京鼓楼医院医学伦理委员会批准。
1.2 研究方法 术后病理标本组织均在10%中性福尔马林液中固定,蜡块包埋后连续切片(厚度4 μm)。常规脱蜡后,在0.3%过氧化氢溶液中浸泡10 min,去除内源性过氧化物酶,采用pH值为8的三羟甲基氨基甲烷(Tris) / 乙二胺四乙酸(EDTA)缓冲液进行抗原修复。采用全自动免疫组化染色仪[罗氏诊断产品(上海)有限公司,型号:BenchMark XT],运用二抗 - 酶标多聚体(EnVision)两步免疫组化染色法进行病理组织切片染色,主要观察乳腺癌组织中AR、ER、PR、HER-2及细胞增殖核抗原(Ki-67)阳性表达情况。其中,AR、ER、PR阳性判读标准:≥ 10%的肿瘤细胞核内出现黄色、棕黄色、深棕色或褐色颗粒则为阳性;Ki-67判读标准:以≥ 14%肿瘤细胞核内出现棕色或深棕色颗粒判定为高表达,反之则为低表达。HER-2判读标准: > 10%的肿瘤细胞呈强而完整、均匀的细胞膜染色为HER-2阳性;>10%的肿瘤细胞呈弱至中等强度且完整的细胞膜染色为HER-2疑似阳性,此时需与荧光原位杂交结果结合予以进一步判读,如HER-2/17号染色体中间着丝粒区(CEP17) ≥ 2.0或该比值<2.0但HER-2拷贝数 / 肿瘤细胞数的比值 ≥ 6.0时判读为HER-2阳性[6]。乳腺癌分子分型为Luminal A型:ER/PR阳性且HER-2阴性,Ki-67低表达(<14%);Luminal B型:ER/PR阳性,HER-2阳性或ER/PR阳性,HER-2阴性,Ki-67高表达(≥ 14%);HER-2过表达型:ER、PR均阴性,HER-2阳性;三阴性型:ER、PR、HER-2均阴性[7]。
1.3 观察指标 ①分析AR、ER、PR及Ki-67在乳腺癌组织中的阳性表达情况。②分析AR在不同分型乳腺癌组织中的表达情况。③分析AR在不同组织学分级乳腺癌组织中的表达情况。④分析乳腺癌组织AR表达与ER、PR、Ki-67表达的关系。
1.4 统计学分析 采用SPSS 24.0统计软件分析数据,计数资料以[ 例(%)]表示,两组间比较采用χ2检验,多组间比较采用χ2趋势检验。以P<0.05为差异有统计学意义。
2 结果
2.1 AR、ER、PR及Ki-67在乳腺癌组织中的阳性表达情况 经EnVision两步免疫组化染色法病理组织切片染色后,可见AR阳性信号呈棕黄色,位于细胞核,见图1-A;ER阳性信号呈深棕色,位于细胞核,见图1-B;PR阳性信号呈棕黄色颗粒,位于细胞核,见图1-C;Ki-67高表达时肿瘤细胞核内出现棕色或深棕色颗粒,见图1-D。
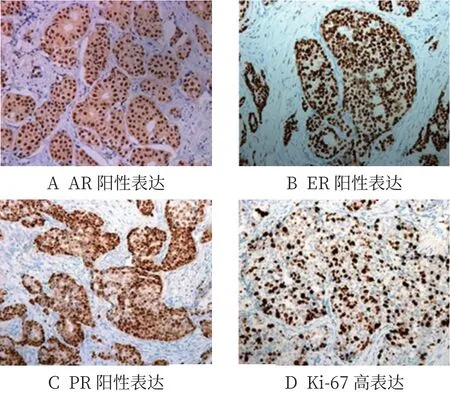
图1 乳腺癌组织中AR、ER、PR、Ki-67免疫组织化学染色(×200)
2.2 AR在不同分型乳腺癌组织中的表达情况 289例乳腺癌患者AR阳性表达率为65.40%(189/289),AR在Luminal A型、Luminal B型、HER-2过表达型乳腺癌患者病理组织中阳性表达率均显著高于三阴性型,差异均有统计学意义(均P<0.05),见表1。

表1 AR在乳腺癌不同分型中的表达情况[ 例(%)]
2.3 AR在乳腺癌不同组织学分级中的表达情况 AR在组织学分级Ⅰ级、Ⅱ级中的阳性表达率均显著高于Ⅲ级,差异均有统计学意义(均P<0.05),见表2。

表2 AR在乳腺癌不同组织学分级中的表达情况比较[ 例(%)]
2.4 乳腺癌组织中AR表达与ER、PR、Ki-67表达的关系 乳腺癌病理组织ER、PR阳性表达患者的AR阳性表达率均显著高于ER、PR阴性表达患者,而乳腺癌病理组织Ki-67低表达患者的AR阳性表达率显著高于Ki-67高表达患者,差异均有统计学意义(均P<0.05),见表3。

表3 AR表达与ER、PR、Ki-67的关系[ 例(%)]
3 讨论
乳腺癌是高度激素依赖及高度异质性肿瘤,目前针对ER、PR的内分泌治疗已经取得了重大进展,但内分泌治疗耐药和ER、PR阴性的患者对内分泌治疗不敏感甚至无效,导致患者普遍预后不佳。既往有研究认为,AR、ER和PR同属于核受体超家族成员,其主要存在于靶细胞核内,属乳腺癌抑癌基因,抑制肿瘤细胞增殖、侵袭乃至转移[8]。AR已经成为乳腺癌的一个新的潜在预后因素及治疗靶点,现逐渐引起关注,但AR表达在乳腺癌患者预后评估中的意义目前尚无明确定论。
本研究发现,289例乳腺癌患者中AR阳性表达率为65.40%,与马少君等[9]报道基本一致,但低于张兴洋等[10]报道,这可能与纳入对象的临床病理特征、分子亚型构成情况或AR阳性判定标准存在差异有关。三阴性型乳腺癌是基底细胞样型中的一类乳腺癌,其侵袭性较强,远处转移率较高,患者易出现骨转移、内脏转移及脑转移;与其他3种分子分型相比,三阴性型乳腺癌的恶性程度较高,预后相对更差,肿瘤分级较高,最易复发[11]。组织学分级反映了肿瘤细胞生长及分化状态,当患者组织学分级高时,表明肿瘤细胞浸润周边组织能力和浸润面积增加,肿瘤组织易于向周围浸润。雄激素可与雌激素协同刺激乳腺癌细胞生长及增殖,而AR可与雄激素结合并被激活,从而通过激活TP53和TP73调控细胞周期、细胞凋亡,上调let-7a表达等一系列调控作用抑制乳腺癌细胞增殖。本研究结果显示,AR在Luminal A型、Luminal B型、HER-2过表达型中阳性表达率均显著高于三阴性型,AR在组织学分级Ⅰ级、Ⅱ级中的阳性表达率均显著高于Ⅲ级,表明AR在三阴性型乳腺癌和组织学分级为Ⅲ级中的阳性表达率较低,其表达状态与乳腺癌恶性程度及预后相关,AR表达水平越低,提示患者预后越差。
ER和PR是目前公认的判断乳腺癌恶化程度的指标,AR可作为乳腺癌细胞中ERα信号通路的直接抑制因子,抑制ER阳性乳腺癌细胞增殖;此外,AR在ER靶基因上有独特的结合位点,可通过与该位点结合直接抑制其转录,也可通过竞争性结合调控因子简介抑制其转录,从而抑制乳腺癌细胞的增殖;PR是一种功能性ER表达的标志物,为ERα的作用靶标,有研究认为,与PR阴性相比,PR阳性分化程度更高,侵袭性更低,预后良好;Ki-67即细胞增殖指数,标记处于增殖周期中的细胞中,其组织分化越差时,表达则处于较高水平,而AR可通过负性调节miR-21的表达而抑制细胞增殖作用[12]。本研究结果显示,ER、PR阳性表达患者AR阳性表达率均显著高于ER、PR阴性表达患者,Ki-67低表达患者AR阳性表达率则显著高于Ki-67高表达患者,表明ER、PR阳性表达时,AR高表达,Ki-67阴性表达时,AR高表达,进一步提示AR与乳腺癌预后相关。但也有研究表明,AR和ER可利用相似的顺式调控区域,AR与ER竞争结合雌激素反应元件进而减弱ER的转录活性,在ER和AR均为阳性的乳腺癌患者中,AR导致细胞凋亡,预示患者预后良好,而在ER阴性,AR阳性的患者中,AR通过结合雄激素反应元件导致细胞增殖,成为预后不良的因子[13]。因此,AR的表达及生物学功能在ER不同表达乳腺癌患者中有显著差异性,还需分类对其进行评估。
综上,三阴性型乳腺癌AR呈低表达,组织学分级Ⅰ级、ER和PR阳性表达患者、Ki-67阴性表达患者AR呈高表达,推测AR表达水平可作为评估乳腺癌患者预后的重要指标,AR高表达的乳腺癌患者预后较好,而AR在乳腺癌中的具体作用机制未来仍需进一步进行探索。
