基于调节外泌体释放电针对大鼠坐骨神经损伤后功能恢复的影响
2021-03-17刘玉璞杨溢铎赵恬田李涵赵玥国海东邵水金
刘玉璞,杨溢铎,赵恬田,李涵,赵玥,国海东,邵水金
实验研究
基于调节外泌体释放电针对大鼠坐骨神经损伤后功能恢复的影响
刘玉璞,杨溢铎,赵恬田,李涵,赵玥,国海东,邵水金
上海中医药大学基础医学院人体解剖教研室,上海 201203
观察抑制血清外泌体水平对电针治疗大鼠坐骨神经损伤的影响,探讨电针是否通过调节外泌体释放促进大鼠坐骨神经损伤后功能恢复。构建大鼠坐骨神经损伤模型,分组进行电针治疗和药物干预,采用GW4869腹腔注射抑制外泌体释放。观察大鼠患侧足一般情况,采用足迹分析评价坐骨神经功能指数,采用神经传导速度比和腓肠肌湿重比评价坐骨神经功能恢复情况,采用免疫荧光染色NF200、MBP分别标记轴突和髓鞘评价神经的再生修复情况。抑制血清外泌体水平后电针对大鼠坐骨神经损伤治疗效果受到影响。与模型组比较,电针组促进大鼠坐骨神经损伤后功能恢复效果显著;与电针组比较,电针+GW4869组大鼠足底溃疡严重,坐骨神经功能指数、坐骨神经功能恢复情况、神经再生修复情况均较差。电针通过调节外泌体释放可促进大鼠坐骨神经损伤后功能恢复。
坐骨神经损伤;电针;外泌体;功能恢复;大鼠
周围神经损伤(peripheral nerve injury,PNI)是临床常见病,可导致神经性疼痛和功能障碍,严重影响患者生活质量。如何更好地促进PNI后神经修复和功能恢复至关重要[1]。电针对PNI后功能恢复效果确切,已被大量文献报道[2-3]和我们前期实验[4-5]所证实,并在临床广为应用,但电针作用机制目前仍未被完全阐明。外泌体是双层膜结构的细胞外囊泡,包含丰富的RNA和蛋白,可作为细胞间信息交流的良好载体[6]。基于电针有促进外泌体释放的趋势[7-8],而外泌体与PNI后修复关系密切[9-10],本研究通过构建坐骨神经损伤(sciatic nerve injury,SNI)模型大鼠,分组进行电针治疗和GW4869干预抑制外泌体释放,检测神经功能恢复和结构再生情况,探讨电针是否通过调节外泌体释放发挥促进SNI后功能恢复和结构再生的作用。
1 实验材料
1.1 动物
雄性Wistar大鼠30只,体质量(200±20)g,SPF级,上海中医药大学动物实验中心提供,动物许可证号SYXK(沪)2014-0008。饲养于上海中医药大学动物实验中心动物房,温度22~25 ℃,相对湿度40%~70%,12 h交替照明,自由摄食饮水。
1.2 主要试剂与仪器
一抗:神经丝蛋白200(neurofilament-200,NF200),美国Sigma,货号N4142;一抗:髓鞘碱性蛋白(myelin basic protein,MBP),英国Abcam,货号ab40390;荧光二抗,美国Thermo Fisher Scientific,货号A27039;山羊血清,美国Sigma,货号G9023;抗荧光淬灭封片液,上海碧云天,货号P0123;外泌体抑制剂GW4869,Sigma,货号D1692。倒置荧光显微镜(IX51,Olympus),G6805A型电针治疗仪(常州英迪电子医疗器械有限公司),3-0外科皮肤缝合线和9-0神经外膜缝合线(上海浦东金环),RM6240E/EC多道生理信号采集处理系统(成都仪器厂)。
2 实验方法
2.1 造模
大鼠适应性饲养1周后,腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉,行右侧大腿后外侧切口,显微镜下于右侧梨状肌下缘下约8 mm处,用双面刀片切断坐骨神经干,然后在体视显微镜下以9-0神经外膜缝合线缝合神经外膜。无菌生理盐水冲洗伤口,3-0外科皮肤缝合线缝合伤口。
2.2 分组及干预
造模完成后,实验大鼠随机分为模型组、电针组和电针+GW4869组,每组10只。模型组每日常规饲养,不予任何治疗;电针组使用G6805A型电针治疗仪,电针大鼠右侧“环跳”(正极)及“足三里”(负极),选用断续波,频率5 Hz,以肌肉出现轻微抽动为度,每次20 min,每日1次,每周6次,共治疗3周;电针+GW4869组在电针组处理的基础上腹膜腔注射GW4869,剂量1 mg/kg,隔日注射,以抑制大鼠血清外泌体释放。
2.3 一般观察
观察大鼠伤口情况、足部皮肤厚薄、足趾红肿、右后肢肌肉及关节活动等变化情况。
2.4 神经再生功能检测
2.4.1 足迹分析评价坐骨神经功能指数
以碳素墨水着色大鼠双后足,使其行走于狭长纸盒,盒底衬垫白纸,收集大鼠实验侧(E)和正常侧(N)足迹,分别测量足印长度(printlength,PL,足跟与第3趾趾尖间距)、足趾跨距(toespread,TS,第1~5趾跨距)、中间趾跨距(intermediate toe spread,ITS,第2~4趾跨距),计算坐骨神经功能指数(SFI)。SFI=-38.3×PL+109.5×TS+13.3×ITS-8.8。SFI正常值为0,-100为完全损伤,数据越接近0表明神经功能恢复越好[12]。
2.4.2 神经传导速度比和腓肠肌湿重比检测
大鼠麻醉后俯卧位固定在固鼠板上,于双下肢后部坐骨神经分布区域备毛,使用RM6240E/EC多道生理信号采集处理系统检测神经传导速度。于坐骨结节下方,坐骨神经两侧分别插入1对针灸针并接1对刺激电极;于坐骨神经下段两侧,腘窝上方分别插入1对针灸针并接1对接收电极。两对电极排列须平行。然后给予强度1 mV、波宽0.2 ms的电刺激,点击软件传导速度测量选项后弹出文本框,先以直尺测量并记录2对电极之间的距离并输入,选择手动测量后再通过波形观察标记记录1次兴奋传播所需时间(2个动作电位峰值相差时间),即可得到传导速度。距离/时间为该侧坐骨神经传导速度,计算患侧与健侧神经传导速度比,比值越大表明神经功能恢复越好。
大鼠麻醉后分别取双侧下肢腓肠肌并称取湿重,计算患侧与健侧比值,比值越大表明肌肉萎缩越少。
2.4.3 轴突和髓鞘免疫荧光染色
NF200是神经元骨架蛋白,被广泛用以标记轴突[12-13]。SNI后可发生瓦勒变性,轴突崩解消失后再生[14],因此,通过坐骨神经横截面NF200检测可反映轴突再生情况。取患侧坐骨神经4%多聚甲醛固定,梯度蔗糖脱水,OCT包埋,10 μm横截面冰冻切片,再进行免疫荧光染色。PBS清洗,0.5%Triton X-100破膜,山羊血清封闭,一抗NF200或MBP 4 ℃度孵育过夜,分别染色轴突和髓鞘,次日PBS清洗3次,荧光二抗避光孵育,再清洗3次,抗荧光淬灭封片液封片,最后荧光显微镜下观察拍照。使用Image J软件评价轴突和髓鞘情况。每组随机选取10个视野染色图片,转化为8-bit灰度后减去背景,调整阈值后设置size为1以上,排除可能的非特异性杂点,然后统计轴突和髓鞘数目。
3 统计学方法
4 结果
4.1 一般情况
造模后1周大鼠手术伤口基本结痂愈合,患侧足呈背伸、外展、外翻状态,足趾并拢呈爪样,跛行步态且行走不稳或拖步,各组大鼠患侧均出现肌肉萎缩、足趾蜷缩、无法伸展、踝部红肿等,且轻重程度不一。3周后足底观察发现,与模型组比较,电针组大鼠足趾蜷缩有所改善;与模型组和电针组比较,电针+GW4869组大鼠足底溃疡明显严重。见图1。
4.2 坐骨神经功能指数评价
与模型组比较,电针组大鼠坐骨神经功能指数明显升高(<0.01);与电针组比较,电针+GW4869组大鼠坐骨神经功能指数明显降低(<0.05)。见图2。
4.3 神经传导速度比和腓肠肌湿重比检测结果
与模型组比较,电针组和电针+GW4869组大鼠神经传导速度比和腓肠肌湿重比明显升高,差异有统计学意义(<0.05);与电针组比较,电针+GW4869组大鼠神经传导速度比和腓肠肌湿重比明显降低,差异有统计学意义(<0.01)。见图3。
4.4 轴突免疫荧光染色结果
坐骨神经NF200免疫荧光染色显示,与模型组比较,电针组大鼠NF200表达明显升高,差异有统计学意义(<0.05);与电针组比较,电针+GW4869组大鼠NF200表达明显降低,差异有统计学意义(<0.05)。见图4。
4.5 髓鞘免疫荧光染色结果
与模型组比较,电针组大鼠MBP表达明显升高,髓鞘数目和完整性均有改善,差异有统计学意义(<0.05);与电针组比较,电针+GW4869组大鼠MBP表达明显降低,髓鞘数目减少,差异有统计学意义(<0.05),且有较多呈不规则形状。见图5。
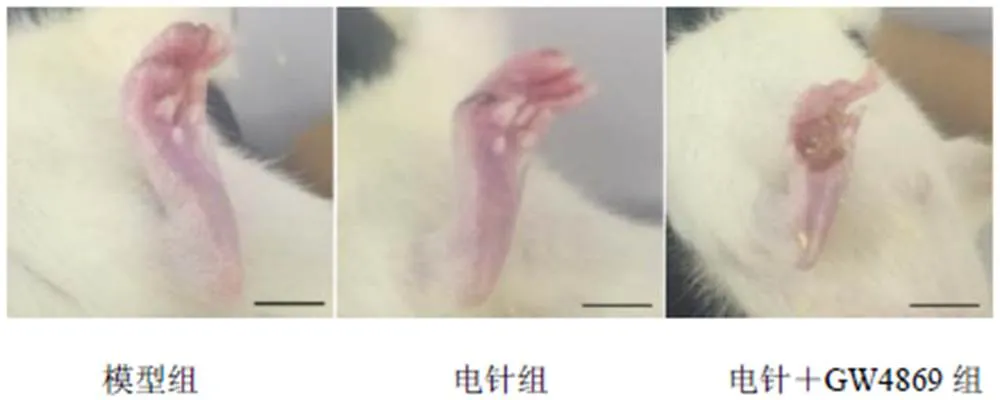
图1 各组大鼠足底一般情况(标尺=0.5 cm)
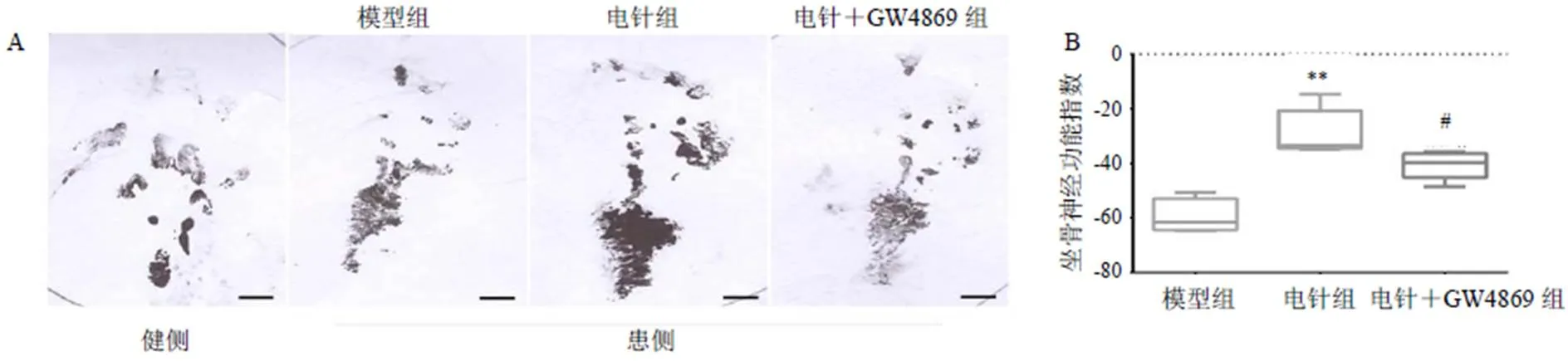
注:A.大鼠足迹;B.坐骨神经功能指数统计;与模型组比较,**P<0.01;与电针组比较,#P<0.05
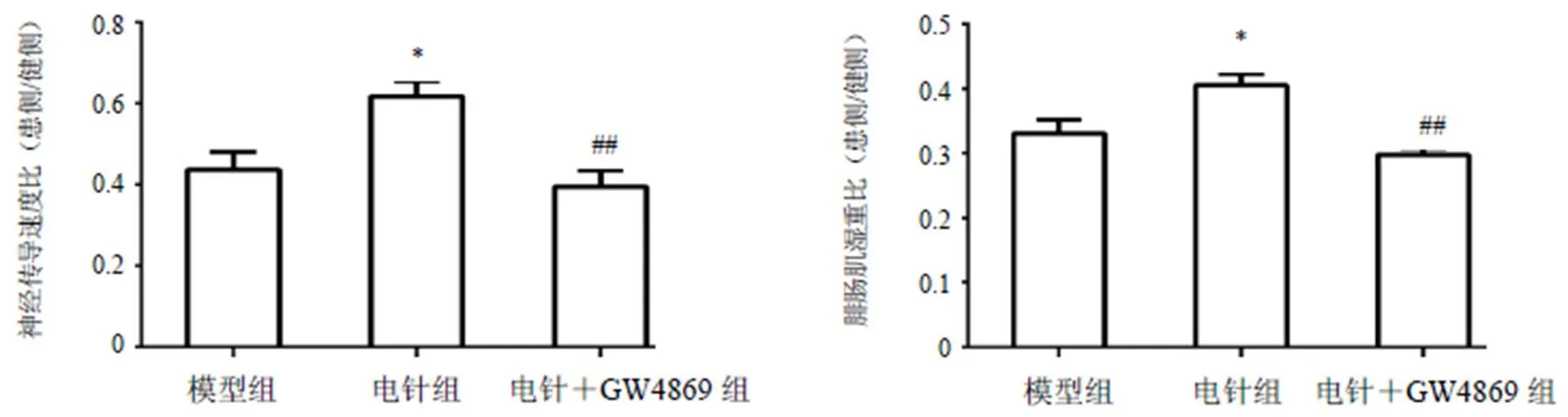
注:与模型组比较,*P<0.05;与电针组比较,##P<0.01
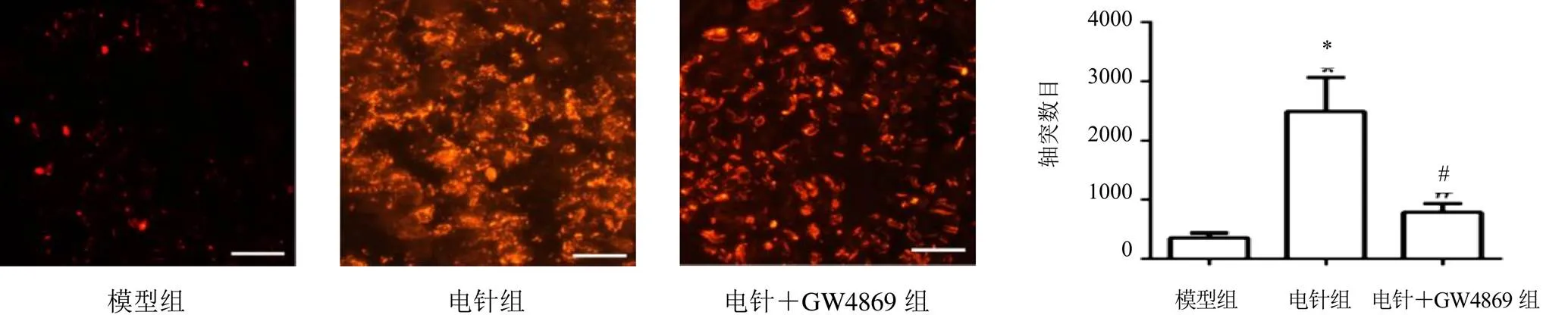
注:与模型组比较,*P<0.05;与电针组比较,#P<0.05
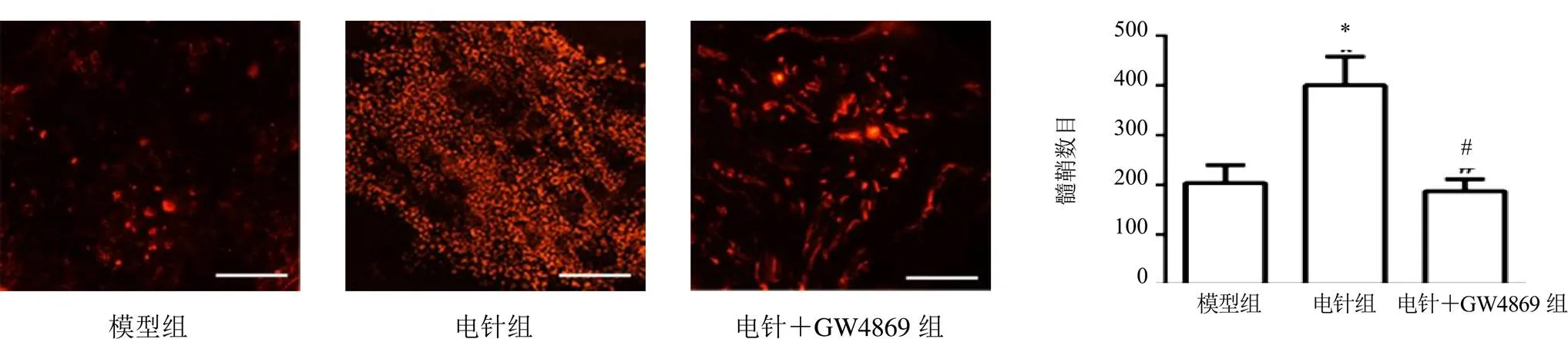
注:与模型组比较,*P<0.05;与电针组比较,#P<0.05
5 讨论
PNI后的修复过程复杂,其机制尚未完全阐明。由于显微外科手术进行缝合或桥接后仍存在功能缺失,故如何更好地促进PNI后功能恢复成为研究的重点。电针将针灸与神经电刺激相结合,可发挥更好的疗效。电针兼具电刺激和经穴效应两者的特点,较单纯针灸更能促进PNI后功能恢复[15-16]。大量研究表明,电针能促进轴突生长和突触重建,减轻损伤区炎症反应,抑制神经细胞凋亡,促进神经再生,改善神经再生微环境[17]。本实验结果表明,电针可促进SNI的修复与神经再生,更好地促进损伤神经早期功能恢复,明显改善肌肉萎缩程度。电针对损伤后神经轴突再生、轴浆转运、施万细胞增殖及神经营养因子的分泌均有明显促进作用[3-5,18-19]。因此,深入探讨电针修复SNI的作用及其机制具有十分重要的临床意义。
外泌体是一种杯盘型磷脂双层囊泡,直径40~150 nm,广泛存在于血清、血浆、尿液和脑脊液等体液中。其包含大量RNA与蛋白,并具有膜渗透性,耐受性良好,甚至还可穿过血脑屏障,介导细胞与细胞/组织间的信息交互,在疾病检测和治疗中都具有极大潜力[20]。外泌体在PNI修复过程中发挥重要的调控作用[9],外泌体中miR-9和miR-19、miR-219[21]等分别参与调节神经元的成熟和分化、髓鞘的形成与再生,外泌体miR-21则可介导感觉神经元和巨噬细胞的通讯并调节痛阈[22]。因此,在神经损伤疾病中具有很高研究价值[10,23]。但外泌体内的遗传物质、作用机制及转运机制等问题尚未明确,还有待深入研究。
GW4869为非竞争性的鞘磷脂酶抑制剂,具有抑制细胞分泌外泌体的作用[24-25],相关动物实验已有大量文献报道,如腹膜内注射GW4869用以抑制循环中的外泌体[26],而使用GW4869有效的同时未发现任何不良影响[27],体质量和血清乳酸脱氢酶水平也与对照组无明显差异[28],表明GW4869本身可能具有的直接药物较为微弱。本实验通过观察抑制血清外泌体水平对电针治疗大鼠SNI的影响,探讨电针是否通过调节外泌体释放促进大鼠SNI后功能恢复。通过构建大鼠SNI模型,本研究分为模型组、电针组和电针+GW4869组,处理3周后对多个神经再生功能指标进行检测,包括一般情况、足迹分析、神经传导速度比、腓肠肌湿重比,并通过免疫荧光染色NF200和MBP观察损伤神经横截面轴突和髓鞘,从而反映神经再生修复情况。结果表明,与模型组比较,电针组可促进神经功能恢复和结构再生;与电针组比较,电针+GW4869组抑制大鼠血清外泌体释放,神经功能恢复和结构再生均受到抑制,结合文献报道穴位注射GW4869阻断穴位局部外泌体后电针的镇痛效应降低[29],说明电针可通过调节外泌体释放促进大鼠SNI后功能恢复和结构再生,提示外泌体是研究电针作用机制的一个新的切入点。鉴于外泌体主要作为载体介导其内容物如RNA和蛋白发挥作用,因此,外泌体内容物将是我们今后进一步研究的方向。总之,本研究证实电针通过调节外泌体释放促进大鼠SNI后功能恢复,为深入研究电针通过外泌体内容物促进SNI后功能恢复的更深层次作用机制提供依据。
[1] PASKAL A M, PASKAL W, PIETRUSKI P, et al. Polyethylene glycol: the future of posttraumatic nerve repair? systemic review[J]. International Journal of Molecular Sciences,2019,20(6):1478.
[2] ZHANG C, MA Z, HUO B, et al. Diffusional plasticity induced by electroacupuncture intervention in rat model of peripheral nerve injury[J]. Journal of Clinical Neuroscience,2019,69:250-256.
[3] HU L N, TIAN J X, GAO W, et al. Electroacupuncture and moxibustion promote regeneration of injured sciatic nerve through Schwann cell proliferation and nerve growth factor secretion[J]. Neural Regeneration Research,2018,13(3):477-483.
[4] 叶晓春,邵水金,国海东,等.电针对坐骨神经损伤大鼠脑源性神经营养因子的影响[J].中国中医药信息杂志,2017,24(6):60-63.
[5] 邵水金,单宝枝,严振国.电针、中药促进大鼠坐骨神经损伤的神经再生研究[J].中国针灸,2003,23(7):417-420.
[6] MEHRYAB F, RABBANI S, SHAHHOSSEINI S, et al. Exosomes as a next-generation drug delivery system:An update on drug loading approaches, characterization, and clinical application challenges[J]. Acta Biomaterialia,2020,113:42-62.
[7] 金婷婷,柳维林,李钻芳,等.电针曲池、足三里对缺血再灌注大鼠缺血侧运动皮层小胶质细胞与外泌体蛋白的影响及机制[J].中国康复, 2019,34(8):395-398.
[8] 李牧洋,王婷婷,陈波,等.电针足三里-环跳穴对不同状态大鼠血清外泌体表达的影响[J].陕西中医,2019,40(2):139-142.
[9] LOPEZ VERRILLI M A, PICOU F, COURT F A. Schwann cell-derived exosomes enhance axonal regeneration in the peripheral nervous system[J]. Glia,2013,61(11):1795-1806.
[10] FRÖHLICH D, KUO W P, FRÜHBEIS C, et al. Multifaceted effects of oligodendroglial exosomes on neurons:impact on neuronal firing rate, signal transduction and gene regulation[J]. Philosophical Transactions of the Royal Society B:Biological Sciences,2014, 369(1652):20130510.
[11] 王韦江,王园园,范金鹏,等.神经生长因子包埋鞘内不同灌注时长对大鼠坐骨神经功能的影响[J].疑难病杂志,2018,17(5):498-502.
[12] ZHANG D, YAO Y, DUAN Y, et al. Surface-anchored graphene oxide nanosheets on cell-scale micropatterned poly (d,l-lactide-co- caprolactone) conduits promote peripheral nerve regeneration[J]. ACS Applied Materials & Interfaces,2020,12(7):7915-7930.
[13] WANG T, LI B, WANG Z, et al. miR-155-5p promotes dorsal root ganglion neuron axonal growth in an inhibitory microenvironment via the cAMP/PKA pathway[J]. International Journal of Biological Sciences,2019,15(7):1557-1570.
[14] BOISSONNAS A, LOUBOUTIN F, LAVIRON M, et al. Imaging resident and recruited macrophage contribution to Wallerian degeneration[J]. Journal of Experimental Medicine,2020,217(11):e20200471.
[15] 邵水金.周围神经损伤的针灸疗法[J].现代康复,2000,4(11):1616-1617.
[16] 章明星,刘阳阳,刘建卫,等.电针治疗周围神经损伤的临床研究进展[J].光明中医,2016,31(8):1196-1199.
[17] 马力颖,宫树丰.近20年针灸治疗周围神经损伤实验研究的文献计量学分析[J].针灸临床杂志,2012,28(4):48-50.
[18] 邵水金,单宝枝,严振国.电针对大鼠坐骨神经损伤后的修复作用[J].中国康复医学杂志,1997,12(4):42-43.
[19] 邵水金,单宝枝,姜俊,等.电针和补阳还五汤治疗大鼠坐骨神经损伤的比较研究[J].中西医结合学报,2003,1(1):54-56.
[20] HE C, ZHENG S, LUO Y, et al. Exosome theranostics:biology and translational medicine[J]. Theranostics,2018,8(1):237-255.
[21] PUSIC A D, KRAIG R P. Youth and environmental enrichment generate serum exosomes containing miR-219 that promote CNS myelination[J]. Glia,2014,62(2):284-299.
[22] SIMEOLI R, MONTAGUE K, JONES H R, et al. Exosomal cargo including microRNA regulates sensory neuron to macrophage communication after nerve trauma[J]. Nature Communications,2017, 8(1):1-17.
[23] LOPEZ-LEAL R. Schwann cell exosomes mediate neuron–glia communication and enhance axonal regeneration[J]. Cellular and Molecular Neurobiology,2016,36(3):429-436.
[24] ZHOU H, LI X, YIN Y, et al. The proangiogenic effects of extracellular vesicles secreted by dental pulp stem cells derived from periodontally compromised teeth[J]. Stem Cell Research & Therapy,2020,11(1):1-18.
[25] ZHU L, ZANG J, LIU B, et al. Oxidative stress-induced RAC autophagy can improve the HUVEC functions by releasing exosomes[J]. Journal of Cellular Physiology,2020,235(10):7392-7409.
[26] XU F, ZHONG J Y, LIN X, et al. Melatonin alleviates vascular calcification and ageing through exosomal miR-204/miR-211 cluster in a paracrine manner[J]. Journal of Pineal Research, 2020,68(3):e12631.
[27] TABATADZE N, SAVONENKO A, SONG H, et al. Inhibition of neutral sphingomyelinase-2 perturbs brain sphingolipid balance and spatial memory in mice[J]. Journal of Neuroscience Research,2010, 88(13):2940-2951.
[28] DINKINS M B, DASGUPTA S, WANG G, et al. Exosome reduction in vivo is associated with lower amyloid plaque load in the 5XFAD mouse model of Alzheimer's disease[J]. Neurobiology of Aging, 2014,35(8):1792-1800.
[29] 陈波,李牧洋,邢立莹,等.穴位局部外泌体参与针刺镇痛效应启动的研究(英文)[J]. World Journal of Acupuncture-Moxibustion,2018, 28(4):263-267.
Effect of Electroacupuncture on Functional Recovery of Rats after Sciatic Nerve Injury Based on Regulating the Release of Exosomes
LIU Yupu, YANG Yiduo, ZHAO Tiantian, LI Han, ZHAO Yue, GUO Haidong, SHAO Shuijin
To observe the effects of inhibiting the level of serum exosomes on the treatment of rat sciatic nerve injury by electroacupuncture; To explore whether electroacupuncture can promote the functional recovery of rats after sciatic nerve injury by regulating the release of exosomes.The sciatic nerve injury model rats were constructed, grouped for electroacupuncture treatment and drug intervention. Intraperitoneal injection of GW4869 was used to inhibit the release of exosomes. The general condition of the affected foot of the rats was observed; the footprint analysis was used to evaluate the sciatic nerve function index, the nerve conduction velocity ratio and the gastrocnemius wet weight ratio were used to evaluate the sciatic nerve function recovery; immunofluorescence staining of NF200 and MBP were used to label axons and myelin sheaths to evaluate nerve regeneration and repair.After inhibiting the level of serum exosomes, the efficacy of electroacupuncture on sciatic nerve injury in rats was affected. Compared with the model group, the electroacupuncture group had a significant effect on promoting functional recovery of rats after sciatic nerve injury. Compared with the electroacupuncture group, the electroacupuncture+ GW4869 group had serious plantar ulcers, and the sciatic nerve function index, sciatic nerve function recovery, and nerve regeneration and repair were poor.Electroacupuncture can promote the functional recovery of rats after sciatic nerve injury by regulating the release of exosomes.
sciatic nerve injury; electroacupuncture; exosomes; functional recovery; rats
R245
A
1005-5304(2021)02-0049-05
10.19879/j.cnki.1005-5304.202007415

国家自然科学基金(81873357)
邵水金,E-mail:shaoshuijin@163.com
(收稿日期:2020-07-21)
(修回日期:2020-07-31;编辑:华强)
