蒙药砂蓝刺头定性与定量质量控制方法研究
2021-03-16曹岚岚程雪梅杨立国王秀兰乌力吉王长虹
曹岚岚,程雪梅,杨立国,王秀兰,奥·乌力吉,王长虹
蒙药砂蓝刺头定性与定量质量控制方法研究
曹岚岚1,程雪梅1,杨立国2,王秀兰2,奥·乌力吉2,王长虹1*
1. 上海中医药大学中药研究所,中药标准化教育部重点实验室,上海市复方中药重点实验室,上海中药标准化研究中心,上海 201203 2. 内蒙古民族大学蒙医药学院,蒙药研发国家地方联合工程研究中心,内蒙古 通辽 028000
建立砂蓝刺头的质量控制方法。采用薄层色谱法,以三氯甲烷-醋酸乙酯-甲醇-甲酸(6∶1∶1∶0.8)为展开剂对砂蓝刺头花中1-甲基-4-甲氧基-8-(β--葡萄吡喃型糖苷)-2(1H)-喹啉酮(MMQ)进行定性鉴别;建立砂蓝刺头HPLC指纹图谱,并对MMQ的含量测定方法进行研究。建立的TLC方法对照品斑点清晰,分离度好;建立的指纹图谱分析方法能够区分砂蓝刺头与近源植物,标定了8个特征峰,并指认出其中4个成分。定量方法测定结果显示MMQ在2.024~151.800 μg/mL呈良好线性关系,平均加样回收率为101.54%,RSD为1.46%。7批样品中MMQ的质量分数为0.13%~0.53%。建立的质量控制方法科学、可靠,可为砂蓝刺头质量标准的建立提供实验依据。
砂蓝刺头花;质量控制;薄层色谱法;高效液相色谱法;1-甲基-4-甲氧基-8-(β--葡萄吡喃型糖苷)-2(1)-喹啉酮
菊科蓝刺头属L.植物在全世界有120余种[1],分布于南欧、北非和中亚。我国有19种,主要分布于我国东北、华北及西北地区[2-3]。蓝刺头属植物中含有有机酸类[4]、噻吩类[5]、黄酮类[6]和生物碱类[7]等化学成分。该属植物多数有药用价值,在我国中医药或者少数民族医药中均有所应用[1],具有抗肿瘤[8]、降血糖[9]、抗炎、抗氧化[10]等多种药理活性。
砂蓝刺头Turcz.为民间常用药材,在辽宁、吉林、内蒙古、宁夏、陕西、甘肃、青海、新疆等省区沙漠地区均有分布[11]。其药用部位包括干燥根、头状花序以及全草。根为常用中药,具有清热解毒、通乳、排脓的功效[12],多入汤剂[13]。在蒙医中,全草具有止血、安胎、舒筋通脉的功效[14];头状花序有固骨质、接骨愈伤、清热止痛之效,可治疗骨折、骨热、刺痛以及疮疡等疾病[13]。相关研究主要集中在砂蓝刺头植物的化学成分提取分离[15-17]以及生态资源[18-19]等方面。未见关于砂蓝刺头花的有效成分和质量评价的研究报道。本课题组前期从砂蓝刺头花(简称EGT)中分离得到了1-甲基-4-甲氧基-8-(β--葡萄吡喃型糖苷)-2(1)-喹啉酮(1-methyl-4-methoxy-8-(β-- glucopyranoside)-2(1)-quinolinone,以下简称MMQ)。以其为指标,建立EGT的薄层鉴别和含量测定方法,并结合指纹图谱进行多成分定性评价,从而达到对EGT的定性和定量控制的目的。
1 材料
1.1 仪器
Linomat-Ⅵ型薄层色谱自动点样器(瑞士CAMAG公司)、Reprostar 3型薄层色谱摄像仪(瑞士CAMAG公司)、Mettler AE200型电子分析天平、KQ-250DB数控超声波清洗器(昆山市超声仪器有限公司)、Waters e2695 HPLC色谱仪、SX2-4-10型系列箱式电阻炉(上海阳光实验仪器)。
1.2 试药
EGT样品S1(批号20180823)、S2(批号20180830)、S6(批号20180901)、S7(20180905),均采集于内蒙古通辽;S3(批号20180811)采集于内蒙锡林郭勒;S4(批号20180811)采集于内蒙锡林浩特;S5(批号20180905)采集于内蒙科左中旗;S8(批号20120814)和S9(批号20120815),采集于甘肃张掖;大蓝刺头花样品S10(批号20110730),采集于新疆阿勒泰;硬叶蓝刺头花样品S11(批号20120801),采集于新疆阿勒泰,S12(批号20110725)和S13(批号20120728)采集于新疆乌鲁木齐;全缘蓝刺头花样品S14(批号20120801)和S15(批号20110731)采集于新疆阿勒泰;蓝刺头花样品S16(批号20101110)采集于内蒙古。以上药材经上海中药标准化研究中心吴立宏研究员分别鉴定为砂蓝刺头Turcz.、大蓝刺头Golosk.、硬叶蓝刺头L.、全缘蓝刺头Kir.和蓝刺头Tausch.的干燥头状花序。MMQ对照品由实验室自制,HPLC面积归一化法,质量分数大于98%。乙腈(色谱纯,美国Fisher公司),水为超纯水,其余试剂均为分析纯。
2 方法与结果
2.1 MMQ的分离与制备
取EGT药材1.2 kg,95%乙醇回流提取3次、60%乙醇回流提取1次,提取1~2 h,回收乙醇。将浓缩液依次用石油醚、二氯甲烷、醋酸乙酯、正丁醇萃取,合并并回收各有机溶剂。取正丁醇部位过MCI小孔树脂,依次用不同浓度甲醇水体系洗脱,取30%甲醇段减压浓缩后得浸膏5 g,通过硅胶和MCI等手段,分离得到目标化合物。经1H-NMR、13C-NMR鉴定,确定该成分为生物碱类化合物MMQ,经HPLC面积归一法测定其质量分数大于98%。
2.2 薄层色谱鉴别
2.2.1 供试品溶液的制备 取EGT粉末(过3号筛)0.25 g,加70%甲醇25 mL,超声处理30 min,滤过,滤液蒸干,残渣加70%甲醇2 mL使溶解,作为供试品溶液。
2.2.2 对照品溶液的制备 取MMQ适量,加甲醇制成质量浓度为1 mg/mL的溶液,作为对照品溶液。
2.2.3 薄层色谱分别吸取供试品溶液和对照品溶液各5 μL,分别点于同一硅胶HSGF254薄层板上,以三氯甲烷-醋酸乙酯-甲醇-甲酸(6∶1∶1∶0.8)为展开剂,展开,取出,晾干,置紫外光灯(254 nm)下检视。供试品在与对照品相应的位置上,显相同颜色的斑点。采用上述色谱方法对7批不同产地的EGT药材(S1~S7)进行薄层色谱鉴别(S8、S9因采集时间较久,未采用),结果样品中MMQ分离度较良好,斑点清晰,比移值(f)合适,并且7批药材具有良好的一致性,见图1。
2.3 指纹图谱的建立
2.3.1 供试品溶液的制备 取EGT样品(S5,过3号筛)0.25 g,精密称定,置100 mL具塞锥形瓶中,精密加入70%甲醇25 mL,称定质量,超声(功率250 W,频率40 kHz)处理30 min,放冷,用70%甲醇补充减失质量,摇匀,滤过,取续滤液作为供试品溶液。

S-MMQ S1~7-EGT样品
2.3.2 色谱条件 以Diamonsil Plus C18(250 mm×4.6 mm,5 μm)为色谱柱;乙腈(A)-0.1%甲酸(B)为流动相梯度洗脱(0~7 min,5% A;7~35 min,5%~28% A;35~53 min,28%~90% A;53~65 min,90% A);体积流量1.0 mL/min;柱温30 ℃;检测波长为275 nm;进样量为10 μL。
2.3.3 精密度试验 称取样品粉末0.25 g(S5),按“2.3.1”项下方法制备供试品溶液,按“2.3.2”项下色谱条件连续进样6次,以MMQ(S)峰为参照峰,计算色谱图中特征峰相对保留时间和相对峰面积,结果显示RSD分别为0.05%~0.49%和0.39%~2.15%。
2.3.4 稳定性试验 取同批次砂蓝刺头粉末(S5)1份,按“2.3.1”项下方法制备供试品溶液,按“2.3.2”项下色谱条件分别于0、1、2、4、6、12、24 h进样,以MMQ峰为参照峰,记录和计算各共有峰相对保留时间、相对峰面积。结果显示RSD分别为0.06%~0.54%和0.33%~1.89%。
2.3.5 重复性试验 取同一批次砂蓝刺头粉末(S5)6份,按“2.3.1”项下方法制备供试品溶液,按“2.3.2”项下色谱条件进样,以MMQ为参照峰,记录和计算各共有峰保留时间、相对峰面积,计算其RSD分别为0.07%~1.11%和0.32%~3.19%。
2.3.6 指纹图谱的建立与分析 按“2.3.1”项和“2.3.2”项对样品进行制备和测定,记录色谱图。运用“中药色谱指纹图谱相似度评价系统研究版(2004版)”,导入S1~S9号样品HPLC数据,以S1为参照图谱,选择平均数法进行自动峰匹配,生成EGT对照指纹图谱(图2-A)。以EGT对照指纹图谱为参照图谱,同时导入7批(S10~S16)蓝刺头属其他种样品HPLC图谱数据,选择平均数法进行自动峰匹配,得到蓝刺头属其他种图谱(图2-B)并计算相似度。计算得到S1~S9号样品相似度分别为0.970、0.950、0.922、0.989、0.959、0.978、0.980、0.916、0.697,伪品相似度分别为0.849、0.452、0.806、0.327、0.499、0.580、0.832。除批号为20120815样品外,其余EGT样品相似度均在0.9以上,种内相似度较高,而蓝刺头属其他种植物样品相似度均低于0.9。将S1~S9号样品与蓝刺头属其他种样品的指纹图谱进行比较,并结合各色谱峰的峰形、峰高以及分离情况等信息,标定了8个特征峰,并经对照品指认4个峰,分别为2号峰是水杨酸、4号峰是绿原酸、5号峰是MMQ、6号峰是异绿原酸,其中MMQ是本研究发现的含量较高的专属性成分,其色谱峰的对称性好、峰较高,与相邻色谱峰达到基线分离,故选定MMQ为参照峰(S)。并计算得到各特征峰相对保留时间的RSD均小于3%,表明特征峰的出峰时间较为稳定,但其相对峰面积的RSD相差较大,表明不同批次中各成分含量存在一定的差异。将16批样品指纹数据进行初步数据筛选,筛选出峰面积比>2%的指纹数据,结果导入SIMCA 13.0软件,进行最小二乘法判别分析(orthogonal projections to latent structures discriminant analysis,OPLS-DA)与聚类分析(hierarchical cluster analysis,HCA),结果见图3和图4。从OPLS-DA和HCA结果显示,EGT与蓝刺头属其他种样品分成2大类,说明所建立的EGT特征指纹图谱有一定的鉴别作用,可用于EGT的质量评价。VIP结果显示13号峰(MMQ)为最主要的贡献成分,该成分为EGT的专属性成分,可作为EGT含量测定的指标成分。
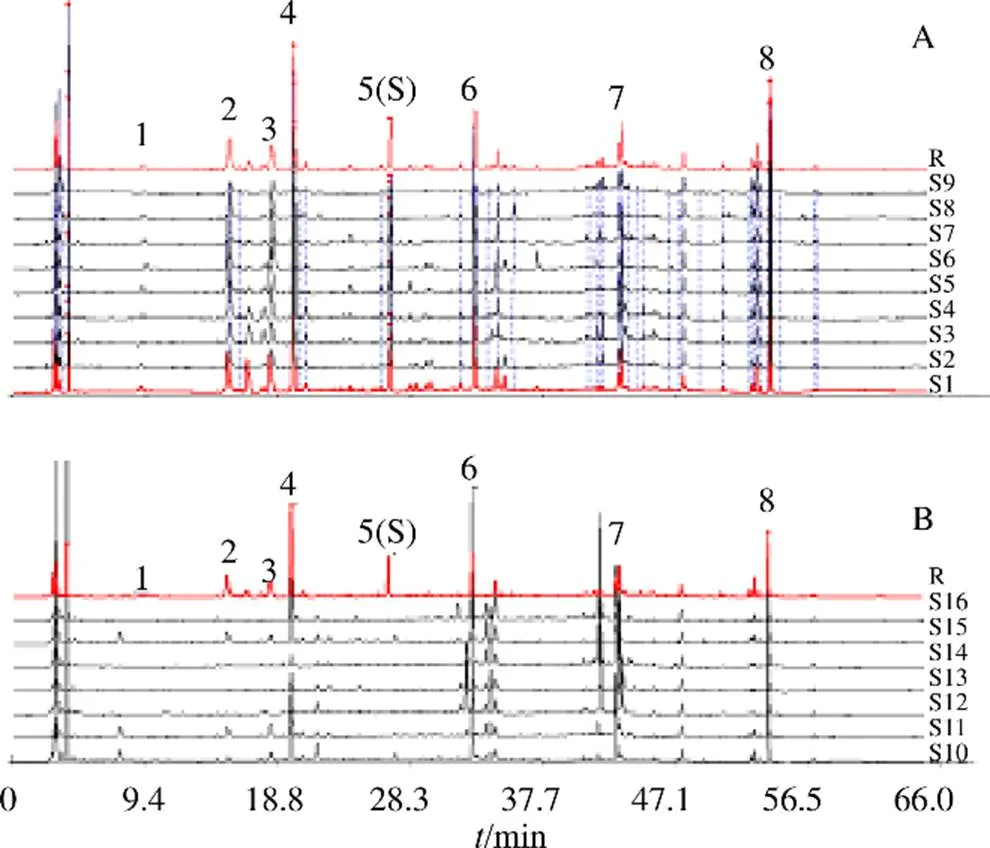
2-水杨酸 4-绿原酸 5-MMQ 6-异绿原酸

图3 蓝刺头属OPLS-DA图(A) 及VIP (VIP>1.0,B) 图
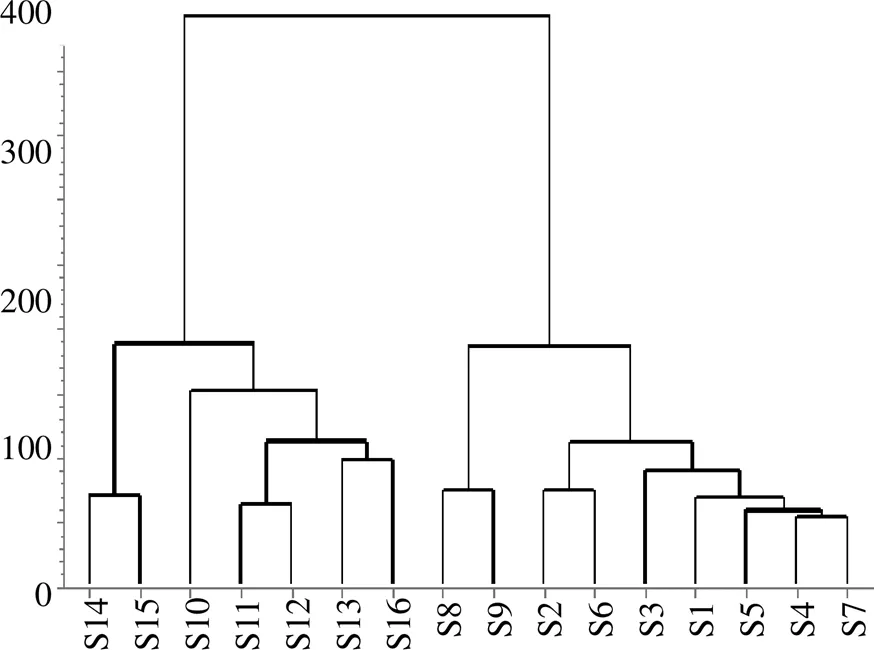
图4 蓝刺头属聚类分析
2.4 MMQ的定量测定
2.4.1 色谱条件 采用Diamonsil Plus C18(250 mm×4.6 mm,5 μm)色谱柱;乙腈-0.1%甲酸水溶液(14∶86)为流动相,体积流量为1.0 mL/min,柱温30 ℃,检测波长为230 nm,进样量为10 μL。理论板数按MMQ峰计不低于2500。对照品溶液和供试品溶液的HPLC见图5。
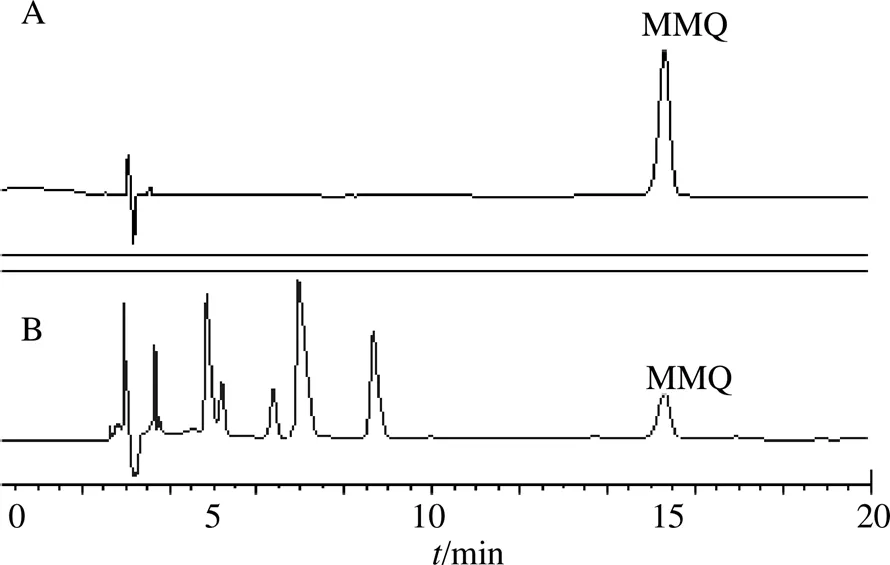
图5 MMQ对照品(A) 和砂蓝刺头花药材(B) HPLC图
2.4.2 供试品溶液的制备 取EGT样品(过3号筛)0.25 g,精密称定,置100 mL具塞锥形瓶中,精密加入70%甲醇25 mL,称定质量,超声(功率250 W、频率40 kHz)处理30 min,放冷,用70%甲醇补充减失质量,摇匀,滤过,取续滤液作为供试品溶液。
2.4.3 对照品溶液的制备 精密称取MMQ对照品10.12 mg,置于10 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,制成含1.012 mg/mL MMQ的溶液,作为对照品贮备溶液。
2.4.4 线性关系考察 用70%甲醇对贮备液进行逐级稀释,得到2.024、20.240、50.600、101.200、151.800 μg/mL的系列对照品溶液,分别精密吸取溶液各10 μL,注入色谱仪进行测定,以对照品的进样质量浓度为横坐标(),峰面积为纵坐标(),进行线性回归,得标准曲线方程为=35.919-4.386 4,=1.000 0,结果表明,MMQ在2.024~151.800 μg/mL线性关系良好。
2.4.5 定量限和检测限 取对照品贮备溶液,逐步稀释,按“2.4.1”项下色谱条件进样,进样量为10 μL,信噪比()为10∶1,测得MMQ的定量限约为2.024 μg/mL。信噪比()为3∶1时,MMQ的检测限约为0.607 μg/mL。
2.4.6 精密度试验 选取高、中、低(101.200、50.600、20.240 μg/mL)3个质量浓度的对照品溶液,按“2.4.1”项下色谱条件下同1 d内连续进样6次,测得MMQ峰面积的RSD分别为0.73%、0.95%、1.37%。连续测定3 d,每天进样1次,记录MMQ峰面积,测得MMQ峰面积的RSD分别为2.06%、1.61%、1.88%。结果显示日内、日间精密度均小于3%。表明日内、日间精密度良好,仪器稳定。
2.4.7 重复性试验 取样品粉末0.25 g(S5),按“2.4.2”项下方法制备供试品溶液,平行6份,按“2.4.1”项下色谱条件进样,进样量为10 μL,记录MMQ的峰面积。采用外标一点法计算MMQ的含量,样品中MMQ的质量分数为5.28 mg/g,RSD为1.37%,表明此方法重复性好。
2.4.8 稳定性试验 取样品粉末0.25 g(S5),按“2.4.2”项下方法制备供试品溶液,按“2.4.1”项下色谱条件分别于0、1、2、4、8、12、24 h进样,进样量为10 μL,结果显示MMQ峰面积的RSD为1.81%,表明供试品溶液在24 h内稳定。
2.4.9 加样回收率试验 精密称取已知含量的EGT粉末0.125 g(S5)精密称定,按已测定的50%、100%、150%精密加入对照品溶液,按“2.4.2”项下方法制备供试品溶液,按“2.4.1”项下色谱条件进样,记录峰面积,采用外标一点法计算加样回收率。结果MMQ的平均加样回收率为101.5%,RSD为1.46%。
2.4.10 定量测定 取7批EGT样品,按“2.4.2”项下方法制备供试品溶液,按“2.4.1”项下色谱条件进样,经HPLC测定后,结果显示7批EGT(S8、S9因采集时间较久,未测定)的质量分数范围在0.13%~0.53%,见表1。
3 讨论
3.1 指标成分的选择
EGT为蒙古族习用药材,目前无相关的质控标准以及专属性成分的研究,本研究通过MCI色谱、硅胶色谱、高效液相色谱等分离手段,得到专属性成分,经核磁鉴定为一种喹啉酮类生物碱(MMQ)。本实验将EGT与其它4种近源样品:大蓝刺头、硬叶蓝刺头、全缘蓝刺头和蓝刺头,进行薄层色谱和HPLC检测比较,结果显示大蓝刺头、硬叶蓝刺头、全缘蓝刺头不含有MMQ,在蓝刺头样品中虽含有少量MMQ,但远低于其检测线。因此MMQ作为砂蓝刺头中含量较高且专属性较强的成分,建立以其为指标成分定性定量方法,有一定的科学性与实用性,可以更好地评价EGT药材的质量。
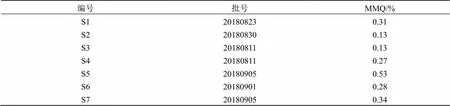
表1 7批EGT药材中MMQ含量测定结果(n=3)
3.2 薄层色谱鉴别
在薄层鉴别展开剂的考察中,发现酸对于薄层展开体系的影响较大,非酸体系下,斑点较少、分离度较差。筛选了多种显色剂,包括磷钼酸、碘化铋钾、碘、10%硫酸乙醇等,显色效果均不佳,不显色或者显色不灵敏,最终定为以三氯甲烷-醋酸乙酯-甲醇-甲酸(6∶1∶1∶0.8)为展开剂,254 nm紫外灯下检视荧光斑点即可。比较了不同厂家的薄层板:银龙-HSGF254板、黄海-HSGF254板、德国MNSGF板和德国MNHSGF板,所建立的薄层方法在上述几种板中均能获得很好的展开效果,其中以德国MNHSGF板分离效果最好。
3.3 指纹图谱建立
中药色谱指纹图谱能够较为全面地反映中药的整体质量。本实验建立指纹图谱分析方法能很好地将EGT与同属其他植物相区别。相似度分析评价中,S9(批号20120815)相似度仅为0.679,其他EGT样品相似度均高于0.9,这提示EGT样品陈置过久可能会影响其药材质量。这一发现为药材市场中EGT药材年限控制提供数据参考。不同来源的9批样品指纹图谱中的共有峰在数目以及相对保留时间上保持一致,但各共有峰相对峰面积有一定的差异,说明各批次药材之间的质量存在差异,推测可能与药材产地、生长年限、采收期等因素有关。将EGT和其他种蓝刺头的指纹数据进行统计分析,主成分分析和聚类分析结果一致,均能实现EGT与同属其他植物(蓝刺头、全缘叶蓝刺、硬叶蓝刺头和大蓝刺头)的区别。在PCA中,16批样品聚为2大类,S1~S9号样品为不同批次EGT,S10~16号样品为蓝刺头属其他种样品,其中S8和S9号样品为2012年收集的样品,虽经放置多年,成分有所下降,但仍归为EGT中。在聚类分析中,S8和S9号样品处于同一组中;S14和S15号样品为全缘蓝刺头也在同一组中,该结果与OPLS-DA结果一致。
3.4 含量测定
在建立MMQ的定量分析方法实验中,进行了提取方法(超声、加热回流)、提取溶剂(纯甲醇、70%甲醇、50%甲醇)、提取时间和提取次数的考察。最终确定的提取方便操作简单、省时,对砂蓝刺头中MMQ提取率高。考察了乙腈-水、乙腈-醋酸铵缓冲盐水溶液、甲醇-0.1%甲酸水溶液、乙腈-0.1%甲酸水溶液等流动相体系对液相色谱分离效果的影响。最终确定的含测方法重复性好,MMQ的分离度和含量测定RSD均符合检测要求。另外,由于S8和S9药材采集时间过久,为了不影响含量限度制定的准确性,未对这2批药材进行含量测定。
利益冲突 所有作者均声明不存在利益冲突
[1] 帕尔哈提·柔孜, 波拉提·马卡比力, 吾古力汗·努尔哈别克, 等. 蓝刺头属植物在我国传统医药中的应用与研究概况 [J]. 中国中药杂志, 2014, 39(19): 3865-3869.
[2] 帕尔哈提·柔孜, 哈勒木别克·木哈买提江, 波拉提·马卡比力, 等. 我国蓝刺头属植物分布介绍 [J]. 中国民族医药杂志, 2015, 21(4): 35-37.
[3] 安争夕, 魏岩, 地立夏提, 等. 新疆植物志 (第5卷) [M]. 乌鲁木齐: 新疆科技卫生出版社, 1999: 237-248.
[4] 木尼热·艾兰汗, 裴迪, 波拉提·马卡比力, 等. 全缘叶蓝刺头根部化学成分提取及抗氧化活性研究 [J]. 信阳师范学院学报: 自然科学版, 2019, 32(2): 214-220.
[5] 李媛, 波拉提·马卡比力, 丁刚, 等. 蓝刺头根化学成分研究 [J]. 中国药学杂志, 2014, 49(2): 99-101.
[6] 薛培凤, 波拉提·马卡比力, 杨雷, 等. 蒙药蓝刺头的化学成分研究 [J]. 中草药, 2017, 48(19): 3921-3926.
[7] Su Y F, Luo Y, Guo C Y,. Two new quinoline glycoalkaloids from[J]., 2004, 6(3): 223-227.
[8] 王岩, 杨茜雯, 杨英. 蓝刺头多糖B对INS-1细胞氧化损伤的保护作用 [J]. 畜牧与饲料科学, 2017, 38(10): 11-14.
[9] 姜梦如, 刘丹丹, 朱浩, 等. 蓝刺头及蓝刺头复方水提物对实验性II型糖尿病大鼠血糖及血脂的影响 [J]. 中国兽医学报, 2017, 37(5): 923-929.
[10] 杨斌, 萨茹丽, 张月梅, 等. 蓝刺头多糖体外抗氧化及抗菌活性的研究 [J]. 华北农学报, 2016, 31(4): 233-238.
[11] 王艳莉, 李新荣, 赵杰才, 等. 不同环境因素对砂蓝刺头种子萌发及出苗的影响 [J]. 兰州大学学报: 自然科学版, 2018, 54(6): 783-789.
[12] 赵汝能, 张承忠, 曹宗钧, 等.甘肃中草药资源志(下册) [M]. 兰州: 甘肃科学技术出版社, 2007: 107.
[13] 《中国大兴安岭蒙中药植物资源志》编撰委员会. 中国大兴安岭蒙中药植物资源志 [M]. 赤峰: 内蒙古科学技术出版社, 2011: 437.
[14] 国家中医药管理局. 中华本草 (第7卷) [M]. 上海: 上海科学技术出版社, 1999: 817.
[15] 苏艳芳, 张贞霞, 时丽敏, 等. 砂蓝刺头地上部分化学成分研究 [J]. 西北药学杂志, 2003, 18(3): 106-108.
[16] 李华民, 何兰. 砂蓝刺头化学成分研究 [J]. 质谱学报, 2005, 26(1): 64.
[17] 李华民, 曹坳程, 文永奇, 等. 砂蓝刺头中的三萜类化合物研究 [J]. 中草药, 2002, 33(4): 306.
[18] Wang Y L, Li X R, Zhao J C,. Population dynamics ofTurcz. at different successional stages of biological soil crusts in a temperate desert in China [J].(Stuttg), 2019, 21(6): 1140-1149.
[19] Wang Y L, Li X R, Liu L C,. Dormancy and germination strategies of a desert winter annualTurcz. in a temperate desert of China [J]., 2019, 34(1): 74-84.
Study on qualitative and quantitative control method for
CAO Lan-lan1, CHENG Xue-mei1, YANG Li-guo2, WANG Xiu-lan2, AO Wu-liji2, WANG Chang-hong1
1. Institute of traditional Chinese Medicine, Shanghai University of traditional Chinese Medicine, key Laboratory of Chinese Medicine Standardization Ministry of Education, Shanghai compound Chinese Medicine key Laboratory, Shanghai Research Center for Standardization of traditional Chinese Medicine, Shanghai 201203, China 2. School of Mongol Medicine, Inner Mongolia University for Nationalities, National and Local Joint Engineering Research Center for Mongolian Medicine Research and Development, Tongliao 028000, China
To establish the quality control method for of.Thin layer chromatography (TLC) method was used for quanlitative analysis of the 1-methyl-4-methoxy-8-(β--glucopyranoside)-2 (1H)-quinolinone (MMQ) with a mixture of trichloromethane-ethyl acetate-methanol-formic acid (6∶1∶1∶0.8) as the developing solvent. The HPLC fingerprint of the capitulum ofand the determination of MMQ were conducted by HPLC.The spots on TLC plate were clear, well-separated and specific without any interference. The linear range of calibration curve was 2.024—151.800 μg/mL, and the average recovery was 101.5% with RSD of 1.46%, which can be used for the quality control of. The contents of MMQ in seven batches ofwere 0.13%—0.53%.The qualitative and quantitative determination method is scientific and reliable, which can provide an experimental basis for the establishment of the quality standard of.
Turcz.; quality control; TLC; HPLC; 1-methyl-4-methoxy-8-(β--glucopyranoside)-2(1)-quinolinone.
R286.6
A
0253 - 2670(2021)06 - 1759 - 06
10.7501/j.issn.0253-2670.2021.06.026
2020-08-06
蒙药研发国家地方联合工程研究中心开放基金项目(MDK2019043);内蒙古自治区食品药品监督管理局内蒙古蒙药材标准研究课题采购项目(JYCZ18-026);中央引导地方科技发展专项资金计划项目:蒙医药现代化关键技术研究及蒙药产业化
曹岚岚,硕士研究生,研究方向为中药新制剂与体内过程研究。Tel: (021)51322511 E-mail: c18516607305@126.com
王长虹,博士,研究员,研究方向为中药新制剂与体内过程研究。Tel: (021)51322511 E-mail: wchcxm@163.com
[责任编辑 时圣明]
