马齿苋酰胺E干预肾癌的作用机制研究
2021-03-16陈盛烨叶挺宇
陈盛烨,黄 航,叶挺宇,潘 悦
马齿苋酰胺E干预肾癌的作用机制研究
陈盛烨,黄 航,叶挺宇,潘 悦
温州医科大学第一附属医院 泌尿外科,浙江 温州 325035
探讨马齿苋酰胺E对人肾癌786-O细胞增殖、迁移和侵袭的作用及机制。体外培养786-O细胞,给予马齿苋酰胺E(10、20、40 μmol/L)进行干预,采用CCK-8法检测细胞增殖情况;采用划痕实验检测细胞迁移能力;采用Transwell小室法检测细胞侵袭能力;采用AO/EB试剂盒检测细胞凋亡率。建立裸鼠移植瘤肾癌模型,给予马齿苋酰胺E(3、15 mg/kg)进行干预,测定各组裸鼠肿瘤质量及体积,采用苏木素-伊红(HE)染色法观察肿瘤组织病理变化;采用Western blotting法检测786-O细胞和荷瘤裸鼠瘤组织中细胞增殖标志物如Ki67、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)及凋亡标志物如活化半胱氨酸蛋白酶-3(Cleaved Caspase-3)、Cleaved Caspase-9及侵袭相关蛋白如基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)、MMP-9及希佩尔-林道抑癌基因(Von Hippel-Lindau,VHL)/缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)通路相关蛋白VHL、HIF-1α的表达情况。马齿苋酰胺E显著抑制786-O细胞活力(<0.05、0.01),下调Ki67、PCNA蛋白表达水平(<0.05、0.01);明显促进786-O细胞凋亡(<0.05、0.01),上调Cleaved Caspase-3、Cleaved Caspase-9蛋白表达水平(<0.05、0.01);有效改善786-O细胞迁移与侵袭能力(<0.05、0.01),显著降低MMP-2、MMP-9蛋白表达水平(<0.05、0.01);显著上调VHL蛋白表达水平(<0.05、0.01)并显著下调HIF-1α蛋白表达水平(<0.01)。马齿苋酰胺E可有效降低荷瘤裸鼠肿瘤质量与体积(<0.05、0.01),抑制肿瘤细胞增殖并促进其凋亡,显著下调Ki-67、PCNA、MMP-2、MMP-9、HIF-1α蛋白表达水平(<0.05、0.01),显著上调Cleaved Caspase-3、Cleaved Caspase-9、VHL蛋白表达水平(<0.05、0.01)。马齿苋酰胺E体外可有效抑制786-O细胞增殖、迁移与侵袭,促进786-O细胞凋亡,体内可有效降低荷瘤裸鼠肿瘤质量与体积,其作用机制可能与调控VHL/HIF通路及其下游蛋白表达有关。
肾癌;迁移;侵袭;马齿苋酰胺E;VHL/HIF-1α信号通路
肾癌是临床常见的泌尿生殖系统恶性肿瘤之一,其发病率在成年人恶性肿瘤中占2%,据统计,全球每年新增患者403 262例、死亡175 098例[1]。30%患者初次诊断时已为晚期,60%确诊患者由于转移性肾癌其5年生存率仅为10%[2]。吸烟、肥胖、高血压为肾癌的主要诱导因素[3]。目前临床通常采用手术切除或术后辅助治疗等方式治疗肾癌,但术后复发率仍高达20%~40%[4]。近年肾癌分子靶向治疗成为研究热门,然而靶向药物易产生耐药性且价格昂贵,中位缓解率仅为1.5~2.0年[5]。因此寻找疗效佳、不良反应小的治疗药物尤为重要。
传统中医药在改善肾癌患者的临床症状、生存质量等方面表现良好[6-7]。马齿苋是苋科植物马齿苋L.的干燥地上部分,又名“长寿菜”,其性寒味酸,具有清热解毒、凉血止血等功效,通常用于治疗热毒血痢、痈肿疔疮、湿疹等[8]。马齿苋的主要成分为生物碱类、萜类、香豆素类、黄酮类等化合物,具有抗炎、抗菌、抗肿瘤、降血糖、调血脂等多种药理活性[9-11]。马齿苋酰胺E是从马齿苋中提取、分离得到的四氢异喹啉并吡咯烷酮类生物碱[12],具有良好的抗氧化、抗炎及神经保护作用[13]。本研究通过体内外实验考察马齿苋酰胺E对肾癌的治疗作用及机制,为其临床应用提供依据。
1 材料
1.1 动物
SPF级雄性BALB/c裸鼠20只,5周龄,体质量18~22 g,购自北京维通利华实验动物技术有限公司,合格证号SCXK(京)2018-008。动物于无菌层流房中给予无菌水及灭菌颗粒饲料饲养。动物实验经温州医科大学实验动物伦理委员会和温州医科大学实验动物中心批准(2018025)。
1.2 细胞
人肾癌786-O细胞购自中国科学院上海细胞所。
1.3 药品与试剂
马齿苋酰胺E(质量分数≥98%,批号0464534-5)购自美国Aurora Fine Chemicals公司;舒尼替尼(批号170304)购自美国MCE公司;HRP标记的羊抗兔二抗(批号20180107)、蛋白抽提试剂盒(批号20181123)、ECL发光液(批号20181121)购自江苏碧云天生物技术公司;AO/EB试剂盒(批号20190107)购自北京索莱宝科技有限公司;Ki67抗体(批号GR256572-6)、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体(批号GR263410-2)、基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)抗体(批号GR276948-1)、MMP-9抗体(批号GR274709-18)、活化半胱氨酸蛋白酶-3(Cleaved Caspase-3)抗体(批号GR213318-5)、Caspase-3抗体(批号GR52861-1)、Cleaved Caspase-9抗体(批号GR219248-2)、Caspase-9抗体(批号GR525572-1)、希佩尔-林道抑癌基因(Von Hippel-Lindau,VHL)抗体(批号GR254523-1)、缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)抗体(批号GR187744-1)购自美国Abcam公司;苏木素-伊红(HE)染色试剂盒(批号S8946)购自上海碧云天生物技术有限公司;细胞培养板、Transwell小室购自美国Corning公司。
1.4 仪器
CKX31倒置显微镜(日本Olympus公司)、Ti-S倒置荧光显微镜(日本Nikon公司);Synergy HT酶标仪(美国Biotek公司);Mimi Protean垂直电泳仪、SEM1-DRY电转仪(美国Bio-Rad公司);SW-CJ-IF细胞超净工作台(苏州尚田生物技术公司)。
2 方法
2.1 细胞培养
786-O细胞用含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的RPMI 1640培养基,于37 ℃、5% CO2培养箱中培养。
2.2 马齿苋酰胺E对786-O细胞活力的影响
取处于对数生长期的786-O细胞,以2×104/mL接种于96孔板中,每孔100 μL,培养24 h。参照文献方法[14-15],设置对照组、马齿苋酰胺E(10、20、40 μmol/L)组及舒尼替尼(5 μmol/L)组,给药组分别加入相应药物,对照组加入不含药物的培养基,培养24 h,每孔加入10 μL CCK8溶液,孵育2 h,采用酶标仪测定450 nm处的吸光度()值。
2.3 马齿苋酰胺E对786-O细胞凋亡的影响
取处于对数生长期的786-O细胞,以1×105/mL接种于24孔板中,每孔500 μL,培养24 h,设置对照组、马齿苋酰胺E(10、20、40 μmol/L)组及舒尼替尼(5 μmol/L)组,给药组分别加入相应药物,对照组加入不含药物的培养基,培养24 h。弃去培养基,加入4%多聚甲醛固定15 min,PBS洗涤3次,按照AO/EB试剂盒说明书检测各组细胞凋亡情况。
2.4 马齿苋酰胺E对786-O细胞迁移的影响
取处于对数生长期的786-O细胞,以5×105/孔接种于6孔板中,待细胞融合度为80%~90%时,进行划痕。设置对照组、马齿苋酰胺E(10、20、40 μmol/L)组及舒尼替尼(5 μmol/L)组,用PBS洗涤3次,给药组分别加入相应药物,对照组加入不含药物的培养基,于培养箱中培养,分别于0、24 h在显微镜下观察并拍照。
2.5 马齿苋酰胺E对786-O细胞侵袭的影响
Transwell小室中加入60 μL Matrigel胶,于培养箱中孵育5 h。取处于对数生长期的786-O细胞,以5×105/mL接种于Transwell小室中,每孔100 μL。Transwell小室下室中加入1 mL培养基。设置对照组及马齿苋酰胺E(10、20、40 μmol/L)组及舒尼替尼(5 μmol/L)组,给药组分别加入相应药物,对照组加入不含药物的培养基,培养24 h。PBS洗涤,棉签擦拭Transwell小室内的细胞,4%多聚甲醛固定5 min,吉姆萨染色8 min,PBS洗涤,于显微镜下观察并拍照。
2.6 马齿苋酰胺E对786-O细胞Ki67、PCNA、MMP-2、MMP-9、Cleaved Caspase-3、Caspase-3、Cleaved Caspase-9、Caspase-9、VHL和HIF-1α蛋白表达的影响
取处于对数生长期的786-O细胞,以5×105/孔接种于6孔板中,培养24 h。设置对照组、马齿苋酰胺E(10、20、40 μmol/L)组及舒尼替尼(5 μmol/L)组,给药组分别加入相应药物,对照组加入不含药物的培养基,培养24 h,弃去培养基,收集细胞。
各组细胞加入RIPA裂解液,离心并提取蛋白,采用BCA蛋白定量试剂盒测定蛋白质量浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,5%牛血清白蛋白封闭,分别加入Ki67、PCNA、MMP-2、MMP-9、Cleaved Caspase-3、Caspase-3、Cleaved Caspase-9、Caspase-9、VHL、HIF-1α抗体(1∶1000),孵育过夜;TBST洗涤,加入HRP标记的羊抗兔二抗,于室温孵育1 h,TBST洗涤后,滴加ECL液进行显影成像,采用Image J软件对条带蛋白光密度进行分析。
2.7 荷瘤裸鼠肾癌模型的建立、分组与给药
按照文献方法[16-18],裸鼠于腹部sc 100 μL 786-O细胞(2×107/mL),当瘤体积达到25 mm3时,将裸鼠随机分为对照组和马齿苋酰胺E低、高剂量(3、15 mg/kg)组及舒尼替尼(7.5 mg/kg)组,每组5只。马齿苋酰胺E溶于0.5% CMC-Na溶液分别配制成质量浓度为0.3、1.5 mg/mL的溶液,各给药组ig 2 mL相应药物,对照组ig等体积CMC-Na溶液,1次/d,连续4周。给药结束后,裸鼠脱颈椎处死,取瘤组织,称定质量,用游标卡尺测量瘤组织的最长直径与最短直径,计算肿瘤体积。
2.8 马齿苋酰胺E对荷瘤裸鼠瘤组织病理变化的影响
取各组裸鼠瘤组织,除去胞膜,用4%多聚甲醛固定,石蜡包埋后切片(厚4 μm),HE染色后于显微镜下观察。
2.9 马齿苋酰胺E对荷瘤裸鼠瘤组织Ki67、PCNA、MMP-2、MMP-9、Cleaved Caspase-3、Caspase-3、Cleaved Caspase-9、Caspase-9、VHL和HIF-1α蛋白表达的影响
各组裸鼠瘤组织按“2.6”项下方法提取蛋白,并采用Western blotting法考察瘤组织Ki67、PCNA、MMP-2、MMP-9、Cleaved Caspase-3、Caspase-3、Cleaved Caspase-9、Caspase-9、VHL、HIF-1α蛋白表达情况。
2.10 统计学分析

3 结果
3.1 马齿苋酰胺E对786-O细胞增殖和凋亡的影响
如图1所示,与对照组比较,马齿苋酰胺E可显著抑制786-O细胞活力(<0.05、0.01),呈剂量相关性;如图2所示,马齿苋酰胺E可显著促进786-O细胞凋亡(<0.05、0.01),呈剂量相关性。
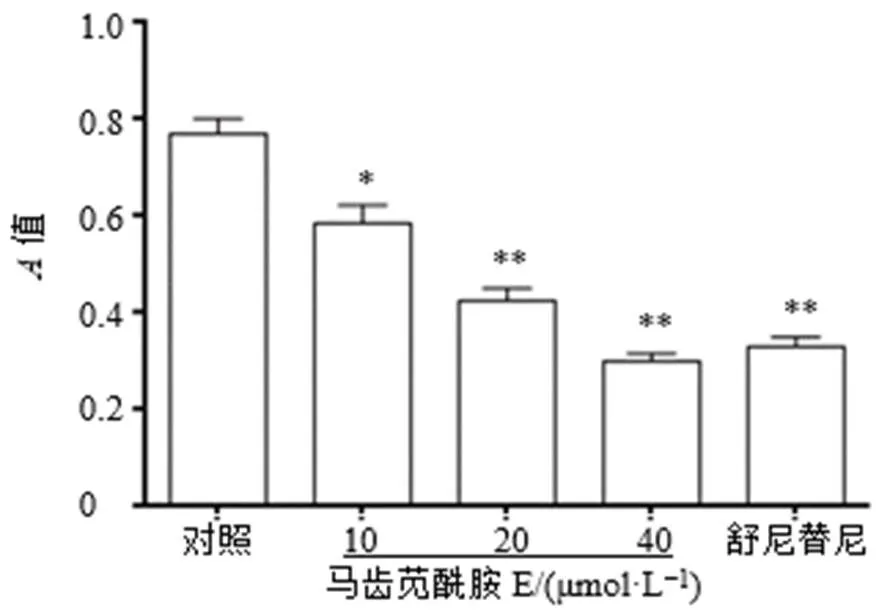
与对照组比较:*P<0.05 **P<0.01,下图同
3.2 马齿苋酰胺E对786-O细胞迁移与侵袭能力的影响
如图3所示,与对照组比较,马齿苋酰胺E显著抑制786-O细胞的迁移与侵袭(<0.05、0.01),且呈剂量相关性。
3.3 马齿苋酰胺E对786-O细胞增殖相关蛋白表达的影响
如图4所示,与对照组比较,马齿苋酰胺E(20、40 μmol/L)显著降低Ki67、PCNA蛋白表达水平(<0.05、0.01),马齿苋酰胺E(10 μmol/L)显著降低Ki67蛋白表达水平(<0.05)。
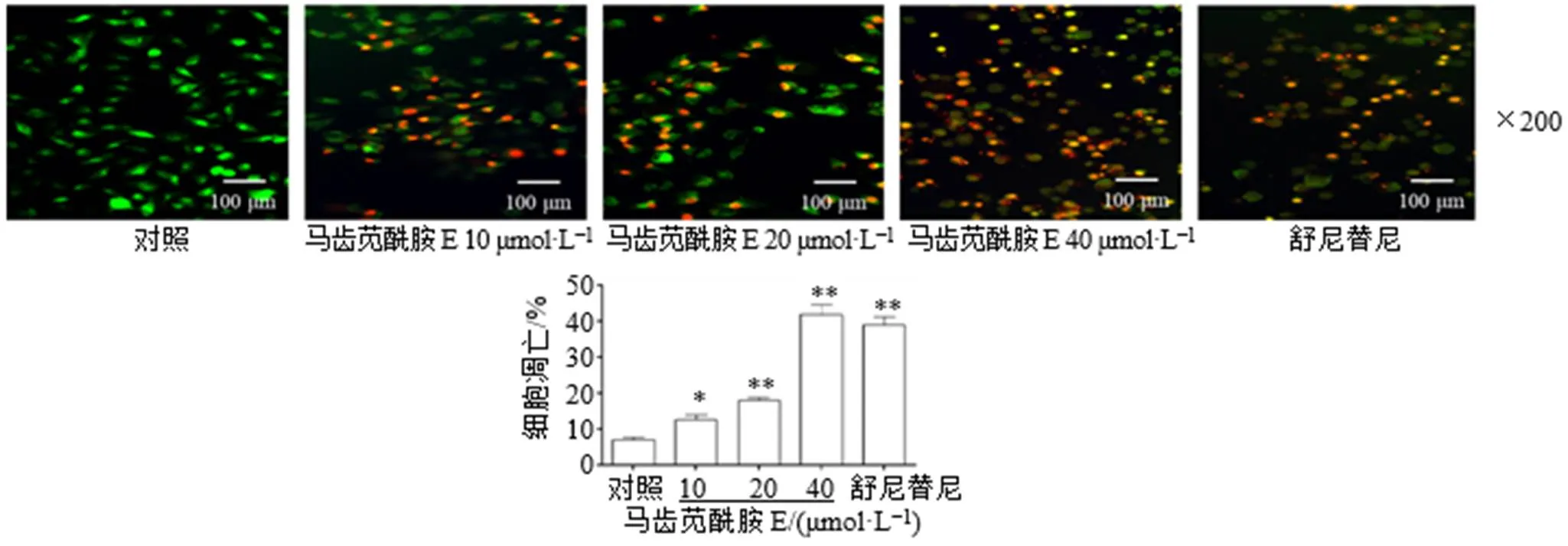
图2 马齿苋酰胺E对786-O细胞凋亡的影响()
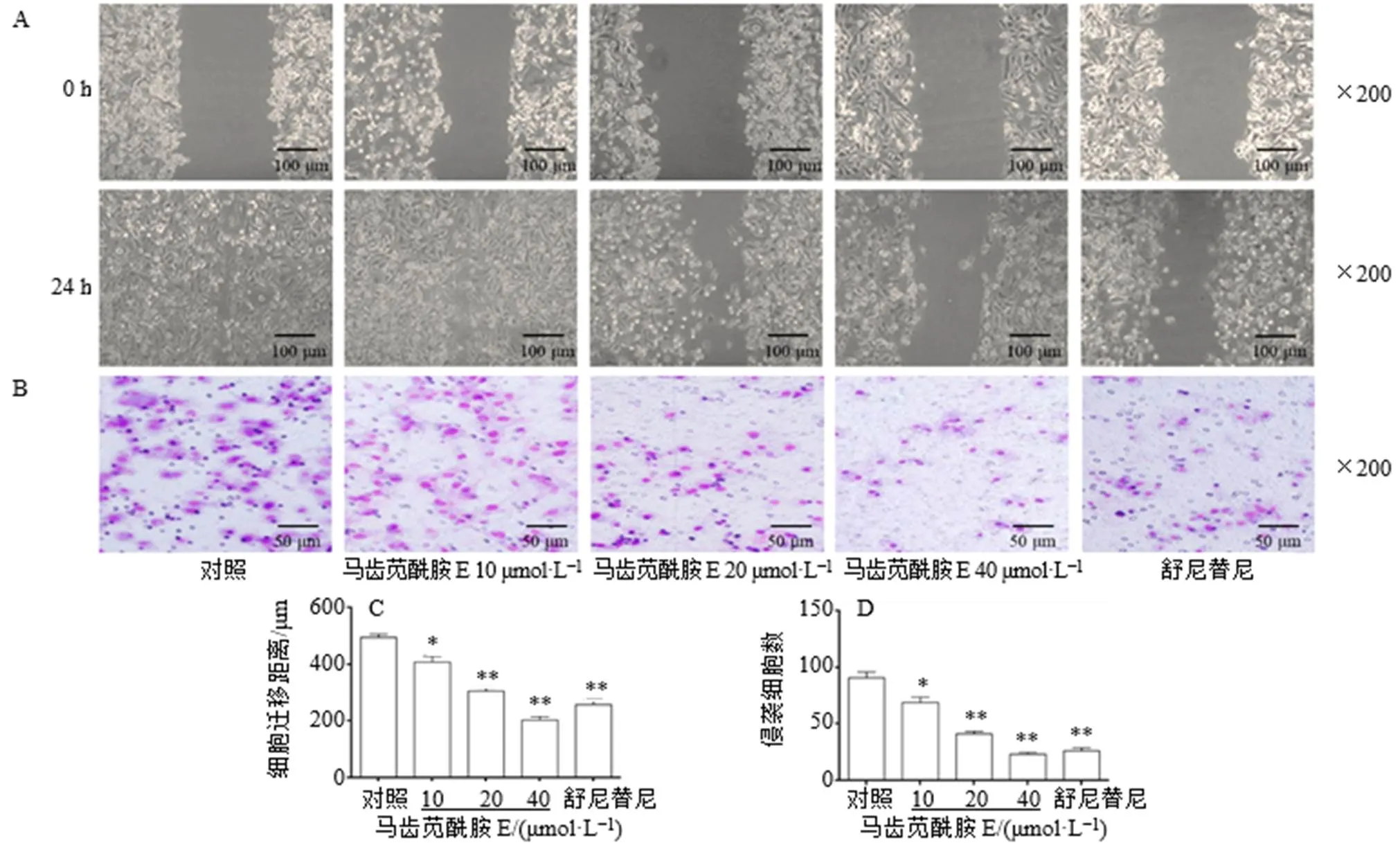
图3 马齿苋酰胺E对786-O细胞迁移(A、C) 与侵袭(B、D) 的影响()

图4 马齿苋酰胺E对786-O细胞Ki67及PCNA蛋白表达的影响()
3.4 马齿苋酰胺E对786-O细胞凋亡相关蛋白表达的影响
如图5所示,与对照组比较,马齿苋酰胺E(20、40 μmol/L)显著升高Cleaved Caspase-3、Cleaved Caspase-9蛋白表达水平(<0.05、0.01),马齿苋酰胺E(10 μmol/L)显著升高Cleaved Caspase-9蛋白表达水平(<0.05)。
3.5 马齿苋酰胺E对786-O细胞迁移及侵袭相关蛋白表达的影响
如图6所示,与对照组比较,马齿苋酰胺E显著降低MMP-2、MMP-9蛋白表达水平(<0.05、0.01),呈剂量相关性。
3.6 马齿苋酰胺E对786-O细胞VHL/HIF-1α相关蛋白表达的影响
如图7所示,与对照组比较,马齿苋酰胺E显著升高VHL蛋白表达水平(<0.05、0.01),显著降低HIF-1α蛋白表达水平(<0.01),呈剂量相关性。

图5 马齿苋酰胺E对786-O细胞Caspase-3及Caspase-9蛋白表达的影响()

图6 马齿苋酰胺E对786-O细胞MMP-2及MMP-9蛋白表达的影响()

图7 马齿苋酰胺E对786-O细胞VHL及HIF-1α蛋白表达的影响()
3.7 马齿苋酰胺E对裸鼠肿瘤大小的影响
如图8所示,与对照组比较,马齿苋酰胺E可明显降低裸鼠的瘤质量与瘤体积(<0.05、0.01),呈剂量相关性。
3.8 马齿苋酰胺E对荷瘤裸鼠瘤组织病理变化的影响
如图9所示,对照组裸鼠肿瘤组织中瘤细胞形态不规则,细胞排列紊乱、大小不一,未见凋亡细胞;细胞核呈圆形,核内常染色质丰富,且核仁明显。各给药组裸鼠肿瘤组织中瘤细胞核内染色质凝聚,细胞坏死、凋亡明显,细胞器肿胀,部分瘤细胞仅留有裸核,偶见少量炎性细胞浸润。
3.9 马齿苋酰胺E对荷瘤裸鼠瘤组织增殖相关蛋白表达的影响
如图10所示,与对照组比较,马齿苋酰胺E显著降低Ki67、PCNA蛋白表达水平(<0.05、0.01),呈剂量相关性。
3.10 马齿苋酰胺E对荷瘤裸鼠瘤组织凋亡相关蛋白表达的影响
如图11所示,与对照组比较,马齿苋酰胺E显著升高Cleaved Caspase-3、Cleaved Caspase-9蛋白表达水平(<0.05、0.01),呈剂量相关性。
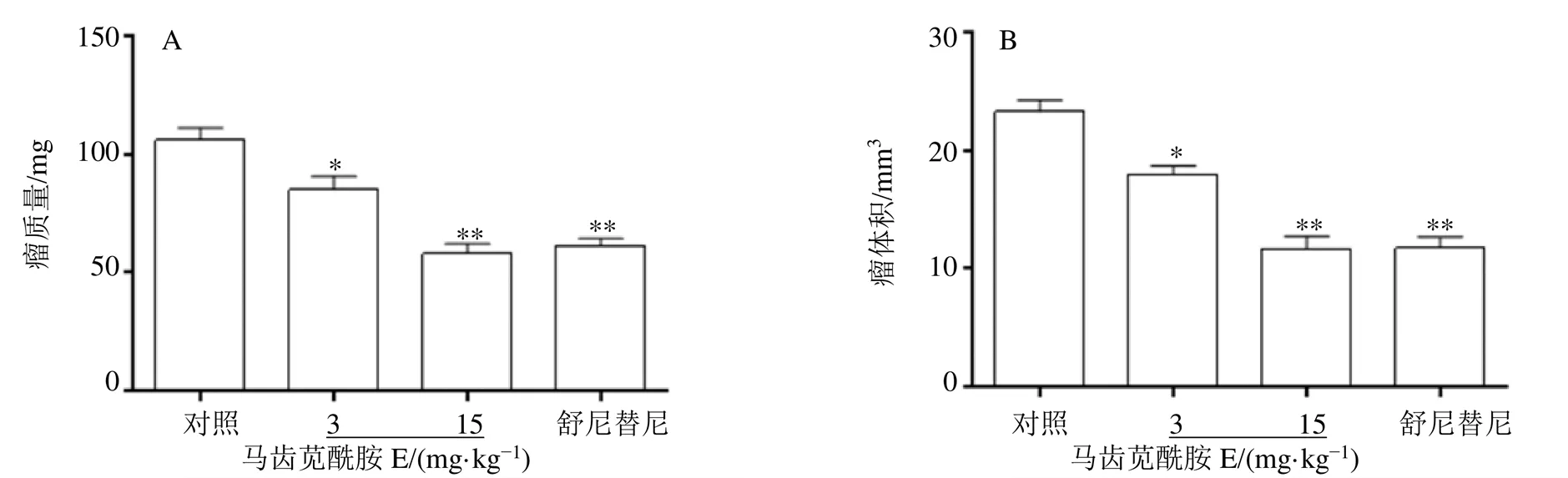
图8 马齿苋酰胺E对荷瘤裸鼠肿瘤质量(A) 与体积(B) 的影响()

图9 马齿苋酰胺E对荷瘤裸鼠瘤组织病理变化的影响(HE, ×200)
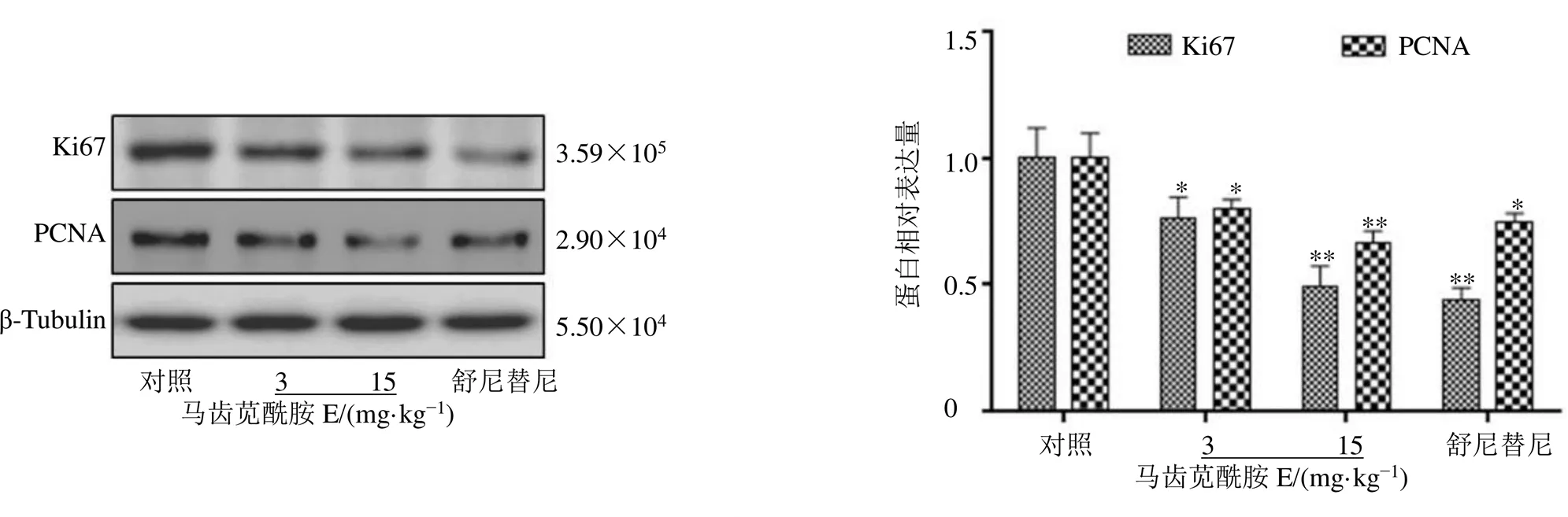
图10 马齿苋酰胺E对荷瘤裸鼠瘤组织Ki67及PCNA蛋白表达的影响()

图11 马齿苋酰胺E对荷瘤裸鼠瘤组织Caspase-3及Caspase-9蛋白表达的影响()
3.11 马齿苋酰胺E对荷瘤裸鼠瘤组织迁移及侵袭相关蛋白表达的影响
如图12所示,与对照组比较,马齿苋酰胺E(15 mg/kg)显著降低MMP-2、MMP-9蛋白表达水平(<0.01),马齿苋酰胺E(3 mg/kg)显著降低MMP-9蛋白表达水平(<0.05),且呈剂量相关性。
3.12 马齿苋酰胺E对荷瘤裸鼠瘤组织VHL/ HIF-1α相关蛋白表达的影响
如图13所示,与对照组比较,马齿苋酰胺E显著升高VHL蛋白表达水平(<0.05、0.01),显著降低HIF-1α蛋白表达水平(<0.01),且呈剂量相关性。
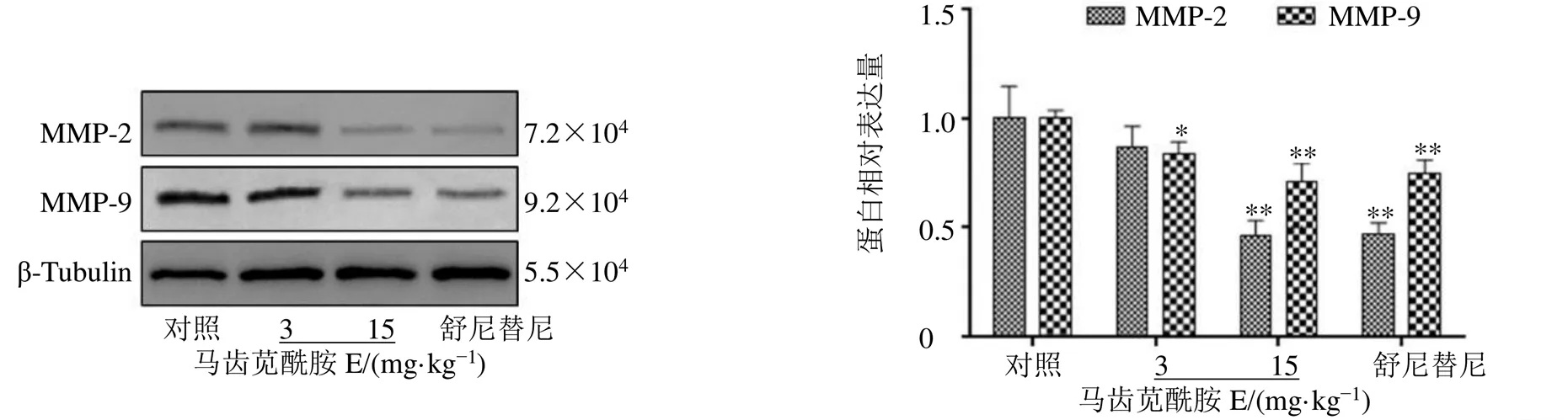
图12 马齿苋酰胺E对荷瘤裸鼠瘤组织MMP-2及MMP-9蛋白表达的影响()
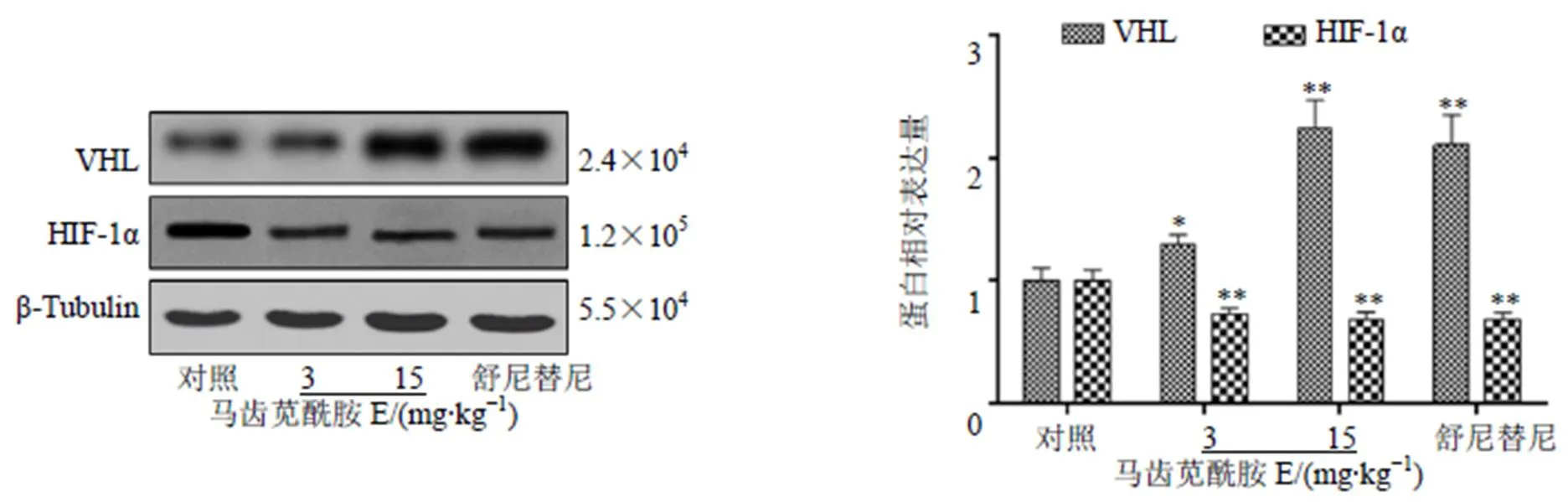
图13 马齿苋酰胺E对荷瘤裸鼠瘤组织VHL及HIF-1α蛋白表达的影响()
4 讨论
近年来,恶性肿瘤、糖尿病及脑血管疾病已成为危害人类生命的“三大杀手”,其中肾癌是临床常见的恶性肿瘤[19]。根据病理分型,肾癌可分为透明细胞癌、乳头状癌、嫌色细胞癌等[20]。由于肾癌属于化疗抵抗性癌症,手术治疗不能彻底清除癌细胞,因此肾癌易复发、预后较差[21]。传统中医认为肾癌具有腰痛、血尿、肿块等症状,与“尿血”“肾积”“腰痛”等病相关,临床通常治法主要包括健脾益肾、清热利湿、活血化瘀等[22-23]。随着传统中药的深入开发,中药的多靶点及整体调理功能在肿瘤治疗中备受关注[24]。马齿苋是我国历代本草医书中记载的中草药,其重要成分马齿苋酰胺E具有良好的药理活性[13],本研究通过体外培养肾癌786-O细胞及体内建立荷瘤裸鼠模型,深入探讨马齿苋酰胺E抗肾癌的活性及作用机制。
Ki67及PCNA作为生物标志物广泛应用于肿瘤的诊治[25]。Ki67、PCNA是评价细胞增殖状态的关键指标,Ki67、PCNA表达越高,癌细胞增殖指数越强[26]。本研究结果显示,马齿苋酰胺E可有效抑制786-O细胞增殖,下调Ki67、PCNA蛋白表达水平。诱导细胞凋亡是抗肿瘤药物研发的重要手段,细胞凋亡途径可分为线粒体途径和外源性死亡受体介导的信号传导途径,抗肿瘤药物能够通过上述细胞程序激活Cleaved Caspase-9,诱导Cleaved Caspase-3活化,从而促进肿瘤细胞凋亡[27-28]。本研究结果显示,马齿苋酰胺E可有效诱导786-O细胞凋亡,上调Caspase-3及Caspase-9的活化水平,表明马齿苋酰胺E通过下调Ki67、PCNA表达,促进Caspase-3、Caspase-9活化,从而调节786-O细胞增殖与凋亡的平衡。肿瘤的转移、侵袭与细胞外基质降解有关,作为降解细胞外基质的关键酶,当MMP分泌增加时可加剧肿瘤侵袭[29-30]。本研究结果显示,马齿苋酰胺E可有效下调786-O细胞中MMP-2、MMP-9蛋白表达,抑制细胞的迁移与侵袭,表明马齿苋酰胺E通过抑制MMP-2、MMP-9表达,从而抑制786-O细胞迁移与侵袭能力。VHL/HIF信号通路在肾癌的发生、发展过程中起着关键调控作用[31-32]。VHL作为重要的抑癌因子,其异常表达可导致HIF-1α处于稳定状态,降解减少。HIF-1α的累积可激活一系列缺氧反应基因转录,诱导肿瘤细胞增殖、抑制肿瘤细胞凋亡并促进肿瘤细胞迁移与侵袭,最终导致肾癌的发生与发展[33-34]。本研究结果显示,马齿苋酰胺E可有效上调786-O细胞中抑癌因子VHL蛋白表达,抑制其下游蛋白HIF-1α表达,表明马齿苋酰胺E可通过调控VHL/HIF-1α信号通路,从而抑制786-O细胞增殖、迁移与侵袭,并促进细胞凋亡。裸鼠肾癌移植瘤模型结果显示,马齿苋酰胺E可有效降低裸鼠肿瘤组织质量与体积,抑制肿瘤组织内部细胞增殖并促进肿瘤细胞凋亡,调控VHL/HIF-1α信号通路相关蛋白的表达,与体外实验结果一致。
综上所述,马齿苋酰胺E可通过下调Ki67、PCNA蛋白表达水平,抑制786-O细胞增殖;通过上调Cleaved Caspase-3、Cleaved Caspase-9蛋白表达水平,促进786-O细胞凋亡;下调MMP-2、MMP-9蛋白表达水平,抑制786-O细胞迁移与侵袭;并可通过调控VHL/HIF-1α信号通路,从而治疗肾癌。
利益冲突 所有作者均声明不存在利益冲突
[1] Bray F, Ferlay J, Soerjomataram I,. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]., 2018, 68(6): 394-424.
[2] Lou S, Ren L, Xiao J,. Expression profiling based graph-clustering approach to determine renal carcinoma related pathway in response to kidney cancer [J]., 2012, 16(6): 775-780.
[3] 赵振威, 李延江. 肾细胞癌流行病学的研究进展 [J]. 山东医药, 2013, 53(7): 95-97.
[4] Janzen N K, Kim H L, Figlin R A,. Surveillance after radical or partial nephrectomy for localized renal cell carcinoma and management of recurrent disease [J]., 2003, 30(4): 843-852.
[5] Lecis D, Sangaletti S, Colombo M P,. Immune checkpoint ligand reverse signaling: Looking back to go forward in cancer therapy [J]., 2019, 11(5): 624.
[6] 刘睿, 邓跃毅. 肾癌术后的中医药治疗体会 [J]. 中国中西医结合肾病杂志, 2009, 10(7): 629.
[7] 周小海. 浅谈中医治疗肾肿瘤 [J]. 医学信息, 2014, 27(27): 527.
[8] 中国药典[S]. 一部. 2015: 49-50.
[9] 王天宁, 刘玉婷, 肖凤琴, 等. 马齿苋化学成分及药理活性的现代研究整理 [J]. 中国实验方剂学杂志, 2018, 24(6): 224-234.
[10] 秦月雯, 侯金丽, 王萍, 等. 马齿苋“成分-活性-中药功效-疾病”研究进展及关联分析 [J]. 中草药, 2020, 51(7): 1924-1938.
[11] 鲍守民, 贾红梅, 邹忠梅, 等. 马齿苋生物碱的研究进展[J]. 药物评价研究, 2020, 43(6): 1174-1182.
[12] Xiang L, Xing D, Wang W,. Alkaloids fromL. [J]., 2005, 66(21): 2595-2601.
[13] 李玲玉. 马齿苋酰胺E和马齿苋提取物的神经保护和抗炎活性研究[D]. 济南: 山东大学, 2018.
[14] 孙洪祥. 马齿苋酰胺E对帕金森病模型的保护作用研究 [D]. 济南: 山东大学, 2016.
[15] Wen J, Li H Z, Ji Z G,. Human urothelial carcinoma cell response to sunitinib malate therapy[J]., 2015, 15: 26.
[16] 姜小良, 尹志康, 谭兵, 等. 藤黄酸联合舒尼替尼抑制肾癌细胞的增殖 [J]. 第三军医大学学报, 2014, 36(7): 687-690.
[17] Li L, Jiao Y, Jin T,. Phenolic alkaloid oleracein E attenuates oxidative stress and neurotoxicity in AlCl3- treated mice [J]., 2017, 191: 211-218.
[18] 孙飞达. 舒尼替尼对裸鼠肾癌干预的实验研究 [D]. 太原: 山西医科大学, 2012.
[19] Farhadieh R D, Smee R, Ow K,. Down-regulation of KAI1/CD82 protein expression in oral cancer correlates with reduced disease free survival and overall patient survival [J]., 2004, 213(1): 91-98.
[20] 牛少曦, 马鑫, 张瑜, 等. miR-223在肾透明细胞癌中的表达与功能 [J]. 南方医科大学学报, 2015, 35(3): 338-342.
[21] Khan M I, Sobocińska A A, Brodaczewska K K,. Involvement of the CB2cannabinoid receptor in cell growth inhibition and G0/G1cell cycle arrest via the cannabinoid agonist WIN55,212-2 in renal cell carcinoma [J]., 2018, 18(1): 583.
[22] 周微红, 奚颖. 周维顺治疗肾癌经验[J]. 江西中医药, 2012, 43(2): 12.
[23] 崔虎军. 中医药治疗肾癌浅探 [J]. 实用中医内科杂志, 2008, 22(3): 39-40.
[24] Nice E C, Fabri L, Hammacher A,. The purification of a Rap1 GTPase-activating protein from bovine brain cytosol [J]., 1992, 267(3): 1546-1553.
[25] 马志君, 吉洁. Ki67与肿瘤关系的研究进展 [J]. 中国医疗前沿, 2012, 7(7): 15-17.
[26] 佘茁萃, 姜毅, 刘涛, 等. 肠艾舒对小鼠CT-26大肠癌组织Ki67和PCNA表达的影响 [J]. 中国中医药信息杂志, 2014, 21(4): 52-54.
[27] Le T D, Jin D, Rho S R,. Capsaicin-induced apoptosis of FaDu human pharyngeal squamous carcinoma cells [J]., 2012, 53(4): 834-841.
[28] Green D R, Kroemer G. The pathophysiology of mitochondrial cell death [J]., 2004, 305(5684): 626-629.
[29] Tang S W, Yang T C, Lin W C,. Nicotinamide-methyltransferase induces cellular invasion through activating matrix metalloproteinase-2 expression in clear cell renal cell carcinoma cells [J]., 2011, 32(2): 138-145.
[30] Kawata N, Nagane Y, Hirakata H,. Significant relationship of matrix metalloproteinase 9 with nuclear grade and prognostic impact of tissue inhibitor of metalloproteinase 2 for incidental clear cell renal cell carcinoma [J]., 2007, 69(6): 1049-1053.
[31] 涂福平, 黄莉, 王祥财. 缺氧环境下VHL和HIF-1α的变化 [J]. 医疗装备, 2017, 30(5): 93-94.
[32] Liu Q, Tong D, Liu G,. HIF2A germline-mutation- induced polycythemia in a patient with VHL-associated renal-cell carcinoma [J]., 2017, 18(12): 944-947.
[33] Liontos M, Trigka E A, Korkolopoulou P,. Expression and prognostic significance of VEGF and mTOR pathway proteins in metastatic renal cell carcinoma patients: A prognostic immunohistochemical profile for kidney cancer patients [J]., 2017, 35(3): 411-419.
[34] Cho H, Du X L, Rizzi J P,. On-target efficacy of a HIF-2α antagonist in preclinical kidney cancer models [J]., 2016, 539(7627): 107-111.
Effect and mechanism of oleracein E on renal carcinoma
CHEN Sheng-ye, HUANG Hang, YE Ting-yu, PAN Yue
Department of Urological Surgery, The First Affiliated Hospital of Wenzhou Medical University, Wenzhou 325035, China
To investigate the effect and mechanism of oleracein E on proliferation, invasion, and migration of human renal carcinoma 786-O cells.Human renal carcinoma 786-O cells were culturedand treated with oleracein E (10, 20, and 40 μmol/L) for intervention. CCK-8 method was used to detect cell proliferation; Scratch test was used to detect cell migration ability; Transwell chamber method was used detect cell invasion ability; AO/EB kit was used to detect cell apoptosis rate. Kidney cancer model of transplanted tumor in nude mice was established and treated with oleracein E (3, 15 mg/kg) for intervention. Weight and volume of tumor in nude mice was determined, pathology changes of tumor tissue were observed by hematoxylin-eosin (HE) staining. Western blotting was used to detect expressions of cell proliferation marker such as Ki67 and proliferating cell nuclear antigen (PCNA), apoptosis marker such as activated cysteine protease-3 (Cleaved Caspase-3) and Cleaved Caspase-9, invasion-related protein such as matrix metalloproteinase-2 (MMP-2) and MMP-9, Von Hippel-Lindau (VHL)/hypoxia inducible factor-1α (HIF-1α) pathway related proteins such as VHL and HIF-1α in 786-O cells and tumor tissues of nude mice.Viability of 786-O cells was significantly inhibited (< 0.05, 0.01), expressions of Ki-67 and PCNA were down-regulated (< 0.05, 0.01); Apoptosis of 786-O cells was significantly promoted (< 0.05, 0.01), expressions of Cleaved Caspase-3 and Cleaved Caspase-9 were up-regulated (< 0.05, 0.01); Migration and invasion ability of 786-O cells were effectively improved (< 0.05, 0.01), expressions of MMP-2 and MMP-9 were significantly reduced (< 0.05, 0.01); VHL protein expression was significantly up-regulated (< 0.05, 0.01) and HIF-1α protein expression was significantly down-regulated (< 0.01) by oleracein E. Weight and volume of tumor in tumor-bearing nude mice were effectively reduced (< 0.05, 0.01), proliferation of tumor cells was inhibited and apoptosis of tumor cells was promoted, Ki67, PCNA, MMP-2, MMP-9, HIF-1α expression were significantly down-regulated (< 0.05, 0.01), expressions of Cleaved Caspase-3, Cleaved Caspase-9, and VHL were significantly up-regulated (< 0.05, 0.01) by oleracein E.Oeracein E can effectively inhibit the proliferation, migration, and invasion of 786-O cells, promote the apoptosis of 786-O cells, and effectively reduce the tumor weight and volume of tumor-bearing nude mice, of which mechanism may be related to the regulation of VHL/HIF pathway and its downstream protein expression.
renal cancer; migration; invasion; oleracein E; VHL/HIF-1α signaling pathway
R285.5
A
0253 - 2670(2021)06 - 1672 - 09
10.7501/j.issn.0253-2670.2021.06.016
2020-12-01
浙江省教育厅科研项目(Y202045313)
陈盛烨,男,副主任医师,主要从事泌尿外科的临床与基础研究。Tel: 13857736357 E-mail: 734623202@qq.com
[责任编辑 李亚楠]
