基于高通量测序和化学轮廓分析研究黄连在连栀矾溶液发酵炮制中的作用
2021-03-16张晓喻袁学刚袁钰婷史迎欣
吴 泽,杜 娟,谢 洁*,勾 洵,彭 玲,叶 羊,张晓喻*,袁学刚,袁钰婷,史迎欣
基于高通量测序和化学轮廓分析研究黄连在连栀矾溶液发酵炮制中的作用
吴 泽1,杜 娟2,谢 洁1*,勾 洵1,彭 玲1,叶 羊1,张晓喻1*,袁学刚3,袁钰婷1,史迎欣1
1. 四川师范大学生命科学学院,四川 成都 610101 2. 四川师范大学地理与资源科学学院,四川 成都 610101 3. 成都市第六人民医院,四川 成都 610058
探究黄连在连栀矾溶液传统发酵炮制中的作用。按照连栀矾溶液传统配方比例,将其拆分为3组配方溶液:连栀矾组(黄连+栀子+白矾)、黄连组(黄连+白矾)和栀子组(栀子+白矾),采用HPLC分析比较3组溶液发酵前后的化学成分变化轮廓,采用Illumina Hiseq高通量测序技术测定并比较发酵溶液中微生物的群落特征。传统配方连栀矾经发酵后环烯醚萜类成分发生了较显著的变化(<0.05),生物碱类成分未发生明显变化,拆分后的黄连组中生物碱类成分和栀子组中环烯醚萜类成分均没有发生明显变化。分别对各组发酵溶液进行测序,根据α多样性分析结果,3组发酵液中真菌多样性为连栀矾组<栀子组<黄连组,真菌的丰富度为栀子组<连栀矾组<黄连组;细菌多样性为连栀矾组<黄连组<栀子组,细菌的丰富度为连栀矾组<栀子组<黄连组。根据β多样性分析结果,3组溶液中的真菌和细菌的群落结构均有明显差异。根据微生物相对丰度分析可知,3组的优势真菌均为子囊菌门、担子菌门和罗兹菌门,不同组间丰度无明显差异;真菌优势属中的孢霉属的丰度在连栀矾组最高,显著高于另外2组(<0.05),栀子组又显著高于黄连组(<0.05);韦斯特壳属的丰度在连栀矾组中最低,显著低于黄连组和栀子组(<0.05),后两者间丰度无明显差异。3组的优势细菌均为变形菌门、厚壁菌门、放线菌门和拟杆菌门,其中连栀矾组中变形菌门的丰度极显著低于黄连组和栀子组(<0.01),厚壁菌门的丰度在连栀矾组中极显著高于黄连组和栀子组(<0.01),放线菌门和拟杆菌门的丰度在3组发酵溶液的差异较小;细菌优势菌属中的乳杆菌属在连栀矾组中显著高于黄连组和栀子组(<0.05),在黄连组中也显著高于栀子组(<0.05),伯克氏菌属丰度在黄连组和栀子组中无显著差异,都显著高于连栀矾组中的丰度(<0.05)。连栀矾溶液配方中的黄连能提高其中栀子的有效成分的发酵转化,并且是通过对发酵体系中的优势菌属的丰度进行调节而发挥作用的。进一步佐证了传统配方制剂的合理性和科学性。
连栀矾溶液;黄连;高通量测序;化学轮廓分析;微生物多样性;发酵;炮制;群落特征;环烯醚萜;生物碱;α多样性分析;β多样性分析;真菌;细菌
发酵是传统中药炮制中一种常用和重要的手段,在我国具有悠久的历史。中药的发酵炮制过程实际上是一个生物转化的过程,通过微生物代谢对中药活性成分的作用实现“减毒增效”[1]。连栀矾溶液是我国著名中医肛肠病学专家黄济川先生的临床效验方,至今已有近百年的临床应用历史,为成都肛肠专科医院的医院效验制剂(川药制字Z20080191)[2]。该制剂由2味植物中药材黄连、栀子和矿物质药材白矾组成,制作工艺非常独特,将黄连、栀子和白矾按组方加水经100 ℃煎煮后,滤过药液加盖静置于阴暗潮湿处发酵,待其表面出现豹纹式青灰色微生物,药液呈澄清的橙红色或黄棕色时装瓶使用。从现代生物技术的角度来看,连栀矾溶液的制作属于多菌种液态自然发酵。
课题组前期利用高通量测序技术测定分析连栀矾溶液发酵炮制过程中的微生物多样性和丰富度,结果表明炮制过程中所涉及的微生物种类繁多,真菌和细菌共同参与发酵,真菌的丰富度和多样性整体变化趋势随发酵时间的增加逐渐增加,细菌的丰富度和多样性整体变化趋势随发酵时间的增加逐渐降低[3-4]。同时对连栀矾溶液发酵过程的化学变化轮廓分析发现,不同时间发酵液的HPLC指纹图谱在色谱峰数量及峰面积方面均有较大的差异,对发酵液中栀子和黄连的主要功效成分进行分析发现,栀子中的环烯醚萜类成分是主要被转化的底物,而黄连中生物碱类化学成分在整个发酵过程没有发生较明显的转化[4-6]。
黄连是我国使用历史悠久的中药,具有天然的广谱抗菌性,同时也可促进益生菌的生长,具有丰富的临床应用基础。黄连的抗菌谱较广,对革兰阳性菌(如肺炎双球菌[7-8]、金黄色葡萄球菌[9-11]等)、革兰阴性菌(如绿脓杆菌[12-13]、大肠埃希菌[14-15]、耐药鲍曼不动杆菌[16-17]等)以及真菌(如白色念球菌[18-19]、假丝酵母菌[20-21]等)均具有显著的抑制作用。在黄连与肠道菌群的相互作用的研究中发现,黄连提取物可明显促进益生菌(乳酸菌、双歧杆菌)的生长,黄连解毒汤低剂量使用时或许有调节肠道菌群平衡的作用[22]。周俊怡等[23]采用Illumina高通量测序技术对黄连解毒汤组和空白对照组大鼠肠道的菌群进行定量检测,结果显示在临床剂量下,连续服用黄连解毒汤7 d能够引起健康大鼠部分肠道菌群比例明显变化。因此,黄连在调节菌群结构中可能发挥重要作用。那么黄连在连栀矾溶液发酵炮制中发挥的作用到底是什么,是否对微生物具有筛选作用,如何影响发酵炮制中微生物的多样性、丰富性,进而影响成分的生物转化?目前还没有相关研究文献进行论证。
本研究拟将连栀矾溶液配方进行拆分,利用HPLC法分析比较不同组方发酵溶液的化学轮廓,采用高通量测序技术研究比较不同组方发酵溶液中微生物的组成及丰度情况,以探究黄连在发酵中的作用,有助于了解黄连在整个发酵炮制中发挥的重要作用,同时也有助于对连栀矾溶液发酵机制的深入认识,为揭示连栀矾溶液的发酵机制提供研究基础,为连栀矾溶液现代化科学发酵提供理论依据。
1 仪器与材料
1.1 材料与试剂
黄连药材饮片(批号1811003051,产地四川)、栀子药材饮片(批号1811000971,产地江西)、白矾(批号1701070,产地四川)均购于成都康美药业生产有限公司,经该公司主管中药师黄华军鉴定,均符合《中国药典》2020年版一部相关项下要求。黄连为毛茛科黄连属植物黄连Franch.的干燥根茎,栀子为茜草科栀子属植物栀子Ellis的干燥成熟果实。色谱纯盐酸、磷酸、甲醇和乙腈均购于成都硕博研创科技有限公司;核酸染料EB(E607322)、琼脂糖(Agarose A600234),生工生物工程(上海)股份有限公司;PCR酶(KOD-401B:Toyobo KOD-Plus-Neo DNA Polymerase);DNA marker(Takara公司,DL2000);TE缓冲液;真菌引物ITS3_KYO2(5’-GATGAAG- AACGYAGYRAA-3’)和ITS4(5’-TCCTCCGCTT- ATTGATATGC-3’),细菌引物515F(5’-GTGCCA- GCMGCCGCGGTAA-3’)和806R(5’-GGACTAC- HVGGGTWTCTAAT-3’);DNA提取试剂盒(MO BIO PowerSoil DNA Isolation Kit);胶回收试剂盒,Omega公司;测序建库试剂盒(TruSeq DNA PCR- Free Sample Prep Kit);上机测序试剂盒(Hiseq Rapid SBS Kit v2)。
1.2 仪器与设备
Nano Drop MP2000C紫外分光光度计,Thermo Fisher公司;VersaDoc'5000凝胶成像仪,Bio-Rad公司;5424R离心机,Eppendorf公司;PowerPac Basic1645050电泳仪,Bio-Rad公司;Qubit 2.0荧光定量仪,Invitrogen公司;Firefly NIMBUS®96凝胶萃取仪,OMEGA-Biotek公司;Applied Biosystems GeneAmp 9700 PCR仪,ABI公司;Hiseq 2500测序仪,Illumina公司;1200型高效液相色谱分析仪,Agilent公司。
2 方法
2.1 发酵液制备与样品采集
连栀矾溶液包括黄连、栀子和白矾3种中药材,本实验按照传统配方比例,根据生药质量浓度一致性原则,将连栀矾溶液分拆为连栀矾组(黄连+栀子+白矾)、黄连组(黄连+白矾)、栀子组(栀子+白矾)。按比例称取中药材进行煎煮,收集滤液于有盖发酵桶中,静置于成都肛肠专科医院制剂室,自然发酵。每天采集发酵溶液样品并利用HPLC法测定发酵液中化学成分变化,以发酵液面出现豹纹式青灰色微生物,药液呈澄清的橙红色或黄棕色,溶液中栀子苷转化率≥95%时作为发酵的终点[24],到达发酵终点时共需发酵18 d,收集发酵终点时的发酵溶液进行高通量测序。样品采集时用无菌吸管在距离液面5 cm,发酵桶壁2 cm的平面的3个点等量进行取样(图1),然后混合为1个样本。

图1 取样示意图
2.2 色谱条件
色谱柱为Eclipse Agilent C18柱(250 mm×4.6 mm,5.0 μm);流动相为0.1%磷酸水溶液-乙腈,梯度洗脱:0~8 min,5%~15%乙腈;8~15 min,15%~18%乙腈;15~20 min,18%~20%乙腈;20~30 min,20%~25%乙腈;30~45 min,25%乙腈;体积流量1 mL/min;柱温25 ℃;检测波长238 nm;进样量10 μL[24]。
2.3 供试品溶液制备
取100 μL发酵液于10 mL棕色量瓶中,加入9 mL甲醇盐酸溶液[甲醇-盐酸(100∶1)],超声处理15 min,室温放置冷却后用甲醇盐酸溶液定容,然后将溶液经0.22 μm的微孔滤膜滤过后装于进样瓶中,按“2.2”项色谱条件进行分析[24]。
2.4 微生物组总DNA提取
按照MO BIO PowerSoil DNA Isolation Kit试剂盒说明书进行基因组DNA的提取,通过0.8%的琼脂糖凝胶电泳检测提取的DNA分子的质量,利用紫外分光光度计对DNA分子质量浓度进行检测,并稀释至10 ng/μL。
2.5 PCR扩增、文库构建及测序
以稀释后的基因组DNA为模板,用带有Barcode的特异引物进行扩增。真菌PCR扩增区域为18S rDNA基因中的ITS2区段,引物为ITS3_ KYO2(5’-GATGAAGAACGYAGYRAA-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’);细菌PCR的扩增区域为16S rRNA基因中的V4区,引物为515F(5’-GTGCCAGCMGCCGCGGTAA-3’)和806R(5’- GGACTACHVGGGTWTCTAAT-3’)。PCR扩增后与1/6体积的6XLoading Buffer混合,使用2%琼脂糖凝胶电泳检测,再使用QIAquick Gel Extraction Kit(QIAGEN)回收目的条带,然后用Qubit@2.0 Fluorometer(Thermo Scientific)定量,最后等物质的量混合。文库构建使用Illumina公司的TruSeq DNA PCR-Free Sample Prep Kit试剂盒进行,构建好的文库经过定量和文库检测合格后,使用Hiseq 2500平台PE250模式测序。
2.6 数据统计与分析
实验数据的统计、分析、绘图使用Office Excel 2019、IBM SPSS Statistics 24、Origin 2020和中药色谱指纹图谱相似度评价系统2012版软件进行;测序数据的生物信息学分析使用OmicStudio工具(https://www.omicstudio.cn/)进行。
3 结果与分析
3.1 发酵溶液中化学成分变化轮廓分析
对3个组发酵前后的溶液(0、18 d)进行HPLC分析得到指纹图谱,根据峰面积归一化法,统计占比达到2%以上的色谱峰,结合叶羊等[24]对连栀矾溶液中化学成分的指认方法,结果确定了发酵液中的主要化学成分,并对主要化学成分发酵前后的色谱峰峰面积变化进行单因素方差分析。不同组方发酵溶液发酵前后的主要化学成分的色谱峰峰面积见表1。同时,绘制了HPLC指纹图谱(图2-A和B)及主要化学成分的峰面积的热图(图2-C)以直观展示不同组方发酵液化学成分在发酵前后的变化情况。分析可知,连栀矾组(黄连、栀子、白矾)溶液中化学成分经发酵后整体变化显著(<0.05),与之前研究一致,黄连所含有的非洲防己碱、表小檗碱、盐酸药根碱、盐酸黄连碱、盐酸巴马汀和盐酸小檗碱(序号6~9、12和13)等生物碱类成分的含量无明显变化,栀子所含主要的环烯醚萜类成分变化显著(<0.05),发酵前主要成分京尼平龙胆双糖苷(序号1)和栀子苷(序号3)随着发酵的进行转化为京尼平(序号5),以及新的环烯醚萜类物质即化合物1、3和4(序号2、10、11)。黄连组(黄连、白矾)发酵溶液中生物碱类化学成分在发酵后含量未发生明显变化,栀子组(栀子、白矾)发酵溶液中环烯醚萜类化学成分在发酵后含量也未发生明显变化,这与连栀矾组溶液中的变化情况不一致。由此可知,黄连的加入提高了溶液中栀子中主要化学成分的转化,这种转化是微生物作用的结果,说明黄连在发酵过程中可能对微生物菌群有调节作用。

表1 不同组方溶液发酵前后主要化学成分色谱峰面积变化情况
表格中峰面积的单位均为mAU
The unit of peak area in the table is mAU
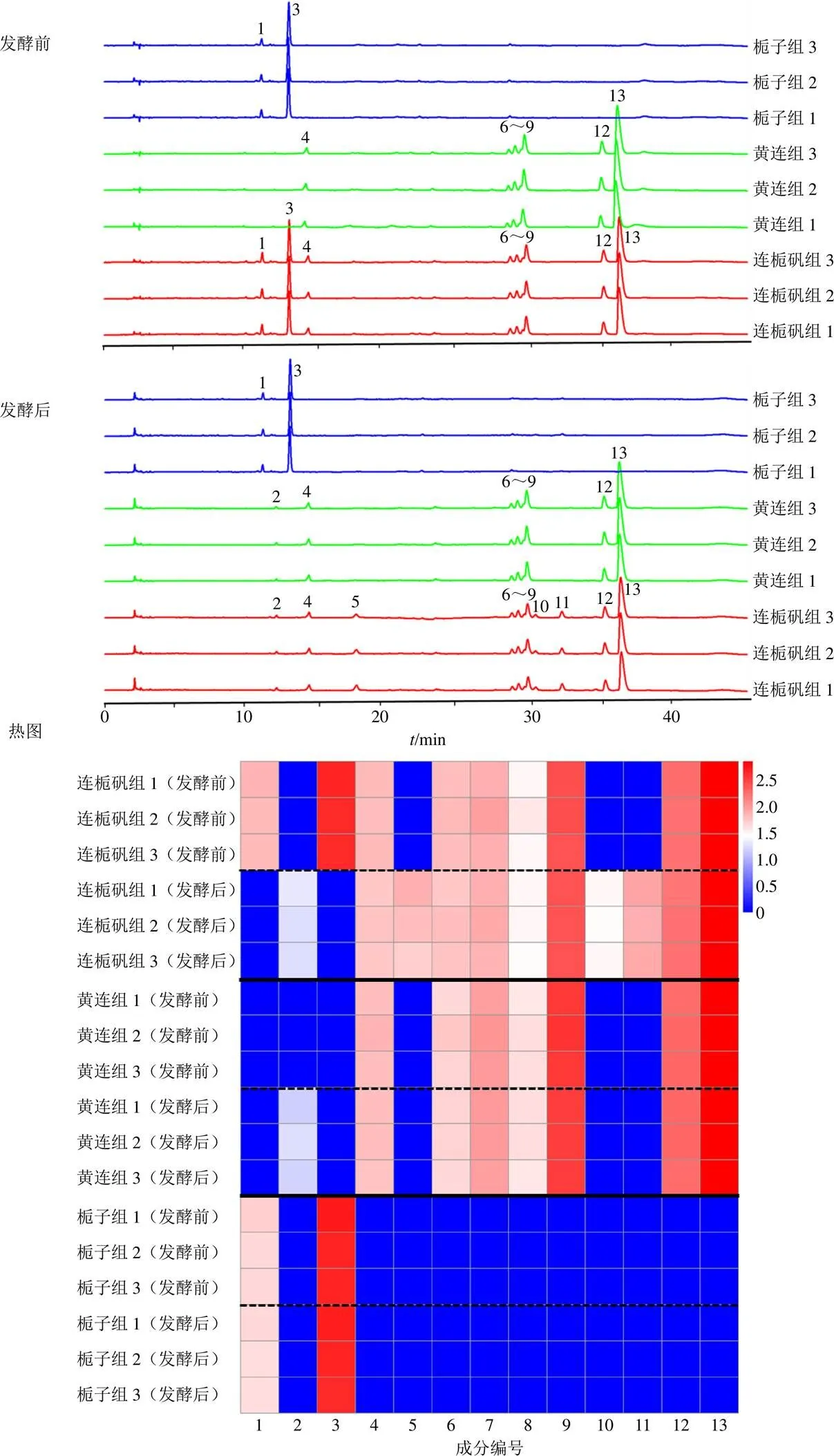
图2 不同组方溶液发酵前、后的HPLC指纹图谱及发酵前后主要化学成分(1~13)色谱峰面积热图
3.2 测序结果及质量分析
不同组方发酵液样品测序序列统计(表2)发现,3种发酵液中共测得真菌有效序列334 026条,其中高质量序列有312 606条,占序列总数的93.59%;细菌有效序列325 218条,其中高质量序列有292 326条,占序列总数的89.89%。真菌序列条数在连栀矾组溶液中的最多,黄连组中的数量与连栀矾组相当,栀子组中最少;细菌序列条数在黄连组溶液中最多,连栀矾组和栀子组中的数量基本一致。值表示测序碱基的质量值,其中30代表正确的碱基识别率达到99.9%时的值,在本次测序样本的30的比例均到达93%以上,说明本次测序整体质量水平较高。

表2 样品序列统计
3.3 OTU(operational taxonomic units)划分和分类地位鉴定
以97%的相似度对获得的序列进行归并和OTU划分,得到每个样品的OTU数量,以此可以表示样品中物种的丰度[25]。结果表明,在各分类水平,真菌OTU的数量在黄连组和栀子组溶液中没有较大差异,而且都多于连栀矾组溶液;细菌OTU的数量在连栀矾组和栀子组溶液中没有明显差异,都少于黄连组溶液(表3)。利用Venn图分析多组样本中OTU的情况可知(图3),连栀矾组、黄连组和栀子组溶液样本中共划分为2878个真菌OTUs,其中共有OTU达到418个,占总数量的43.57%;特有OTU数分别是161、129、241个,占其样本总数的20.99%、12.38%、24.64%。连栀矾组、黄连组和栀子组溶液样本中共划分为1594个细菌OTUs,其中共有OTU有318个,占总数量的59.85%;特有OTU数分别是75、97、112个,占其样本总数的14.65%、17.05%和21.83%。
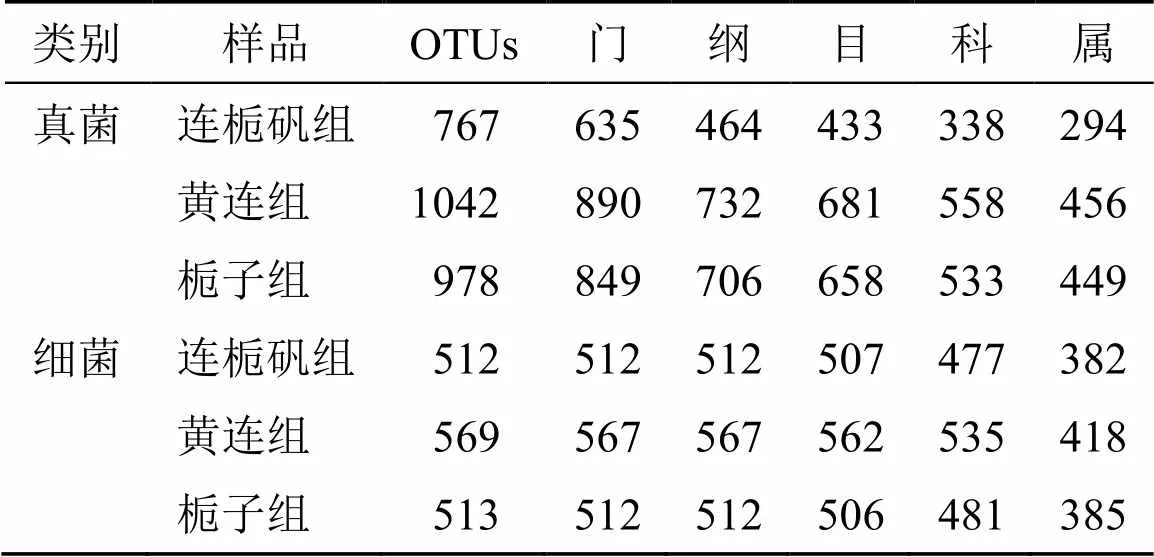
表3 OTU划分和分类地位鉴定结果统计
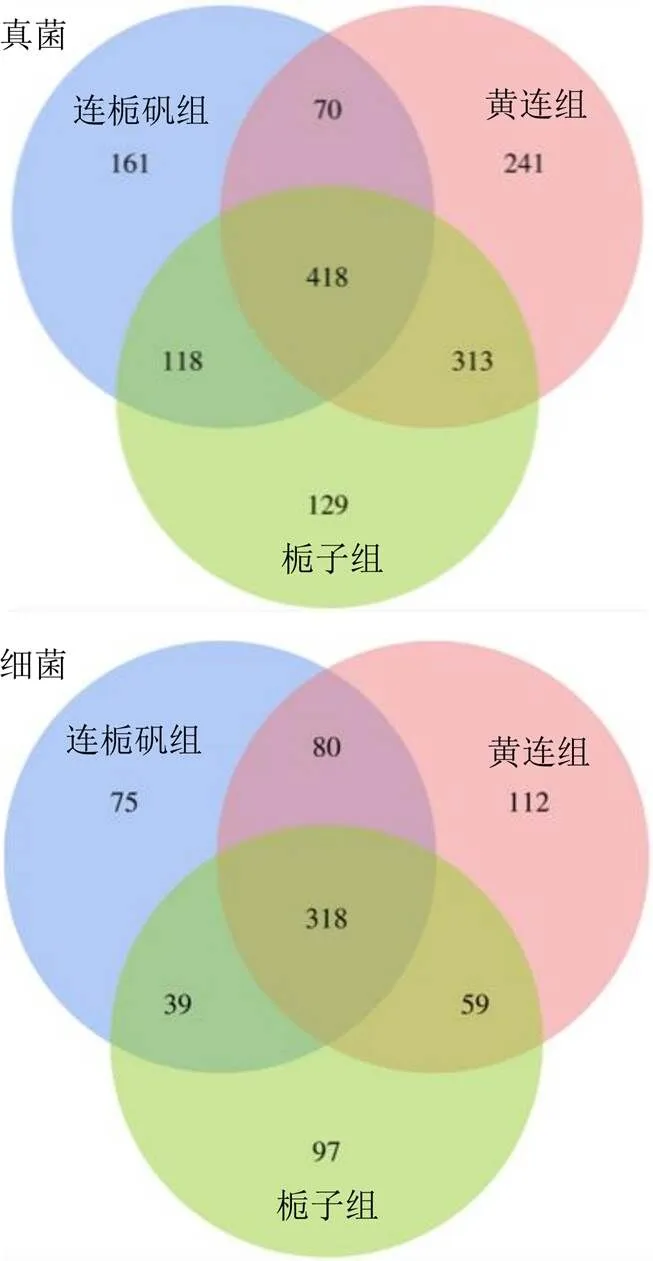
图3 样品韦恩图
3.4 α多样性分析
3.4.1 稀释曲线 为了探索样本物种丰富度随测序深度的变化趋势,一般进行稀释曲线的制作。方法是从样本中随机抽取一定量的序列,并统计它们所代表的物种数目,以抽取的一系列序列数和相应的物种数来构建曲线。当曲线趋于平缓时可认为测序深度已经基本覆盖到样品中所有的物种,增大数据量只会产生少量的低丰度物种。由图4可知,所有的发酵溶液样本随着测序深度的增加,曲线不断趋于平缓,说明测序数量此时已经足够大,能够覆盖样本中绝大多数的微生物信息。
3.4.2 α多样性指数 在群落生态学的研究中,α多样性常用来表征样本的物种丰富程度及多样性,其中Chao1指数、Ace指数可以反映群落物种的丰富度,Shannon指数、Inv Simpson指数可以反映群落的多样性,它们的数值越大,菌群丰富度和多样性越高。
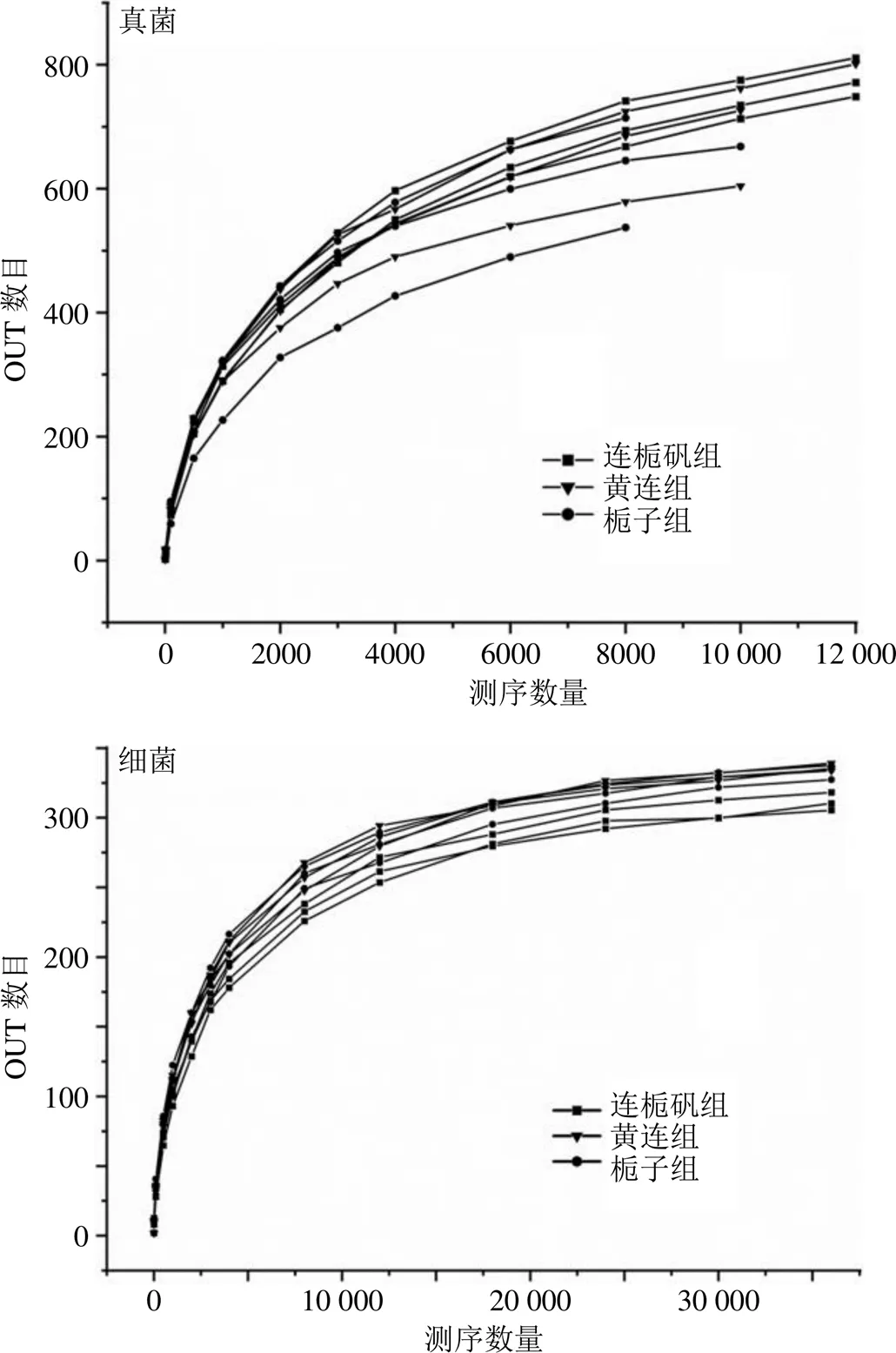
图4 稀释曲线
不同发酵溶液样本的α多样性指数计算结果如表4所示,真菌群落的Chao1指数和Ace指数都是在黄连组中最大,其次为连栀矾组,在栀子组中的最小,说明真菌群落的丰富度大小依次为黄连组>连栀矾组>栀子组;Shannon指数和Inv Simpson在黄连组中最大,在连栀矾组中最小,说明真菌群落的多样性大小依次为黄连组>栀子组>连栀矾组。细菌群落的Chao1指数和Ace指数也都是在黄连组最大,在连栀矾组和栀子组中的几乎无差异,说明细菌群落的丰富度大小依次为黄连组>栀子组>连栀矾组;Shannon指数和Inv Simpson在栀子组中最大,在连栀矾组中最小,说明细菌群落的多样性大小依次为栀子组>黄连组>连栀矾组。在各发酵液中真菌群落的丰富度指数和多样性指数都显著高于细菌群落(<0.05),说明发酵过程中的真菌具有比细菌更高的丰富度和多样性。
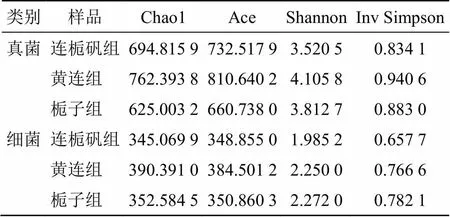
表4 样品中微生物α多样性指数
3.5 β多样性分析
主成分分析(principal component analysis,PCA)是一种对数据进行简化分析的技术,这种方法可以有效的找出数据中最主要的元素和结构,去除噪音和冗余,将原有的复杂数据降维,揭示隐藏在复杂数据背后的简单结构[26]。通过分析不同样本群落组成可以反映样本间的差异和距离,PCA运用方差分解,将多组数据的差异反映在二维坐标图上,坐标轴取能够最大反映样品间差异的2个特征值。样本物种组成越相似,反映在PCA图中的距离越近。图5所示为发酵溶液中微生物的PCA图,真菌和细菌的主成分分析的第1主成分和第2主成分的贡献率分别为62.16%、21.2%和62.1%、27.1%,说明在PCA中所选主成分可以充分解释原始数据中的差异。由PCA可知,3组样品在PCA图中分布都较分散,距离较远,说明3组样品中真菌和细菌的菌群结构都差异较大。通过基于Bray-Curtis距离的样本层级聚类分析,得到图6所示结果,由图可知,3组样品在聚类图中都分别聚为一类,真菌中连栀矾组与黄连组、栀子组的距离分别为0.12和0.32,黄连组和栀子组的距离为0.21,细菌中连栀矾组与黄连组、栀子组的距离分别为0.27和0.41,黄连组和栀子组的距离为0.19,说明3组溶液样品中的真菌和细菌的群落结构都存在较大的差异,黄连可能对发酵体系中微生物的群落结构有一定的调节作用。
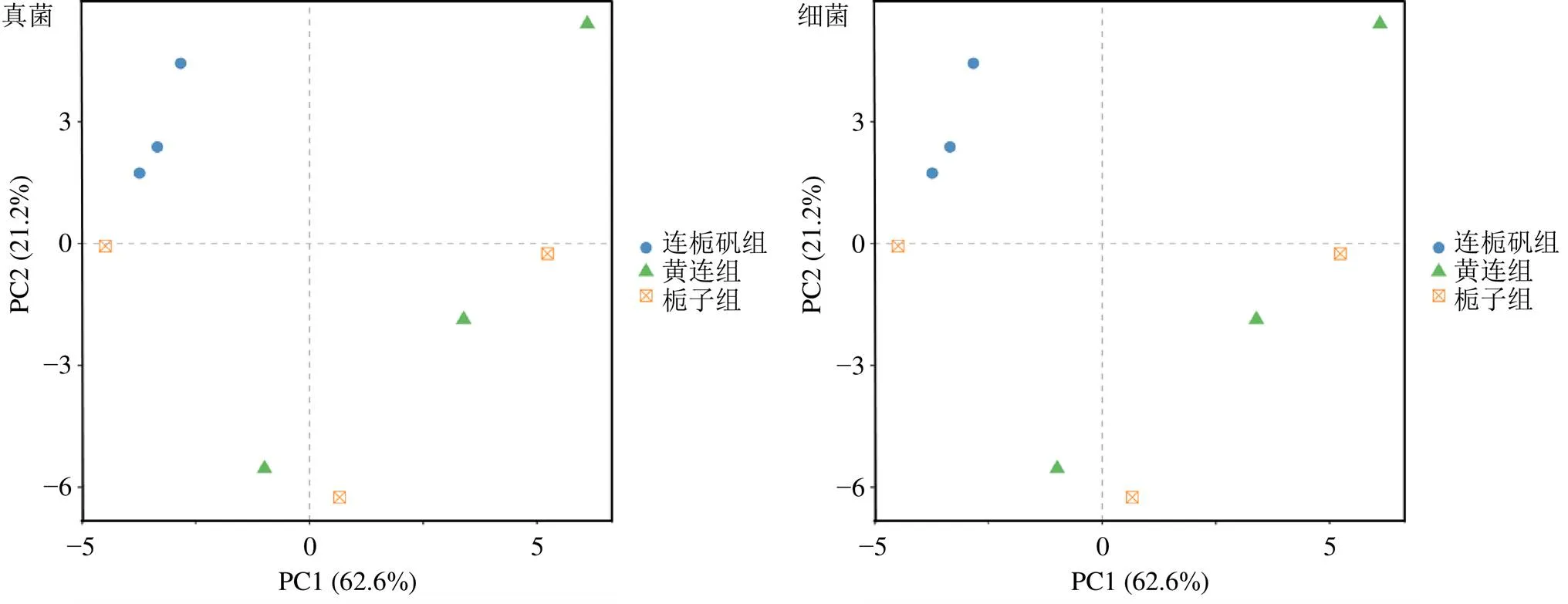
图5 微生物群落PCA图
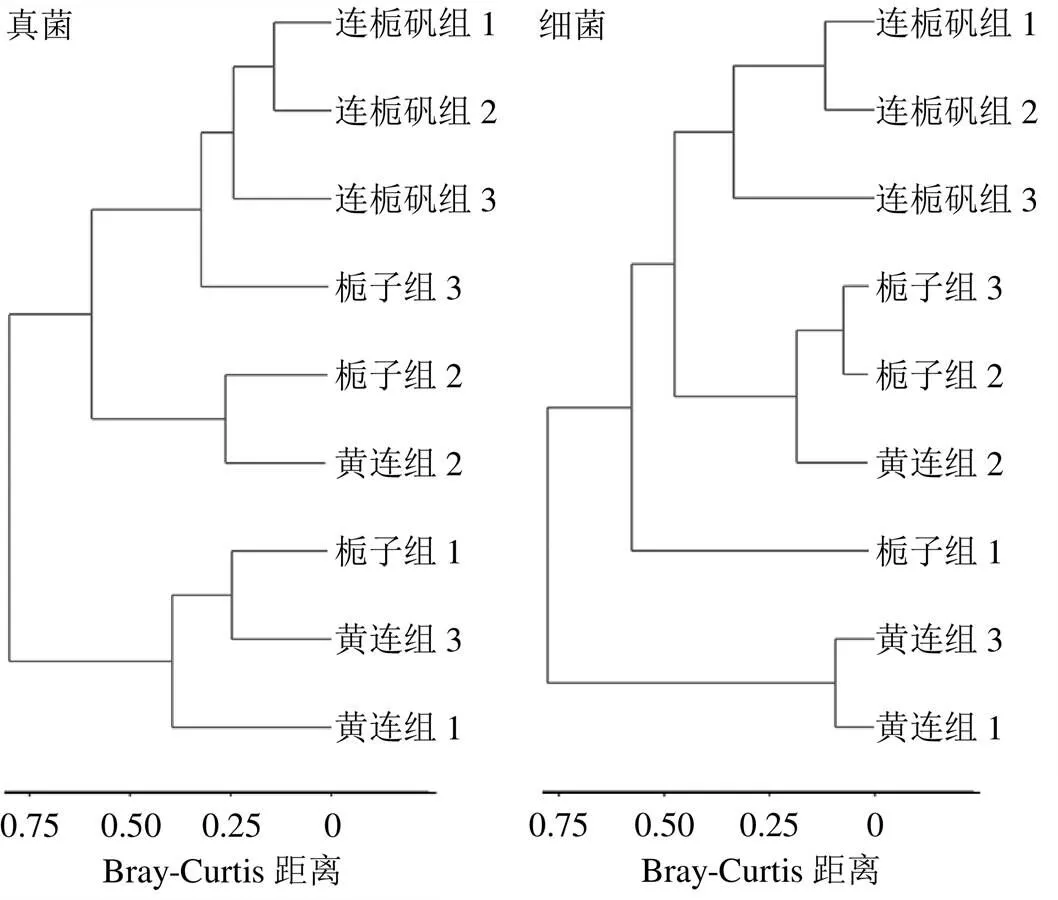
图6 基于Bray-Curtis距离的样本层级聚类图
3.6 各分类水平群落组成分析
3.6.1 门水平群落组成分析 不同组方发酵液中微生物群落的组成及丰度如图7所示(图7-A中Other表示未分类的门;图7-B中Other表示相对丰度排名10以后的门)。真菌中的子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和罗兹菌门(Rozellomycota)的相对丰度较高,它们在连栀矾组中的丰度分别为78.55%、8.96%、5.67%,在黄连组中的丰度分别为72.25%、14.61%、5.23%,在栀子组中的丰度分别为80.48%、8.29%、3.96%。真菌中的球囊菌门(Glomeromycota,0~0.05%)、被孢霉门(Mortierellomycota,0.02%~0.05%)、毛霉门(Mucoromycota,0~0.01%)和壶菌门(Chytridiomycota,0~0.01%)等在发酵溶液中的相对丰度都极低(图7-A)。
细菌中相对丰度排名前10的门为变形菌门(Proteobacteria,37.56%~81.34%)、厚壁菌门(Firmicutes,2.15%~52.14%)、放线菌门(Actinobacteria,6.64%~10.70%)、拟杆菌门(Bacteroidetes,2.76%~4.82%)、异常球菌-栖热菌门(Deinococcus-Thermus,0.34%~0.59%)、Kiritimatiellacota(0.07%~0.09%)、广古菌门(Euryarchaeota,0.05%~0.07%)、绿弯菌门(Chlorolexi,0.03%~0.07%)、疣微菌门(Verrucomicrobia,0.03%~0.05%)和浮霉菌门(Planctomycetes,0.02%~0.05%)。变形菌门、厚壁菌门、放线菌门和拟杆菌门是发酵溶液中的优势细菌门,它们在不同组方中的丰度差异较大。连栀矾组中变形菌门的丰度极显著低于黄连组和栀子组(<0.01),分别为37.56%、64.24%、81.34%;厚壁菌门的丰度在连栀矾组中极显著高于黄连组和栀子组(<0.01),分别为52.14%、27.43%、2.15%;放线菌门和拟杆菌门的丰度在3组发酵溶液的差异较小,在连栀矾组、黄连组和栀子组中丰度分别为6.64%、4.36%、10.70%与2.76%、3.13%、4.82%(图7-B)。

图7 门水平微生物群落组成
3.6.2 属水平群落组成分析 在属水平分析了发酵溶液中高丰度物种的群落组成及丰度情况,绘制了丰度排名前10的真菌和细菌群落组成柱状图(图8)。分析可知,真菌中丰度靠前的10个菌属如图8-A所示,其中孢霉属spp.(14.08%~41.50%)、曲霉属(4.43%~4.87%)、韦斯特壳属(2.58%~12.85%)、青霉属(1.25%~1.93%)、假丝酵母属(1.87%~2.15%)为真菌中优势菌属,这与课题组前期研究一致。比较拆方后各组优势真菌属的丰度差异,发现曲霉属、青霉属和假丝酵母属的丰度在3组发酵溶液中无明显差异,但是孢霉属的相对丰度在栀子组中显著高于黄连组溶液(<0.05),两者都显著低于连栀矾组溶液中丰度(<0.05);韦斯特壳属的丰度在连栀矾组中显著低于黄连组和栀子组(<0.05),而后两者丰度无明显差异,说明黄连能调节发酵体系中真菌的群落丰度。
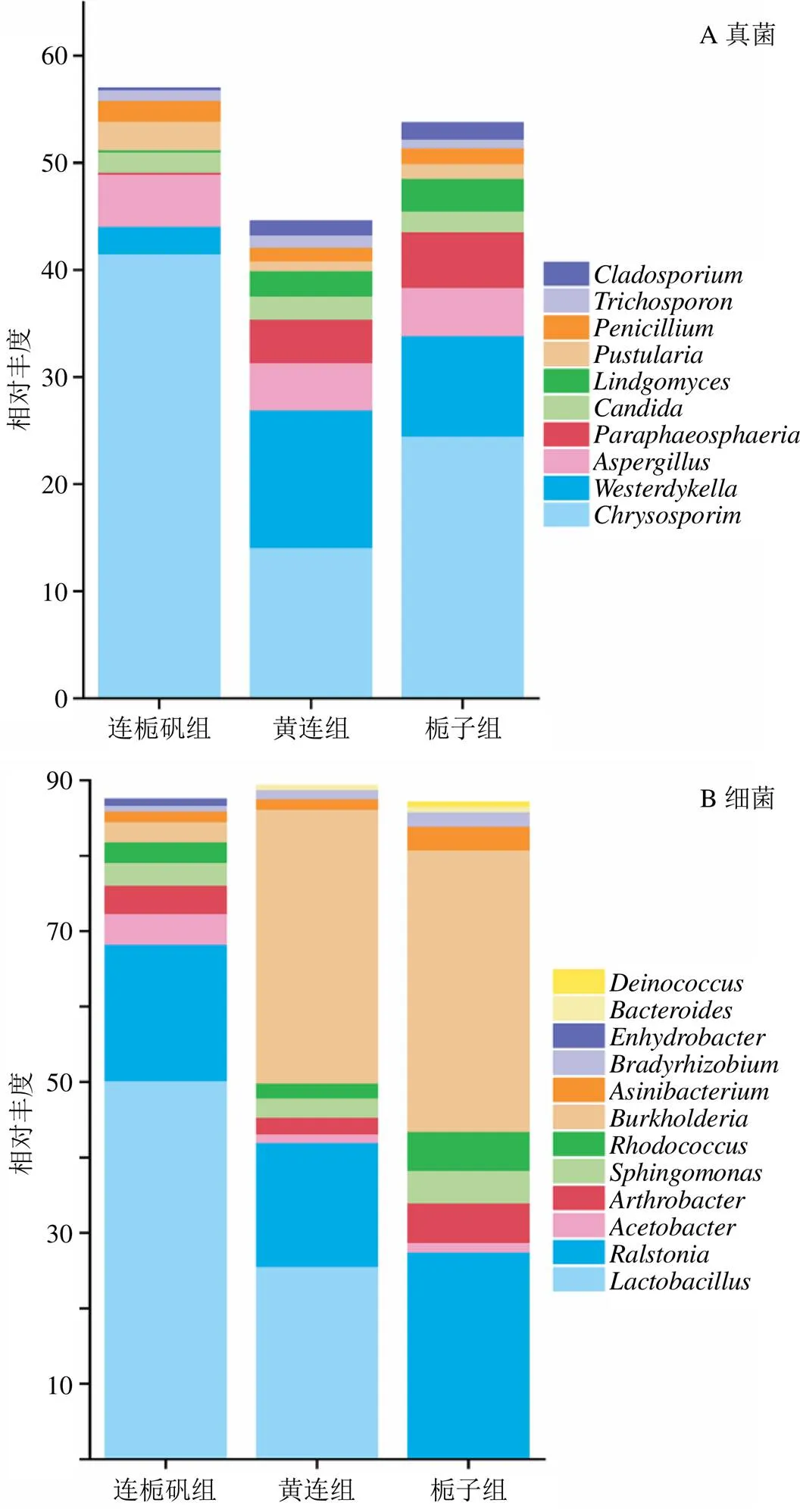
图8 属水平微生物群落组成
细菌群落中丰度相对靠前的菌属为乳杆菌属(0~50.18%)、劳尔氏菌属(16.41%~27.45%)、醋杆菌属(1.13%~4.10%)、节杆菌属(2.21%~5.25%)、鞘脂单胞菌属(2.59%~4.29%)、红球菌属(1.95%~5.20%)、伯克氏菌属(2.62%~37.31%)、(3.11%~1.42%)、慢生根瘤菌属(0.73%~1.95%)和拟杆菌属(0~0.74%)(图8-B)。其中乳杆菌属、劳尔氏菌属和的伯克氏菌属丰度较高,是发酵中的优势细菌属。比较各组优势细菌属的丰度差异,发现乳杆菌属在连栀矾组中显著高于黄连组和栀子组(<0.05),在黄连组中也显著高于栀子组(<0.05);劳尔氏菌属丰度在栀子组中最高,在连栀矾组中最低,3组发酵溶液中劳尔氏菌属的丰度没有明显的差异;伯克氏菌属丰度在黄连组和栀子组中无显著差异,都显著高于连栀矾组中的丰度(<0.05),说明黄连也对发酵体系中细菌的数量具有调节作用。
3 讨论
本研究通过对传统的连栀矾溶液配方进行拆分发酵,分析比较了不同组方发酵溶液在发酵后的化学成分变化及微生物群落特征。从各组配方组化学成分发酵前后的变化及发酵后各组之间的成分差异,可以明确组方中的栀子是在发酵过程中被微生物转化的药材,其主要功效成分环烯醚萜类化合物,尤其是栀子苷的转化非常明显,但是仅有栀子和白矾的发酵组,栀子被微生物转化的程度大大降低,说明加入黄连共同发酵对栀子的转化有很好的促进作用。
从发酵后各组之间的微生物群落特征的比较后发现,不管是哪种配方,发酵炮制系统中真菌的群落丰富度和多样性都明显高于细菌,并且不同组间真菌和细菌的丰富度和多样性、及群落结构又呈现出不同的差异性。在发酵过程中只有配方中的药材为发酵溶液中微生物的生长提供所需的营养物质,黄连、栀子都有的传统配方连栀矾组溶液中的化学成分相对于另外2个拆方组来说种类和含量均占优势,发酵时提供给微生物生长的营养物质最多,更有利于微生物的生长,但是结果表现为不管真菌还是细菌其丰富度和多样性均不是最高。真菌多样性最高的是黄连白矾组,细菌多样性最高的是栀子白矾组。
结合课题组前期对连栀矾溶液发酵过程中真菌和细菌的演替特征的测定,发现真菌的丰富度和多样性整体变化趋势随发酵时间的增加逐渐增加,而细菌的变化与真菌刚好相反,说明真菌和细菌之间存在相互拮抗作用。又因为黄连在抑菌方面具有显著的效果,因此,只有黄连的拆方组可能由于黄连的抑菌成分抑制了细菌的生长,使得体系中的真菌优势生长,表现为丰富度和多样性均最高,而仅有栀子的拆方组由于没有黄连,也就没有了抑制细菌生长的抑菌成分,体系中的细菌生长旺盛,拮抗了真菌的生长,所以表现为细菌丰富度高而真菌丰富度低。当黄连、栀子组合在一起进行发酵时,黄连能发挥抑菌的作用,调节系统中的真菌生长,使得体系中真菌与细菌的群落结构均与拆方组有明显的不同,这可能就是完全配方组中栀子的功效成分转化率最高的原因。
因此,本研究结果证实了连栀矾溶液传统配方中虽然经过发酵黄连的主要功效成分不发生转化,但是它通过调节自然发酵体系中的微生物群落,使得转化栀子苷等主要功效成分的真菌处于优势生长,保证其转化完全,从而在一定程度上也保证了产品在自然发酵工艺条件下的质量,这也进一步佐证了传统配方制剂的合理性和科学性。
利益冲突 所有作者均声明不存在利益冲突
[1] 乔延江, 王延年, 史新元. 中药发酵炮制学 [M]. 北京: 科学出版社, 2013: 23-25.
[2] 袁学刚, 王战国, 邹亮, 等. 连栀矾溶液促进大鼠肛周脓肿创面愈合作用研究 [J]. 成都中医药大学学报, 2016, 39(1): 39-43.
[3] 袁学刚, 叶羊, 赵甲元, 等. 基于高通量测序分析连栀矾溶液发酵炮制过程中真菌菌群多样性变化 [J]. 中草药, 2018, 49(18): 4259-4268.
[4] 叶羊. 连栀矾溶液发酵炮制过程中化学成分的动态变化与微生物的动态演替研究 [D]. 成都: 四川师范大学, 2020.
[5] 袁学刚, 王战国, 胡慧玲, 等. HPLC测定连栀矾溶液中表小檗碱、黄连碱、巴马汀和盐酸小檗碱的含量 [J]. 中药与临床, 2016, 7(1): 31-33.
[6] 郭懿萍, 覃彩缤, 陈黎, 等. UPLC-MS/MS法测定连栀矾溶液中7种成分的含量 [J]. 中药材, 2018, 41(9): 2143-2146.
[7] Al-Rashidi R R, Al-Shaikhli H, Alsaray R A,. Antibacterial activity of selected fractions extract ofFranch rhizomes [J]., 2020, 20(3): 985-990.
[8] 王华富, 商振球, 桂志红, 等. 中药黄连对临床常见耐药菌株的体外抑菌活性分析 [J]. 中国药师, 2018, 21(9): 1662-1664.
[9] Hao Y M, Huo J H, Wang T,. Chemical profiling ofrootlet and screening of its bioactive compounds in inhibitingby UPLC-Q-TOF/MS [J]., 2020, 180: 113089.
[10] Luo J Y, Yan D, Yang M H. Study of the anti-MRSA activity ofby chemical fingerprinting and broth microdilution methods [J]., 2014, 12(5): 393-400.
[11] 陈仁德, 李勇军. 10种中草药对临床常见致病菌体外抗菌作用的实验 [J]. 抗感染药学, 2018, 15(2): 196-198.
[12] Kim E H, Jang Y A, Kim S B,. Antimicrobial, antifungal effect and safety verification using BCOP assay of extracts from[J]., 2018, 61(3): 297-304.
[13] 黄晓辉, 高贵阳, 黄志昂. 12种中药对20株广泛耐药铜绿假单胞菌的体外抑菌作用研究 [J]. 中国实用医药, 2018, 13(31): 196-198.
[14] 桂勇, 黄俐华, 胡小洋, 等. 10种中药对产ESBLs大肠埃希菌的体外抑菌活性 [J]. 中国现代医生, 2013, 51(31): 65-67.
[15] 黄梅, 于千惠, 谭玲玲, 等. 12种中药免煎颗粒剂体外抑菌活性研究 [J]. 时珍国医国药, 2017, 28(7): 1617-1619.
[16] Tsai C C, Lin C S, Hsu C R,. Using the Chinese herbagainst extensively drug-resistantinfections:andstudies [J]., 2018, 18(1): 96.
[17] 吴贤丽, 庞载元, 敖茂程, 等. 4种中药对广泛耐药鲍曼不动杆菌的抑菌作用 [J]. 国际检验医学杂志, 2016, 37(8): 1030-1031.
[18] Park J S, Lee J H. Mechanism in antibacterial activity on fraction ofagainst[J]., 2017, 10(7): 2387-2390.
[19] 李钰乐, 方毅, 李亚婷, 等. 秦皮等10种中药对白色念珠菌抑制作用的体外实验研究 [J]. 延安大学学报: 医学科学版, 2017, 15(2): 53-55.
[20] 吴亚, 刘东梅, 郄会卿, 等. 黄连等对假丝酵母菌的体外抑菌研究 [J]. 中国实验诊断学, 2016, 20(8): 1276-1277.
[21] 张丽娟, 宁玉梅, 丁美红, 等. 黄连对白假丝酵母菌性阴道炎家兔阴道组织中TGF-β1表达的影响及临床意义 [J]. 中华中医药学刊, 2016, 34(9): 2258-2260.
[22] 罗海华, 董姝, 张晟, 等. 黄连解毒汤对小鼠肠道菌群的影响 [J]. 热带医学杂志, 2009, 9(4): 369-371.
[23] 周俊怡, 周严严, 赵海誉, 等. 黄连解毒汤对健康大鼠肠道菌群结构影响的研究 [J]. 浙江中医药大学学报, 2018, 42(10): 804-809.
[24] 叶羊, 张晓喻, 杜娟, 等. 连栀矾溶液不同储存条件下主要活性成分变化研究 [J]. 中草药, 2019, 50(23): 5745-5752.
[25] Zhang M L, Zhang M H, Zhang C H,. Pattern extraction of structural responses of gut microbiota tooinfection via multivariate statistical analysis of clone library data [J]., 2009, 70(2): 21-29.
[26] Anderson M J, Crist T O, Chase J M,. Navigating the multiple meanings of β diversity: A roadmap for the practicing ecologist [J]., 2011, 14(1): 19-28.
Based on high-throughput sequencing and chemical profiling to study role ofin concocting of Lianzhifan solution
WU Ze1, DU Juan2, XIE-Jie1, GOU Xun1, PENG Ling1, YE Yang1, ZHANG Xiao-yu1, YUAN Xue-gang3, YUAN Yu-ting1, SHI Ying-xin1
1. College of Life Science, Sichuan Normal University, Chengdu 610101, China 2. College of Geography and Resource Science, Sichuan Normal University, Chengdu 610101, China 3. The Sixth People’s Hospital of Chengdu, Chengdu 610058, China
To investigate the role of Huanglian () in the traditional fermentation processing of Lianzhifan solution.According to the traditional formula ratio of Lianzhifan solution, it was divided into three groups of formula solutions: Lianzhifan group [Huanglian () + Zhizi () + Baifan () (LZF)],group [+(CR)], andgroup [+(GF)]. The chemical composition changes of the three groups of solutions before and after fermentation were analyzed and compared by HPLC. Illumina Hiseq high-throughput sequencing technology was used to determine and compare the community characteristics of microorganisms in the fermentation solution.The iridoid composition of the traditional formula LZF group has undergone significant changes after fermentation (< 0.05), and the alkaloid composition has not changed significantly. The alkaloid composition in CR and the iridoids in GF did not change significantly after fermentation. The fermentation solutions of each group were sequenced. According to the results of α diversity analysis, the fungal diversity in the three fermentation broths was LZF < GF Lianzhifan solution;; high-throughput sequencing; chemical profile analysis; microbial diversity; fermentation; processing; community characteristics; iridoids; alkaloids; α diversity analysis; β diversity analysis; fungi; bacteria R283.1 A 0253 - 2670(2021)06 - 1623 - 11 10.7501/j.issn.0253-2670.2021.06.010 2020-11-12 四川省科技计划项目(2020YJ0372) 吴 泽(1993—),男,硕士研究生,专业方向为微生物学。Tel: 18123346194 E-mail: 906264997@qq.com 谢 洁 Tel: 13880757684 E-mail: xiejaye@163.com 张晓喻 Tel: 13060005523 E-mail: zhangxy2005@126.com [责任编辑 郑礼胜]
