整合糖组与代谢组学方法比较蒸制和酒炖熟地黄化学成分
2021-03-16张晓亚徐金娣邹叶廷李松林
张晓亚,徐金娣,许 军,邹叶廷,龙 芳, 3*,李松林*
整合糖组与代谢组学方法比较蒸制和酒炖熟地黄化学成分
张晓亚1, 2,徐金娣2,许 军1,邹叶廷1,龙 芳1, 3*,李松林1, 2*
1. 南京中医药大学附属中西医结合医院 中药质量研究室,江苏 南京 210028 2. 江苏省中医药研究院和中国中医科学院江苏分院 中药代谢组研究室,江苏 南京 210028 3. 南京中医药大学附属中西医结合医院 呼吸科,江苏 南京 210028
对《中国药典》收载的蒸制和酒炖2种炮制法所得熟地黄的化学成分进行比较研究。整合基于HPLC(C18)-PDA、HPLC(NH2)-ELSD和高效凝胶渗透色谱(HPGPC)-ELSD的糖组学和基于UPLC-QTOF-MS/MS的代谢组学方法,对2种熟地黄的糖类组分(多糖、寡糖和游离单糖)和非糖小分子组分进行分析比较。与蒸制地黄相比,酒炖地黄多糖相对分子质量范围更宽,较大相对分子质量多糖占比较高。2种熟地黄多糖均由甘露糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成,但其物质的量比稍有不同(2.57∶0.05∶1.00∶0.87∶0.102.07∶0.07∶1.00∶1.05∶0.17)。2种熟地黄均含有寡糖水苏糖、甘露三糖和蜜二糖,但酒炖地黄中水苏糖含量显著高于蒸制地黄(<0.01)。2种熟地黄均含有游离单糖葡萄糖、果糖、鼠李糖、甘露糖、半乳糖和阿拉伯糖,但酒炖地黄中葡萄糖(<0.01)、鼠李糖(<0.05)和甘露糖(<0.05)含量均显著低于蒸制地黄,而半乳糖含量显著高于蒸制地黄(<0.05)。2种熟地黄中共筛选到29个差异性非糖小分子成分,主要为环烯醚萜苷类、苯乙醇苷类和呋喃醛衍生物。代表性成分定量分析表明,与蒸制地黄相比,酒炖地黄中梓醇、益母草苷和地黄苷D含量较高(<0.01),密力特苷(<0.05)和5-羟甲基糠醛(<0.01)含量较低。蒸制和酒炖地黄内在质量存在显著差异,这种内在质量差异是否会显著影响其药效仍有待深入研究。
熟地黄;蒸制;酒炖;糖组学;代谢组学;HPLC;高效凝胶渗透色谱;UPLC-QTOF-MS/MS;多糖;寡糖;游离单糖;甘露糖;半乳糖醛酸;葡萄糖;半乳糖;阿拉伯糖;水苏糖;甘露三糖;蜜二糖;果糖;鼠李糖;环烯醚萜苷类;苯乙醇苷类;呋喃醛衍生物;梓醇;益母草苷;地黄苷D;密力特苷;5-羟甲基糠醛
熟地黄为玄参科地黄属植物地黄Libosch.干燥块根的炮制品,具有补血滋阴、益精填髓的功效,用于血虚萎黄、肝肾阴虚等症[1]。历代本草记载了十余种熟地黄炮制方法[2-3],其中蒸制法始见于汉代《金匮要略方论》[4],酒炖法始见于明代《炮炙大法》[5],此2种方法已被《中国药典》2020年版收录为法定方法[1]。现代研究表明熟地黄中主要活性成分包括糖类、环烯醚萜苷类、苯乙醇苷类和呋喃醛衍生物等[6]。李军等[7]曾对蒸制和酒炖地黄的还原糖进行含量比较,陶益等[8]和许军等[9]曾对2种熟地黄中部分非糖类小分子成分进行含量比较。但对熟地黄中糖类组分(游离单糖、寡糖和多糖)及非糖类小分子组分(环烯醚萜苷类、苯乙醇苷类和呋喃醛衍生物等)同时进行系统比较分析,从整体角度评价酒炖和蒸制熟地黄内在质量的研究还未见报道。
近年来,代谢组学和糖组学方法已成功应用到中药炮制研究,区别于单一或几个成分为指标,通过同时表征非糖小分子组分和糖类组分,能从整体角度全面解析中药炮制化学机制[10-12]。本课题组前期曾构建基于HPLC(C18)-PDA、HPLC(NH2)- ELSD和高效凝胶渗透色谱(HPGPC)-ELSD的糖组学以及基于UPLC-QTOF-MS/MS的代谢组学方法,对生地黄和蒸制熟地黄的糖类组分和非糖小分子组分进行了比较研究,揭示了九蒸九制过程熟地黄整体质量变化规律,探讨了熟地黄炮制过程中多糖、寡糖以及小分子组分的化学转化机制,明确了地黄炮制大分子多糖与小分子呋喃醛及其糖苷类组分之间的联系[10-11]。本研究在前期工作的基础上,整合糖组和代谢组学方法,对酒炖和蒸制地黄的化学成分进行系统比较研究,为不同炮制法熟地黄的药效物质研究提供参考。
1 仪器与材料
Waters 2695高效液相色谱仪、Waters 2489紫外检测器、EmpowerTM3工作站、Waters Acquity UPLCTM液相色谱仪、Waters Synapt G2-SQ-TOF质谱仪,美国Waters公司;2000ES蒸发光散射检测器,美国Alltech公司;Milli-Q超纯水制备仪,美国Millipore公司;AT201电子分析天平,瑞士梅特勒-托利多公司;KQ-250E型超声波清洗器,昆山超声仪器有限公司。
乙腈,色谱纯,美国TEDIA公司;甲醇,色谱级,江苏汉邦科技有限公司;甲酸,质谱级,德国Sigma-Aldrich公司。1苯基-3-甲基-5-吡唑啉酮(PMP),国药集团有限公司;黄酒,批号20180914,规格500 mL,中粮绍兴酒有限公司。分析用水为Millipore超纯水;其余试剂均为分析纯。
对照品:甘露糖(质量分数99.6%,批号140651-201403)、鼠李糖(质量分数≥98%,批号111683-201502)、葡萄糖(质量分数99.8%,批号110833-201908)、半乳糖(质量分数100%,批号100226-201807)、右旋糖酐相对分子质量标准(1套,批号140637-201203)购于中国食品药品检定研究院;半乳糖醛酸(质量分数97%,批号T0034)购于上海宝曼生物科技有限公司;阿拉伯糖(质量分数99.5%,批号ASB-00001945-001)购于北京北纳创联生物技术研究院;(−)-果糖(质量分数99.5%,批号00628)、(+)-蜜二糖(质量分数99.5%,批号91016)购于德国Dr. Ehrenstorfer GmbH公司;甘露三糖(质量分数≥96%,批号17122602)购于成都普菲德生物技术有限公司;水苏糖(质量分数98%,批号LB98325)购于Sigma-Aldrich公司;5-羟甲基糠醛(5-HMF,质量分数≥98%,批号140919)、毛蕊花糖苷(质量分数≥98%,批号201006)、异毛蕊花糖苷(质量分数≥97%,批号201106)、梓醇(质量分数98%,批号20131005)和桃叶珊瑚苷(质量分数≥98%,批号201102)购于四川维克奇生物科技有限公司;益母草苷(质量分数≥98%,批号HL030494)、地黄苷D(质量分数≥98.3%,批号J0T-11004)购于成都普菲德生物技术有限公司;密力特苷(质量分数≥98%,批号HM030541)购于宝鸡市辰光生物科技有限公司。
生地黄样品(编号JSPACM-26-6)购于河南温县地黄种植户,经南京中医药大学附属中西医结合医院李松林研究员鉴定为玄参科地黄属植物地黄Libosch.的干燥块根。
2 方法
2.1 蒸制和酒炖熟地黄的制备
2.1.1 蒸制熟地黄[10]取生地黄,置蒸屉中,加适量水,按照《中国药典》2020年版附录IV0213炮制通则蒸法隔水蒸制,每次蒸6 h,取出,60 ℃干燥12 h,共蒸制6次,蒸液与地黄拌匀。取出,晾晒至约八成干时,切块(1 cm3左右),60 ℃干燥,即得。
2.1.2 酒炖熟地黄 取生地黄,置炖盅中,按照生地黄与黄酒用量比例5∶2加入黄酒拌匀,浸泡 1 h,按照《中国药典》2020年版附录IV 0213炮制通则,共隔水炖36 h,分6次进行,每次6 h。取出,晾晒至约八成干时,切块(1 cm3左右),60 ℃干燥,即得。
2.2 地黄多糖制备
精密称取蒸制/酒炖地黄样品10.0 g,加入超纯水140 mL,100 ℃煎煮提取2次,每次2 h,合并提取液,减压浓缩至50 mL,加入188 mL 95%乙醇,在4 ℃下静置12 h,3500 r/min离心(离心半径10 cm)10 min,保存上清液,备用(记录体积),沉淀用无水乙醇洗涤3次,60 ℃挥干,得蒸制/酒炖地黄多糖。
2.3 地黄糖组分表征
2.3.1 地黄多糖的重均相对分子质量(w)分布范围分析
(1)对照品溶液制备:精密称取w分别为2700、5250、9750、13 050、36 800、64 650、135 350、300 600、2 000 000的右旋糖酐对照品适量,用超纯水溶解并定容,制成质量浓度均为2.0 mg/mL的对照品溶液,0.45 μm微孔滤膜滤过后进样。
(2)供试品溶液制备:精密称取蒸制/酒炖地黄多糖各15.00 mg,分别加1 mL超纯水溶解,过0.45 μm微孔滤膜滤过后进样。
根据工程特点和要求,选用中联ZDG 360成槽机进行施工,成槽机上的纠偏装置能够对成槽质量随时监控、纠正。成槽现场图见图5。
(3)色谱条件:按课题组已建立的方法[10]进行测定,色谱柱为TSK-GEL G4000PWxL凝胶柱(300 mm×7.8 mm,10 μm),柱温35 ℃,流动相为超纯水,体积流量0.5 mL/min,进样体积20 μL,ELSD漂移管温度115 ℃,N2体积流量3.2 L/min。
(4)多糖w分布:以右旋糖苷对照品保留时间为横坐标(),w的对数值为纵坐标(lgw),得线性回归方程lgw=9.481 7-0.205 9,=0.996 3。蒸制和酒炖地黄多糖色谱图见图1,以对照品线性回归方程计算蒸制地黄多糖w分布范围为1.02×103~5.54×106,主要有4个色谱峰,w分别为2.63×106、9.33×105、5.37×105、2.57×103,根据峰面积计算其相对含量分别为5.68%、7.87%、17.05%、69.41%;酒炖地黄多糖w分布范围为1.01×103~6.98×106,主要有3个色谱峰,w分别为3.50×106、6.46×105、2.51×103,相对含量分别为1.98%、50.99%、47.03%。
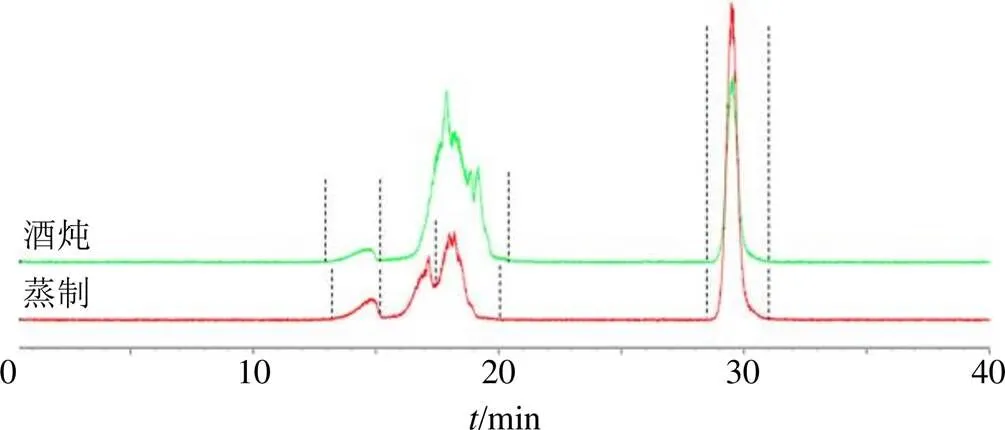
图1 蒸制和酒炖地黄多糖的HPGPC图
2.3.2 地黄多糖的单糖组成分析
(1)对照品溶液制备:取各单糖对照品适量,精密称定,分别用超纯水溶解并定容,制成甘露糖2.51 mg/mL、鼠李糖1.99 mg/mL、半乳糖醛酸2.52 mg/mL、葡萄糖2.33 mg/mL、半乳糖2.03 mg/mL、阿拉伯糖2.43 mg/mL的单一对照品溶液。精密吸取各单一对照品溶液100 μL,加入氨水溶液和0.5 mol/L PMP甲醇溶液各100 μL,混合,70 ℃反应30 min。冷却,加入100 μL冰醋酸中和溶液,再加入500 μL氯仿萃取3次,离心,上清液稀释10倍,0.45 μm微孔滤膜滤过后进样。
(2)供试品溶液制备:精密吸取“2.3.1(2)”项下蒸制/酒炖地黄多糖溶液各0.5 mL,精密加入3 mol/L三氟乙酸3 mL,封口,100 ℃水解3 h,冷却,60 ℃水浴挥干,精密加入1 mL超纯水复溶,即得蒸制/酒炖地黄多糖水解液。精密吸取多糖水解液100 μL,按上述衍生化方法处理后,即得蒸制/酒炖地黄多糖水解液衍生化样品。衍生化样品稀释10倍,0.45 μm微孔滤膜滤过后进样。
(3)色谱条件:按课题组已建立方法[10]进行测定,色谱柱为Grace AlltimaTMC18柱(250 mm×7.8 mm,5 μm),柱温35 ℃,流动相为乙腈-100 mmol/L乙酸铵水溶液,梯度洗脱:0~5 min,15%~20%乙腈;5~30 min,20%~28%乙腈;体积流量1.0 mL/min;进样量20 μL;检测波长245 nm。
(4)地黄多糖的单糖组成分析结果:通过与单糖对照品色谱图保留时间进行比较(图2),蒸制和酒炖地黄多糖均由甘露糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成。采用外标一点法计算各单糖含量,并换算成相对物质的量比分别为2.57∶0.05∶1.00∶0.87∶0.10和2.07∶0.07∶1.00∶1.05∶0.17,可见各单糖相对含量稍有差异。
2.3.3 地黄寡糖分析
(1)对照品溶液制备:取各寡糖及果糖对照品适量,精密称定,分别用60%乙腈溶解并定容,制成甘露三糖1.0 mg/mL、蔗糖1.2 mg/mL、麦芽糖1.3 mg/mL、棉籽糖1.2 mg/mL、蜜二糖1.2 mg/mL、水苏糖1.0 mg/mL、果糖1.4 mg/mL的单一对照品溶液。

A-单糖混合对照品 B-蒸制地黄多糖水解液 C-酒炖地黄多糖水解液 D-蒸制地黄游离单糖 E-酒炖地黄游离单糖 1-甘露糖 2-鼠李糖 3-半乳糖醛酸 4-葡萄糖 5-半乳糖 6-阿拉伯糖
(3)色谱条件:按课题组已建立方法[10]进行测定,色谱柱为Alltima Amino柱(250 mm×4.6 mm,5 μm);柱温35 ℃;流动相为乙腈-水(70∶30);体积流量1 mL/min;进样量20 μL;ELSD漂移管温度100 ℃;N2体积流量3.2 L/min。
(4)地黄寡糖分析结果:蒸制与酒炖地黄均含有甘露三糖、蜜二糖和水苏糖(图3),采用外标一点法计算各寡糖含量(表1),其中甘露三糖、蜜二糖含量无显著性差异,但酒炖地黄中水苏糖质量分数显著高于蒸制地黄(<0.01)。
2.3.4 地黄游离单糖分析 精密吸取“2.2”项下醇沉上清液100 μL,按“2.3.2(2)”项下方法衍生化制备供试品溶液,并采用“2.3.2”项下对照品溶液和分析方法进行表征。其中果糖为酮糖,无法进行PMP衍生化,采用“2.3.2”项下方法进行检测。结果发现,蒸制和酒炖地黄均含有葡萄糖、鼠李糖、甘露糖、半乳糖、果糖和阿拉伯糖(图2、3)。采用外标一点法计算样品中游离单糖含量。由表2可见酒炖地黄中葡萄糖(<0.01)、鼠李糖(<0.05)和甘露糖(<0.05)含量均显著低于蒸制地黄,半乳糖含量则显著高于蒸制地黄(<0.01)。

A-寡糖及果糖混合对照品 B-蒸制地黄样品 C-酒炖地黄样品 1-果糖 2-蔗糖 3-麦芽糖 4-蜜二糖 5-棉籽糖 6-甘露三糖 7-水苏糖

表1 蒸制和酒炖地黄中寡糖的含量(, n =3)
与蒸制地黄比较:**<0.01
**< 0.01RRP-S

表2 蒸制和酒炖地黄中游离单糖的含量(, n = 3)
与蒸制地黄比较:*<0.05**<0.01
*< 0.05**< 0.01RRP-S
2.4 地黄非糖小分子组分表征
2.4.1 对照品溶液制备 取梓醇、桃叶珊瑚苷、密力特苷、益母草苷、毛蕊花糖苷、异毛蕊花糖苷、5-HMF对照品适量,精密称定,用50%甲醇溶解并定容,混合,再用倍半稀释法制成含梓醇9.5 μg/mL、桃叶珊瑚苷10.0 μg/mL、密力特苷10.5 μg/mL、益母草苷10.6 μg/mL、毛蕊花糖苷10.4 μg/mL、异毛蕊花糖苷10.4 μg/mL、地黄苷D 11.6 μg/mL、5-HMF 11.8 μg/mL的混合对照品溶液。
2.4.2 供试品溶液制备 精密量取“2.2”项下上清液各5 mL,加甲醇,定容至10 mL,12 000 r/min离心(离心半径6.5 cm)10 min,取上清液,0.45 μm微孔滤膜滤过后进样。
2.4.3 UPLC-QTOF-MS/MS分析 参照课题组已建立的方法[10],采用代谢组学策略对蒸制和酒炖地黄中的差异性非糖小分子进行表征,采用选择离子模式(SIM)方法对代表性成分进行定量分析,其中5-HMF由于其弱离子化,采用UPLC-PDA检测。
(1)色谱条件:Waters Acquity HSS T3色谱柱(100 mm×2.1 mm,1.8 µm);流动相为0.1%甲酸水溶液(A)和0.1%甲酸乙腈溶液(B),梯度洗脱:0~1 min,2% B;1~2 min,2%~5% B;2~5 min,5%~12% B;5~10 min,12%~20% B;10~12 min,20%~30% B;12~13 min,30%~50% B;13~15 min,50%~100% B;15~16 min,100% B;体积流量0.4 mL/min;柱温35 ℃;进样量2 µL。5-HMF检测波长283 nm。
(2)质谱条件:采用电喷雾离子源负离子模式下的MSEcentroid采集,低碰撞能量6 eV,高碰撞能量30~60 eV,毛细管电压2.7 kV,锥孔电压35 V,离子源温度100 ℃;脱溶剂气温度500 ℃,反向锥孔气流50 L/h,脱溶剂气600 L/h,质量扫描范围/100~1500,Q-TOF采集率0.2 s,以亮氨酸脑啡肽为校正液([M−H]−/554.261 5)。
(3)定量方法学考察:将混合对照品溶液按照倍数稀释法稀释,得到12个不同质量浓度的混合对照品溶液。按上述条件分析,记录峰面积,以对照品质量浓度为横坐标(),峰面积为纵坐标(),绘制标准曲线。以信噪比为3和10时各对照品的质量浓度作为检测限和定量限。取蒸制地黄上清液3份,每份样品连续测定2次,连续3 d,各分析成分峰面积的RSD值用于评价日内和日间精密度。取已测定指标成分含量的蒸制地黄样品,分别加入一定量的对照品溶液(相当于原样品中各指标成分含量的50%、100%、150%),每个质量浓度平行制备3份用于加样回收率测定。取精密度测试的样品分别在2、4、6、8、12、24 h进样分析,以各分析物峰面积的RSD值评价稳定性。
2.4.4 数据采集与处理以及质谱数据使用 采用MassLynx 4.1软件进行采集,使用Progenesis QI v2.3软件(美国Waters公司)进行峰提取、峰匹配及归一化等处理,信息导入EZinfo 3.0软件进行主成分分析(PCA)和正交偏最小二乘判别分析(OPLS-DA)。统计学分析采用SPSS 24.0软件,组间比较采用检验,<0.05为差异有统计学意义。
2.4.5 差异性成分筛选 PCA分析结果如图4所示,模型的拟合效果和预测能力良好(2X0.986,2=0.966),酒炖和蒸制地黄可明显区分,表明其非糖小分子存在明显差异。采用OPLS-DA进行分析得S-plot图(图5),以<0.05且VIP>1筛选差异成分,并根据准分子离子峰、加和离子峰和特征碎片离子峰与对照品和文献数据比对,共鉴定出29个差异成分,其中环烯醚萜苷类成分9个,苯乙醇苷类成分10个,呋喃醛衍生物1个(图6和表3)。将鉴定出的差异成分的峰面积进行min-max标准化处理,将归一化的数据进行热图分析,结果见图7。
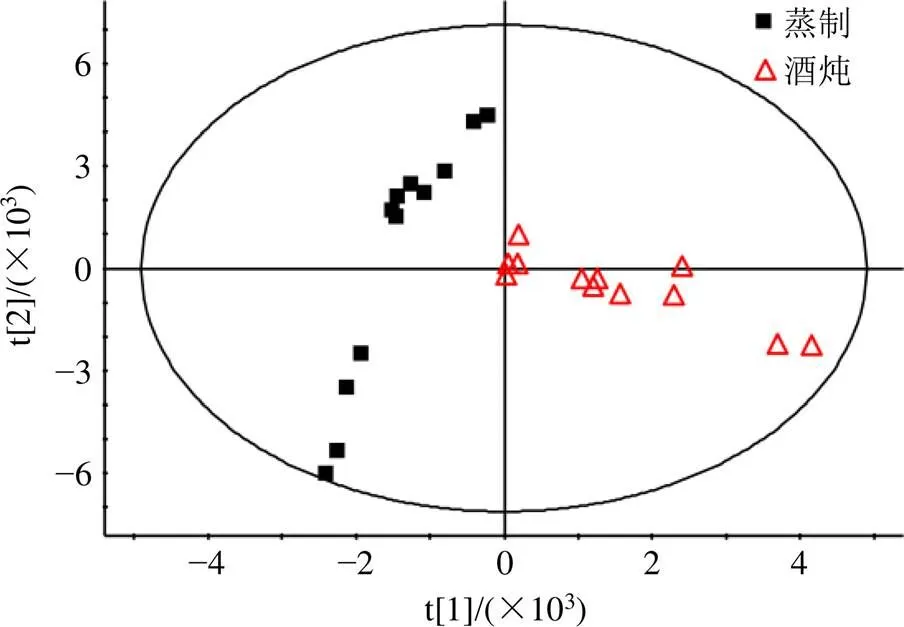
图4 蒸制和酒炖地黄的负离子模式下PCA得分图
2.4.6 代表性成分定量分析
(1)方法学验证:方法线性良好(>0.990 0,表4),灵敏度高(检测限<0.084 μg/mL,定量限<0.250 μg/mL),精密度良好(日内精密度RSD≤5.44%,日间精密度RSD≤6.60%),准确度较高(平均加样回收率为84.20%~99.87%),稳定性良好(RSD≤6.79%)(表4)。
(2)含量测定:对酒炖和蒸制地黄中主要差异性成分和某些活性成分进行定量[18-19],结果表明环烯醚萜苷类成分和呋喃醛衍生物在2种地黄中含量差异较大。酒炖地黄中梓醇含量为蒸制地黄的20.9倍,益母草苷含量为蒸制地黄的20.7倍,地黄苷D含量也较高(<0.01),但密力特苷和5-HMF则较低(<0.05,表5)。

图5 蒸制和酒炖地黄在负离子模式下的S-plot图

1-梓醇 3-地黄苷D 4-密力特苷 6-益母草苷 25-异毛蕊花糖苷 30-桃叶珊瑚苷 31-毛蕊花糖苷

表3 蒸制和酒炖地黄差异非糖小分子成分信息
3 讨论
本研究通过整合基于LC-UV/ELSD/MS的糖组学和代谢组学方法,对蒸制和酒炖地黄的糖组分和非糖小分子组分进行了比较研究,发现酒炖地黄多糖主要组分w较大(6.46×105左右),蒸制地黄多糖主要组分w较小(2.57×103左右)。与蒸制地黄相比,酒炖地黄中水苏糖含量较高,而游离单糖含量较低。酒炖地黄中梓醇和益母草苷含量分别是蒸制地黄的20.9、20.7倍,而5-HMF含量则低17%。可见,酒炖和蒸制地黄的糖类组分和非糖小分子组分均存在显著差异。
本实验及其他学者前期研究均发现,炮制过程中地黄的部分多糖发生水解反应生成寡糖,水苏糖等寡糖易分解产生甘露三糖和蜜二糖,而甘露三糖和蜜二糖会进一步分解;梓醇和益母草苷等苷类成分易水解成相应苷元;多糖、寡糖和苷类成分水解时会产生大量的还原糖,还原糖和氨基酸进一步发生美拉德反应,产生5-HMF等呋喃醛衍生物[11-12]。蒸制和酒炖熟地黄的化学成分差异,其可能原因是炮制辅料黄酒的加入影响了某些水解酶的活性,从而影响了多糖、寡糖和苷类成分的降解速度。

图7 蒸制和酒炖地黄差异成分的热图分析
梁代《本草经集注》有“得清酒良”的记载[20],认为地黄加酒炮制后具有较好的疗效。元代《汤液本草》记载地黄“熟则性寒而补肾”“假酒力则微温,大补,血衰者须用之”[21],指出了蒸制地黄和酒制地黄药性和临床作用的区别。本研究发现蒸制和酒炖熟地黄在大小分子组分上均存在显著差异,这种差异是否显著影响其药效还需要更多的生物活性模型加以验证。
近期研究发现,水苏糖作为一种功能性低聚糖,能够通过促进双歧杆菌、乳酸杆菌等有益菌的增殖,进而调节肠道微生态,发挥改善胃肠道功能、调节免疫和缓解炎症等作用[22];梓醇对血管内皮细胞、神经元细胞和肾系膜细胞有保护作用,具有抗炎、抗氧化、抗抑郁、降糖和抗肿瘤等活性[23];5-HMF具有抗氧化和抗炎活性[24]。上述几种成分在蒸制和酒炖地黄中的含量有显著差异,其与药性、药效的关联性值得深入研究。
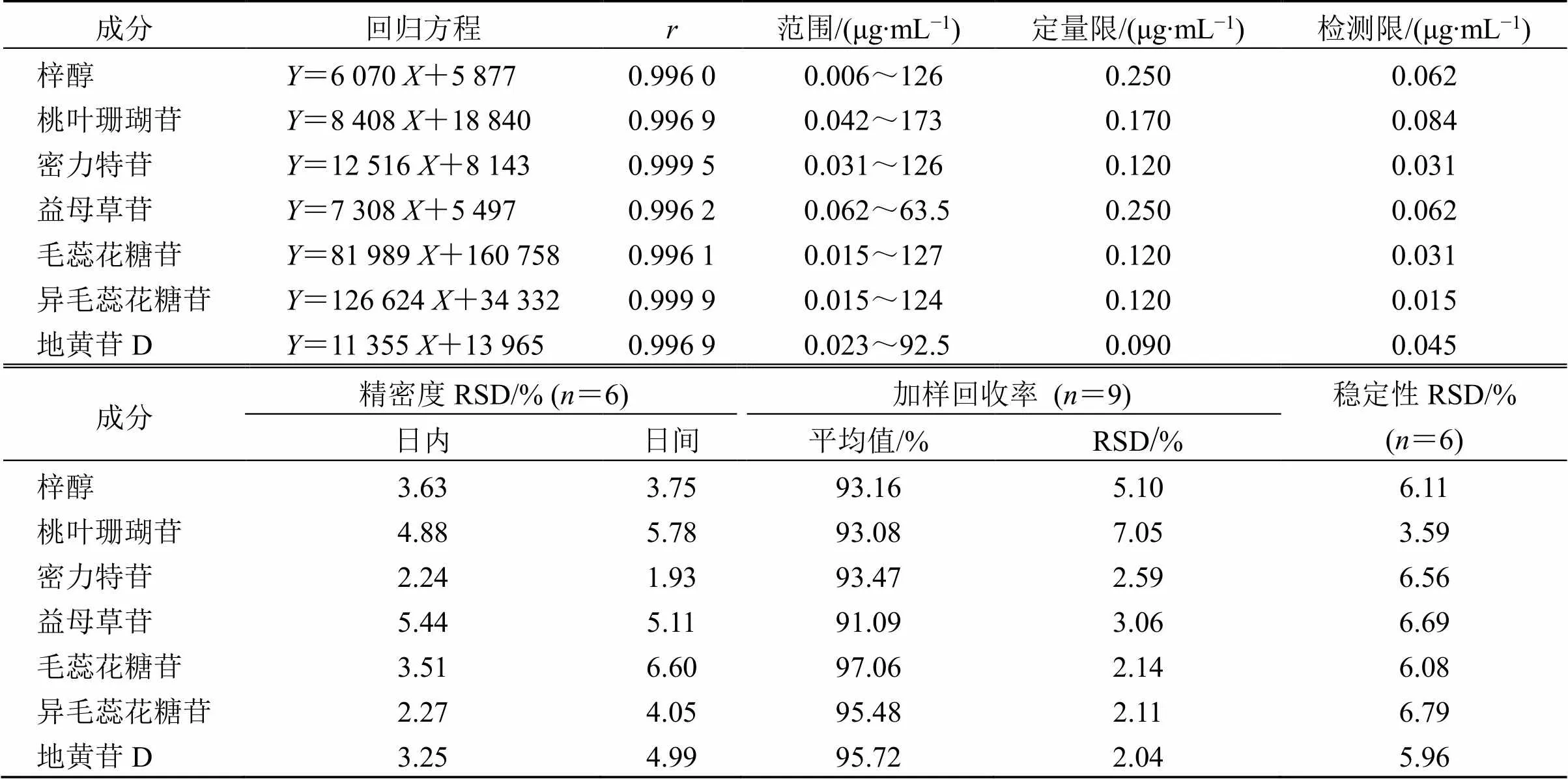
表4 UPLC-QTOF-MS/MS定量方法学验证

表5 蒸制和酒炖地黄中代表性非糖小分子成分的含量(, n = 3)
与蒸制地黄比较:*<0.05**<0.01
*< 0.05**< 0.01RRP-S
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020.
[2] 张丽萍, 李军, 张振凌, 等. 熟地黄炮制方法的历史沿革 [J]. 河南中医学院学报, 2005, 20(2): 69-71.
[3] 徐军, 傅喆暾. 地黄炮制品名历史沿革及功效考辨探讨 [J]. 中成药, 2017, 39(9): 1913-1916.
[4] (汉) 张仲景述 (晋) 王叔和集. 金匮要略方论 [M]. 北京: 人民卫生出版社, 2012: 20.
[5] (明) 缪希雍著成莉校注. 炮炙大法 [M]. 北京: 中国医药科技出版社, 2012: 9.
[6] 周丽, 徐金娣, 毛茜, 等. 地黄加工炮制研究新进展及展望 [J]. 中药材, 2016, 39(5): 1184-1190.
[7] 李军, 张丽萍, 张振凌, 等. 熟地黄清蒸和酒炖不同时间还原糖含量测定 [J]. 中成药, 2006, 28(4): 513-515.
[8] 陶益, 蒋妍慧, 唐克建, 等. 地黄炮制前后化学成分的UHPLC-Q-TOF/MS比较研究 [J]. 中药新药与临床药理, 2016, 27(1): 102-106.
[9] Xu J, Wu J, Zhu L Y,. Simultaneous determination of iridoid glycosides, phenethylalcohol glycosides and furfural derivatives inby high performance liquid chromatography coupled with triple-quadrupole mass spectrometry [J]., 2012, 135(4): 2277-2286.
[10] Zhou L, Xu J D, Zhou S S,. Integrating targeted glycomics and untargeted metabolomics to investigate the processing chemistry of herbal medicines, a case study on[J]., 2016, 1472: 74-87.
[11] Zhou L, Xu J D, Zhou S S,. Chemomics-based marker compounds mining and mimetic processing for exploring chemical mechanisms in traditional processing of herbal medicines, a continuous study on[J]., 2017, 1530: 232-240.
[12] 孟祥龙, 王勃, 胡聪, 等. 基于HPLC-MS及网络药理学探讨熟地黄炮制过程与美拉德反应的相关性 [J]. 中药材, 2020, 43(1): 61-70.
[13] Li S L, Song J Z, Qiao C F,. A novel strategy to rapidly explore potential chemical markers for the discrimination between raw and processedby UHPLC-TOFMS with multivariate statistical analysis [J]., 2010, 51(4): 812-823.
[14] 张波泳, 江振作, 王跃飞, 等. UPLC/ESI-Q-TOF MS法分析鲜地黄、生地黄、熟地黄的化学成分 [J]. 中成药, 2016, 38(5): 1104-1108.
[15] 周菲, 林美斯, 李锐, 等. 基于UPLC-Q-TOF-MS技术分析百合地黄汤的化学成分 [J]. 中国实验方剂学杂志, 2020, 26(7): 15-22.
[16] Yoshikawa M, Matsuda H, Morikawa T,. Phenylethanoid oligoglycosides and acylated oligosugars with vasorelaxant activity from[J]., 2006, 14(22): 7468-7475.
[17] 张蕾, 邹妍, 续洁琨, 等. 地黄地上部分化学成分的研究 [J]. 中国中药杂志, 2015, 40(16): 3214-3219.
[18] Potočnjak I, Marinić J, Batičić L,. Aucubin administered by either oral or parenteral route protects against cisplatin-induced acute kidney injury in mice [J]., 2020, 142: 111472.
[19] Gan L, Li X Z, Zhu M Y,. Acteoside relieves mesangial cell injury by regulating Th22 cell chemotaxis and proliferation in IgA nephropathy [J]., 2018, 40(1): 364-370.
[20] (南朝·梁) 陶弘景编尚志钧, 尚元胜辑校. 本草经集注: 辑校本[M]. 北京: 人民卫生出版社, 1994: 199.
[21] (元) 王好古著张永鹏校注.汤液本草[M]. 2版.北京: 中国医药科技出版社, 2019: 59.
[22] Liu Y, Li T, Alim A,. Regulatory effects of stachyose on colonic and hepatic inflammation, gut microbiota dysbiosis, and peripheral CD4+T cell distribution abnormality in high-fat diet-fed mice [J]., 2019, 67(42): 11665-11674.
[23] Bhattamisra S K, Yap K H, Rao V,. Multiple biological effects of an iridoid glucoside, catalpol and its underlying molecular mechanisms [J]., 2019, 10(1): E32.
[24] Kong F H, Lee B H, Wei K. 5-Hydroxymethylfurfural mitigates lipopolysaccharide-stimulated inflammation via suppression of MAPK, NF-κB and mTOR activation in RAW 264.7 cells [J]., 2019, 24(2): E275.
Integrating glycomics and metabolomics to compare chemical profiles of steaming and wine-stewing processed
ZHANG Xiao-ya1, 2, XU Jin-di2, XU Jun1, ZOU Ye-ting1, LONG Fang1, 3, LI Song-lin1, 2
1. Department of Pharmaceutical Analysis, Affiliated Hospital of Integrated Traditional Chinese and Western Medicine to Nanjing University of Chinese Medicine, Nanjing 210028, China 2. Department of Metabolomics, Jiangsu Province Academy of Traditional Chinese Medicine and Jiangsu Branch of Chinese Academy of Traditional Chinese Medicine, Nanjing 210028, China 3. Department of Respiratory Medicine, Affiliated Hospital of Integrated Traditional Chinese and Western Medicine to Nanjing University of Chinese Medicine, Nanjing 210028, China
To compare the chemical profiles of Shudihuang (, RRP) processed by steaming (RRP-S) and wine-stewing (RRP-W) documented in China Pharmacopeia.HPLC-PDA, HPLC-ELSD and HPGPC-ELSD based glycomics and UPLC-QTOF-MS/MS based metabolomics were integrated to compare the glycome (polysaccharides, oligosaccharides and free monosaccharides) and metabolome (non-sugar small molecules) respectively in RRP-S and RRP-W.Compared with RRP-S, the molecular weight range of polysaccharides in RRP-W was broader, and the proportion of larger molecular weight polysaccharides was higher. Both the polysaccharides in RRP-S and RRP-W were composed of mannose, galacturonic acid, glucose, galactose and arabinose, but with different molar ratios (2.57:0.05:1.00:0.87:0.102.07:0.07:1.00:1.05:0.17). Oligosaccharides stachyose, manninotriose and melibiose were detectable in both RRP-S and RRP-W with the content of stachyose significantly higher in RRP-W than that in RRP-S (< 0.01). Free monosaccharides glucose, fructose, rhamnose, mannose, galactose and arabinose were detected in both RRP-S and RRP-W, with the contents of glucose (< 0.01), rhamnose (< 0.05) and mannose (< 0.05) significantly lower, whereas galactose higher (< 0.05) respectively, in RRP-W than that in RRP-S. A total of 29 non-sugar small molecules with significant abundance difference between RRP-W and RRP-S were identified or tentatively assigned, the chemical types of which belonged to iridoid glycosides, phenylethanoid glycosides and furfural derivative. The quantitative determination of the representative non-sugar small molecules showed that the contents of catalpol, leonuride and rehmannioside D were higher in RRP-W (< 0.01), whereas melittoside (< 0.05) and 5-hydroxymethylfurfural (5-HMF,< 0.01) were lower in RRP-W, than that in RRP-S.There is significant difference in intrinsic quality between RRP-S and RRP-W, and whether the quality variations could obviously affect the bioactivities of RRP-S and RRP-W deserves further investigation.
; steaming; wine-stewing; glycomics; metabolomics; HPLC; HPGPC; UPLC-QTOF-MS/ MS; polysaccharide; oligosaccharides; free monosaccharide; mannose; galactouronic acid; glucose; galactose; arabinose; stachyose; mannotriose; melibiose; fructose; rhamnose; iridoid glycosides; phenylethanoid glycosides; furan aldehyde derivatives; catalpol; leonuride; rehmannioside D; melittoside; 5-hydroxymethylfurfural
R283.6
A
0253 - 2670(2021)06 - 1591 - 10
10.7501/j.issn.0253-2670.2021.06.006
2020-10-13
国家自然科学基金项目(81872975);国家自然科学基金项目(81603262);江苏省中医药研究院自主科研项目(BM2018024-2019001)
张晓亚,女,硕士研究生,研究方向为中药质量控制。E-mail: zxy11162020@163.com
李松林,研究员,主要从事中药药效物质基础、质量控制和新产品研发。E-mail: songlinli64@126.com
龙 芳,副研究员,主要从事中药药效物质基础和质量控制研究。E-mail: longfangcpu@163.com
[责任编辑 郑礼胜]
