花生壳乙酸乙酯萃取物对金黄色葡萄球菌抗菌作用及机理
2021-03-16戚馨月汪海峰周建新
曹 瑶 戚馨月 汪海峰 周建新
(南京财经大学食品科学与工程学院;江苏省现代粮食流通与安全协同创新中心;江苏高校粮油质量安全控制及深加工重点实验室,南京 210023)
花生是世界上重要的油料作物[1],全球每年花生果产量超过4 200万t,壳产量约1 800万t[2]。花生壳是花生产业的一种丰富而廉价的副产品,除少量被制成饲料,大多数被用作取暖和烹饪的燃料或者被当作废物丢弃,导致资源损失和环境污染[3]。研究表明,花生壳中富含黄酮类化合物,如木犀草素、圣草酚,5,7-二羟色原酮等[4],作为植物的次生代谢产物,在预防和管理现代疾病如艾滋病[5]、癌症[6]、炎症[7]和肥胖[8]发挥重要作用。QIU等[9]采用HPLC-DAD-TOF/MS法对花生壳中的成分进行鉴别,在花生壳的甲醇提取物中发现了3种化合物,分别为5,7-二羟基色原酮、圣草酚和木犀草素,含量分别为0.59、0.92、2.36 mg/g。左爱学等[10]从花生壳乙醇提取物中分离出12种化合物,分别鉴定为木犀草素、香叶木素、圣草酚、5,7-二羟基色原酮、大风子素、5,7,3’,4’-tetrahydroxy-8-prenylflavone、5,7,3’-trihydroxy-4’-methoxy-8prenylflavone、racemoflavone、5-羟基-色原酮-7-O-β-D-葡萄糖苷、阿魏酸、谷甾醇、胡萝卜苷。YU等[11]和CAMARGO等[12]发现花生壳提取物能够抑制细菌的生长。戚馨月等[13]采用不同极性的有机溶剂分级提取,发现花生壳分级提取物对不同供试菌均有一定的抑制作用,其中乙酸乙酯提取物对金黄色葡萄球菌的抑制作用最强。QIAN等[14]发现木犀草素可以破坏金黄色葡萄球菌细胞膜的完整性,对细菌生物膜的形成具有较强的抑制作用。HE等[15]研究中发现圣草酚对编码金黄色葡萄球菌外分泌蛋白Hla的基因hla表达和转录有明显的抑制作用。然而,花生壳提取物的抗菌机理鲜见报道。食源性疾病仍然是世界范围内一个主要的公共卫生问题,其主要原因是食用了细菌、病毒和寄生虫等病原微生物污染的食品[16]。金黄色葡萄球菌,一种常见的食源性致病菌,进入人体可引起许多急慢性感染[17]。本研究以金黄色葡萄球菌ATCC 6538为指示菌,分析花生壳提取物对其抗菌作用和机理,为开发食品天然防腐剂提供参考。
1 材料与方法
1.1 指示菌及预处理
金黄色葡萄球菌ATCC 6538购于江苏省疾病预防控制中心。将ATCC 6538接种于新鲜的胰蛋白胨大豆肉汤(TSB)中,培养至对数期后按2%转接至新鲜TSB中,于(36±1) ℃,120 r/min 恒温摇床振荡培养18 h至生长对数后期,菌液经12 000 r/min离心5 min,弃去上清液,使用无菌1×磷酸缓冲溶液(PBS)洗涤菌体沉淀,重复洗涤两次后,使用一定量1×PBS重悬,调整菌液浓度为109CFU·mL-1,备用。
1.2 培养基与试剂
胰蛋白胨大豆琼脂培养基(TSA)、TSB;氯化钠、石油醚、乙酸乙酯、正丁醇、二甲基亚砜(DMSO),以上均为分析纯;1×PBS、碘化丙啶(PI)、5(6)-羧基二乙酸荧光素(5(6)-cFDA)。
1.3 花生壳提取物的制备
花生壳洗净后55 ℃烘干,用高速粉碎机磨碎成粉,过50目筛。准确称取5 kg花生壳粉用50 L 90%乙醇提取3次,每次3 h,合并提取液。减压浓缩至无乙醇味,浓缩液加水稀释至含生药量0.25 g/mL,共20 L。依次用等体积石油醚、乙酸乙酯、正丁醇萃取三次,合并相同溶剂萃取液,减压浓缩,得到石油醚萃取部位浸膏51.56 g,乙酸乙酯萃取部位浸膏144.63 g,正丁醇萃取部位浸膏22.69 g,均置于-20 ℃冰箱备用。
1.4 仪器与设备
FW100型高速粉碎机,RE-2000型旋转蒸发仪,LDZX-50FBS型立式压力蒸汽灭菌器,酶标仪,转盘式激光共聚焦显微镜,扫描电子显微镜等。
1.5 方法
1.5.1 花生壳各萃取部位对ATCC 6538抗菌活性的测定
参照郑东超等[18]方法,用DMSO复溶石油醚、乙酸乙酯及正丁醇萃取部位浸膏,配制成51.2 mg/mL的母液,各取1 mL将灭菌后直径为6 mm的滤纸片浸泡于其中4 h,取出沥干,以DMSO为对照。取1.1节中菌悬液均匀涂布于TSA平板上,将上述滤纸片平铺于培养皿中。置于(36±1) ℃条件下培养24 h,按十字交叉法测量抑菌圈直径。
1.5.2 乙酸乙酯萃取物对ATCC 6538抗菌作用的测定
1.5.2.1 MIC和MBC的测定
参照YE等[19]方法,取200 μL无菌TSB加入96孔细胞培养板中,再加入200 μL乙酸乙酯萃取物母液倍比稀释,使其浓度分别为25.6、12.8、6.4、3.2、1.6、0.8、0.4、0.2 mg/mL,取1.1中菌悬液4 μL接种至96孔板中,以相同体积无菌水为空白对照,(36±1) ℃条件下培养24 h,测定OD600 nm。以OD600 nm无变化的最低浓度为MIC。将OD600 nm无变化的菌悬液在TSA平板上涂布,菌落数少于5个的最低浓度为MBC。
1.5.2.2 生长曲线及生长动力模型的建立
参照SILVA-ANGULO等[20]方法,取1.1节中菌悬液以2%转接至新鲜的TSB中培养至稳定期,用无菌TSB调整菌液为104CFU·mL-1,再按1%分别转接于新鲜的TSB中,向其中加入乙酸乙酯萃取物使其终浓度为1/4 MIC、1/2 MIC、MIC,以添加相同体积的TSB作为空白对照。置于(36±1) ℃培养,每隔2 h取样在TSA平板上涂布,(36±1) ℃培养24 h后进行菌落计数。
选择Baranyi模型来拟合其生长状况,并表征菌株的生长参数。见式(1):
(1)
式中:y(t)为t时刻菌浓度的对数;y0为初始菌浓度(t=0)的对数;ymax为最大菌浓度的对数;μmax为最大比生长速率;A(t)为调整方程,见式(2)、式(3)。
(2)
y0=μmax×λ
(3)
式中:t为培养时间;v为菌体在生长过程中的增长速率;λ为迟滞时间。
1.5.2.3 致死曲线的建立
参照王虹懿等[21]方法,取1.1节中菌悬液调整至107CFU·mL-1,加入乙酸乙酯萃取物溶液使其最终浓度为MIC、2 MIC及4 MIC,以相同体积1×PBS作为空白对照,置于(36±1) ℃静置培养,每隔2 h取样,在TSA平板上涂布,(36±1) ℃培养24 h后进行菌落计数。
1.5.3 乙酸乙酯萃取物对ATCC 6538抗菌机理的研究
1.5.3.1 细胞形态的观察
参照赵梓雯[22]方法,取1.1中菌悬液调整至107CFU·mL-1,加入乙酸乙酯萃取物溶液使其最终浓度为MIC、2 MIC、4MIC、6 MIC和MBC,以相同体积1×PBS作为空白对照,置于(36±1) ℃培养4 h。10 000 r/min离心10 min,1×PBS洗涤2次,除净上清液,在室温下用2.5%的戊二醛固定3 h。10 000 r/min离心5 min,1×PBS洗涤2次,除净上清液,将样品依次用30%、50%、70%、80%、90%、95%、100%的乙醇溶液对样品进行洗脱,每次10 min。洗脱结束将样品固定在镜片上,置于镀金仪中真空喷金90 s,拍照。扫描电镜使用的电压为10 kV,放大倍数为20 000倍。
1.5.3.2 细胞膜通透性的观察
参照周祺等[23]和刘国荣等[24]方法,按照上述1.5.3.1中方法制备样品后,10 000 r/min离心10 min,用1×PBS重悬,向每个样品中加入5(6)-cFDA至终浓度达到2.5 μmol/L,避光反应10 min;然后加入PI使其终浓度为0.5 μmol/L,避光反应10 min。取5 μL菌液转接到载玻片上,加上盖玻片,置于激光共聚焦显微镜下观察。激光共聚焦显微镜放大倍数为40倍空气镜,标尺为110 μm。
1.6 数据处理与分析
每个实验重复3 次。实验结果使用Origin8.5 软件制图,SPSS 22进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 花生壳各萃取物部位对ATCC 6538的抑菌圈直径
乙酸乙酯萃取部位有明显的抑菌圈,直径为(9.54±0.78) mm,石油醚萃取部位、正丁醇萃取部位及DMSO对照组均无抑菌圈。证明花生壳中抗菌活性物质存在于乙酸乙酯萃取部位及该试剂可作为配制母液的溶剂。
2.2 乙酸乙酯萃取物对金黄色葡萄球菌ATCC 6538的抗菌作用
2.2.1 MIC和MBC
当乙酸乙酯萃取物样品浓度大于或等于0.80 mg/mL时,样品菌悬液OD600 nm无变化,由此确定MIC为0.80 mg/mL;当浓度大于或等于6.40 mg/mL时,在TSA平板上菌落数均小于5,因此确定MBC为6.40 mg/mL。
2.2.2 生长曲线及生长动力模型
Baranyi模型特别适用于有延滞、对数、稳定三个阶段的生长曲线,其既表达了微生物生长量与时间的关系,也较为准确地评估微生物的迟滞时间(λ)、最大比生长速率(μmax)及最大生长量(ymax)等生长参数[25]。ATCC 6538经不同浓度乙酸乙酯萃取物作用下在TSB中生长的Baranyi模型曲线如图1所示。
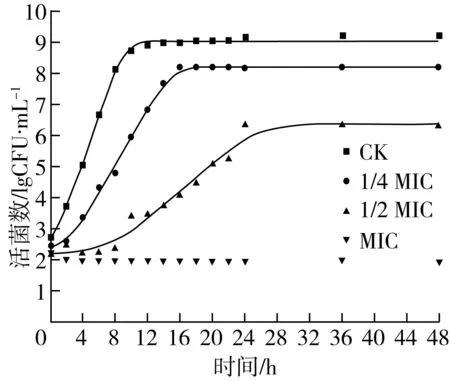
注:—表示ATCC 6538在TSB中的Baranyi模型生长曲线。图1 ATCC 6538在含有不同浓度乙酸乙酯萃取物的TSB中的生长曲线
由图1可知,除浓度为MIC外,ATCC 6538在其他几种浓度的乙酸乙酯萃取物中的生长量实测值皆比较均匀地分布于生长曲线的两侧。各拟合方程R2均大于0.97,说明利用Baranyi模型能很好地拟合指示菌的生长状况并表征其生长参数,ATCC 6538的生长参数统计如表1所示。
细菌的生长繁殖一般分为4个时期:延滞期、对数期、稳定期和衰亡期[26]。由表1可知,在空白对照组和实验组中,指示菌菌体初始浓度y0在2.317 0 ~2.755 0 lg CFU·mL-1之间,彼此相差小于1 lg CFU·mL-1。当菌体生长达到稳定期后,空白组与实验组之间的最大生长量ymax差异显著(P<0.05),对照组ymax为9.037 5 lg CFU·mL-1,浓度为1/2 MIC的ymax为6.474 3 lg CFU·mL-1,彼此相差接近3 lg CFU·mL-1,表明乙酸乙酯萃取物能够抑制ATCC 6538生长,浓度越大抑制越明显。添加乙酸乙酯萃取物的TSB中ATCC 6538的迟滞时间显著(P<0.05)大于其在不含有萃取物的TSB中的数值,且呈现浓度依赖性。在乙酸乙酯萃取物作用后,ATCC 6538的最大比生长速率显著减小(P<0.05)。

表1 ATCC 6538在含不同浓度乙酸乙酯萃取物的TSB中的生长动力学参数
2.2.3 致死曲线
ATCC6538经不同浓度乙酸乙酯萃取物作用下在1×PBS中的致死曲线如图2所示。
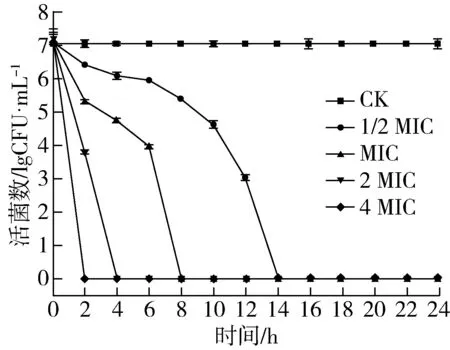
图2 ATCC 6538在不同浓度乙酸乙酯萃取物中的致死曲线
由图2可知,不同浓度乙酸乙酯萃取物对其均有杀菌作用,添加乙酸乙酯萃取物的1×PBS中ATCC 6538的活菌数变化显著(P<0.05)大于其在不含有萃取物的1×PBS中的数值。当添加乙酸乙酯萃取物浓度为1/2 MIC时,作用14 h后活菌数下降至0;当添加乙酸乙酯萃取物浓度为MIC时,作用8 h后活菌数下降至0;当添加乙酸乙酯萃取物浓度为4 MIC时,作用2 h后活菌数下降至0,与空白对照组相比显著缩短(P<0.05)。
2.3 乙酸乙酯萃取物对ATCC 6538的抗菌机理
2.3.1 细胞形态的观察
ATCC6538经过乙酸乙酯萃取物作用培养至稳定期在扫描电子显微镜下的菌体形态如图3所示。

图3 经不同浓度乙酸乙酯萃取物处理的ATCC 6538扫描电子显微镜照片
由图3可知,空白对照组(图3a)指示菌细胞圆润饱满、外形规则且表面光滑。MIC处理组(图3b)少量细胞表面出现粗糙,2 MIC处理组(图3c)细胞表面出现粗糙且少量外形皱缩,4 MIC处理组(图3d)细胞之间开始出现黏连状态,6 MIC处理组(图3e)少量细胞出现干瘪,MBC处理组(图3f)大量细胞出现干瘪。可以看出乙酸乙酯萃取物能够使指示菌细胞生长时的形态发生变化,且随着乙酸乙酯萃取物浓度的增加,细胞发生的变化越明显。说明乙酸乙酯萃取物能够导致裂解指示菌细胞壁,使胞内物质流出。
2.3.2 细胞膜通透性的观察
通过激光共聚焦显微镜观察的经乙酸乙酯萃取物作用的ATCC 6538菌体细胞膜通透性如图4所示。
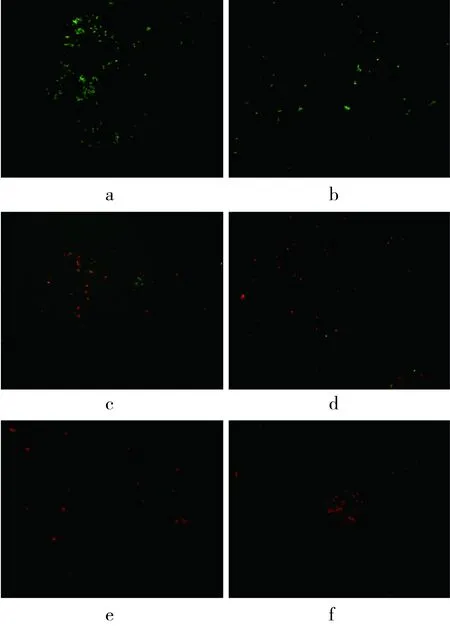
注:a CK;b MIC;c 2 MIC;d 4 MIC;e 6 MIC;f MBC,放大倍数为40。图4 经不同浓度乙酸乙酯萃取物处理的ATCC 6538激光共聚焦照片
经过两种核酸荧光探针5(6)-cFDA和PI染色后,可区分完整细胞膜和膜受损的菌体细胞。如图4所示,空白对照组(图4a)和MIC处理组(图4b)的大部分菌体呈绿色荧光,2 MIC处理组(图4c)大部分菌体细胞呈中间态橙黄色荧光,4 MIC处理组(图4d)、6 MIC处理组(图4e)和MBC处理组(图4f)绝大多数细胞呈红色荧光且红色荧光。以上表明,在未经过乙酸乙酯萃取物作用和低浓度作用的菌体细胞中大多数细胞的细胞膜完整,细胞主要显示为绿色荧光;随着作用浓度的增大,PI逐渐进入细胞与5(6)-cFDA竞争取代结合位点,荧光颜色由绿色转变为橙黄色或红色,细胞膜受损程度增加。
3 讨论
本研究首先通过滤纸片法研究了花生壳石油醚萃取物、乙酸乙酯萃取物及正丁醇萃取物对ATCC 6538的抗菌活性,发现其中主要抗菌成分在乙酸乙酯萃取部位。推测是因为乙酸乙酯萃取物成分主要是黄酮类物质,近年来研究报道表明花生壳提取物具有良好的抗菌活性,其主要活性物质为黄酮类物质[27]。
其次研究了乙酸乙酯萃取物对ATCC 6538的抗菌作用,确定其MIC为0.80 mg/mL,MBC为6.40 mg/mL。根据MIC和MBC浓度从指示菌的生长和致死2个角度探讨了不同浓度对指示菌的抗菌作用,发现萃取物使指示菌延滞期变长,最大比生长速率降低且最大菌落数减少。这与已报道的花生肽亚铁螯合物能够使金黄色葡萄球菌生长缓慢且衰亡期提前报道相似[28]。
此外,从细胞形态和细胞膜的完整性2个角度分别探讨了乙酸乙酯萃取物对ATCC 6538的抗菌机理。通过扫描电镜检测指示菌的细胞形态,发现萃取物作用后菌体细胞形态明显被破坏,随着浓度增大细胞形态出现皱缩干瘪,细胞壁破裂,胞内物质流出。这也与已报道的野艾蒿提取物可破坏金黄色葡萄球菌细胞壁的抑制作用相似[29]。结合共聚焦显微镜的观察结果,发现萃取物作用的菌体细胞红色荧光强度增大,造成指示菌的细胞膜损伤,使指示菌细胞膜形成孔洞,导致细胞膜通透性增加,有研究表明,木犀草素可以破坏金黄色葡萄球菌细胞膜的完整性[14]。利用花生壳提取物作用于常见的食源性致病菌,高效的控制微生物的生长繁殖。
4 结论
花生壳提取物对金黄色葡萄球菌ATCC 6538具有良好的抑制作用,其中主要抗菌成分在乙酸乙酯萃取部位,能够导致指示菌延滞期变长,最大比生长速率降低,并且通过破坏指示菌的细胞壁和增加细胞膜的通透性,最终表现出抗菌作用。本研究为开发利用花生壳等其他天然植物提取天然防腐剂提供了参考。
