小米粥油制备及抑菌和吸附内毒素作用的研究
2021-03-16陈树俊
陈树俊 郭 琪 杨 宝
(山西大学生命科学学院1,太原 030006) (太原市食品药品检验所2,太原 030006)
大米或小米熬粥时,表面上会凝聚一层黏稠米汤,营养学称其为“米油”[1],小米熬制的也叫“小米粥油”。小米熬粥后,米汤中占有大部分营养,尤以粥油中最为丰富[2]。细菌是引起小儿感染性腹泻的因素之一,如致病克雷伯菌、沙门菌、志贺菌等[1];还有内毒素性腹泻,内毒素主要作用于肠道,影响肠细胞代谢,降低肠细胞氧利用率,导致屏障细胞坏死脱落,肠豁膜通透性增加,引发内毒素易位、血症,继而反馈性使细菌进入形成肠源性感染[3,4]。多项研究表明,米油在治疗腹泻方面有很好疗效[5-7],郑向华等[8]研究米汤的保健功能,发现米汤加盐可以减少水和电解质大量流失,从而治疗急性腹泻引起的脱水症状。其含有较多的ω-3多不饱和脂肪酸可以降低细胞炎症及免疫反应[9],小米油脂中80%以上为不饱和脂肪酸[10]。因此,通常称米油为“天然抗生素”[11]。如今,食疗性缓解小儿腹泻的报道较少,而小米粥油良好的口感相比传统药物更利于患儿接受,制备辅助治疗小儿腹泻食品具有重要意义。
目前对米油的报道较少,杨军红等[1]利用大米油进行抑菌实验和吸附内毒素实验,有显著效果,并且发现米油对实验性大鼠肠屏障损伤有修复作用[11]。有研究报道,对危重症、急性腹泻、炎症性肠病、外科术后启动肠道功能的患者早期给予大米米油对症支持,收到了良好效果[8]。山西是我国优质小米产地,小米量大质优[12],小米粥油含有高浓度淀粉、丰富的水溶性蛋白质、大量游离氨基酸,小分子肽,维生素,纤维素[1]。为了进一步验证小米粥油的功能特性,本研究对小米粥油进行制备并以抑菌圈大小作为评价指标进行工艺优化,采用真空冷冻干燥技术制备小米粥油粉,利用小米粥油进行抑菌实验,并探索其抑菌机理;利用小米粥油粉进行吸附细菌内毒素实验,为开发利用小米粥油提供科学依据。
1 材料与仪器
1.1 材料与试剂
东方亮一级小米;金黄色葡萄球菌、伤寒沙门氏标准菌株、大肠埃希标准菌株、痢疾志贺标准菌株、肺炎克雷伯标准菌株(太原市食品药品检验所提供);其他试剂均为分析纯。
1.2 仪器与设备
ACS-15型电子台秤;PYX-DHS-50X65-S-Ⅱ隔热式电热恒温培养箱;JXZDYR-8粉碎机;TFDS25真空冷冻干燥成套设备;UV-5100型紫外可见分光光度计。
2 实验方法
2.1 小米粥油制备
小米→清洗→浸泡→熬煮→趁热过滤→静止放冷→成品
选取新鲜小米,在粉碎机中研磨2次,每次10 s,加水浸泡,以一定料液比熬煮,熬煮结束后用80目筛过滤并冷却到常温,即为小米粥油。
2.1.1 制备小米粥油工艺优化
通过肺炎克雷伯菌抑菌圈大小,考察浸泡时间(0、30、60、80、100 min),料液比(1∶10、1∶15、1∶20、1∶25、1∶30),煮粥时间(20、25、30、35、38 min)三因素对小米粥油抑菌性的影响,设计单因素、正交实验。
2.2 小米粥油粉制备
最佳工艺条件制作出小米粥油,静止放冷,在-47 ℃冰箱中冷冻12 h,置于真空冷冻干燥机中干燥,结束后将成品快速粉碎,过80目筛,密封备用。
2.3 抑菌实验
2.3.1 菌株活化和制备菌悬液
将5种供试菌种接种至平板,36 ℃培养16 h,培养出菌落后,配成浓度为104~105CFU/mL的菌悬液。
2.3.2 抑菌实验
将1 μL待测菌悬液均匀涂布于平板中,取2个牛津杯对称放置其中,放入料液比为1∶20的小米粥油。36 ℃培养16 h后,测量抑菌圈直径大小,观察小米粥油对各菌种的抑制效果。
2.3.3 最低抑菌浓度(MIC)的测定
小米粥油制备料液比为1∶15、1∶20、1∶25、1∶30、1∶35的样品。
取5 mL样品于10 mL培养基中,摇匀后倒平板,取100 μL菌悬液,均匀涂布于平板,36 ℃培养16 h,以培养皿中第1个出现单菌落平板的抑菌剂浓度为MIC[13],不加小米粥油的平板为空白对照。
2.3.4 小米粥油对菌体生长曲线的影响
参照文献[14]。取小米粥油MIC的样液,按照体积比菌悬液:样液为1∶50加入液体培养基中。每种菌的处理时间为24 h,分别在600 nm处每隔2 h测定OD值。以小米粥油MIC为对照组并记录其吸光值。
2.3.5 核酸含量的测定
参照文献[15],取1 000 μL对数生长期菌液,离心后收集,用生理盐水冲洗3次,再加入1 000μL生理盐水,加入料液比为1:20的小米粥油100 μL,在培养箱中36 ℃培养3 h后,离心,测定上清液在260 nm波长处吸光度值,对照组不加小米粥油,只加菌液与生理盐水作为空白对照。
2.3.6 电导率的测定
将供试菌种接种于液体培养基中,37 ℃恒温震荡培养至对数生长期,离心,收集菌体,生理盐水清洗3次,离心,置于生理盐水中,加入1 MIC小米粥油,对照组用生理盐水进行校正,放于37 ℃摇床中培养6 h,每隔1 h取出测电导率[16]。
2.4 小米粥油粉吸附内毒素实验
采用鲎试剂显色基质法进行小米粥油粉的内毒素测试[17,18]。制备内毒素标准曲线,阴性对照为检查用水。
将小米粥油粉去除内毒素[1]。加1.0 mL检查用水,使小米粥油粉质量分数分别为0.5%、1.0%、1.5%、2.0%。剧烈振荡6 min,离心,取上清液,测吸光度值。在1 mL检查用水中溶解内毒素标准品(5 EU/支),用旋涡混合器将溶液混合5 min。用检查用水将其稀释为0.75 EU/mL。试管中加入1.2 mL内毒素溶液并测定液体吸光值,即可得到吸附前内毒素含量。再加入小米粥油粉使其质数分数分别为0.5%、1.0%、1.5%、2.0%,剧烈振荡6 min,离心,取上清液,测定吸光值,并减去阴性对照,即可得吸附后的内毒素含量。
内毒素吸附率的计算公式:
吸附率=
2.5 数据统计分析
3 结果与讨论
3.1 制备小米粥油工艺优化实验结果
3.1.1 单因素实验结果
由图1可以看出,随着时间的增加,浸泡时间与熬煮时间对抑菌圈的直径先增大后减小,因为小米经过水浸泡之后,小米表皮变软,小米中的淀粉分子被释放,充分水化的淀粉颗粒可以提升整体凝胶网络体系的胶着性和黏度[19],且营养成分被大量溶出;在熬煮25 min之前,由于湿热作用,淀粉分子剧烈膨胀、作用力减小、结构逐渐破坏[20-21],使得小米中营养物质快速被释放出来,所以小米粥油的抑制作用加强。浸泡时间超过60 min、熬煮时间超过25 min后抑菌圈减小,这可能是因为过长时间的浸泡会是的小米中的固形物大量受到损害[22],使得营养物质受到损失,抑菌性下降;熬煮时间超过25 min之后,由于加热时间越来越长,营养物质被受到破坏,抑菌作用也逐渐减弱。随着料液比的增加,抑菌圈大小呈明显下降趋势,这是因为随着料液比的增加,小米粥油浓度下降,抑菌作用也随着下降,浓度过大时,小米粥油浓度过于稠密几乎难以过滤,水分大部分蒸发,考虑到实际工艺条件,选择料液比1∶15、1∶20、1∶25(g/mL),浸泡时间30、60、80 min,熬煮时间20、25、30 min进行正交试验研究。

图1 各因素对抑菌圈的影响
3.1.2 正交试验结果
为确定最佳小米粥油制备工艺条件,选择浸泡时间、料液比、熬煮时间3个因素,以抑菌圈直径大小为评价指标进行正交实验。
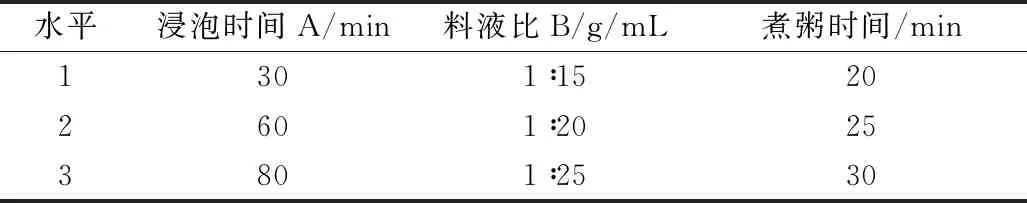
表1 制备小米粥油实验因素与水平
由表2可知,影响抑菌性因素强弱顺序:料液比>熬煮时间>浸泡时间,小米粥油制备最佳工艺条件为:浸泡时间30 min,料液比1∶20,熬煮时间25 min,结果与单因素实验略有差异。进行3次重复试验,得到的抑菌圈直径大小为(10.1±0.11) mm
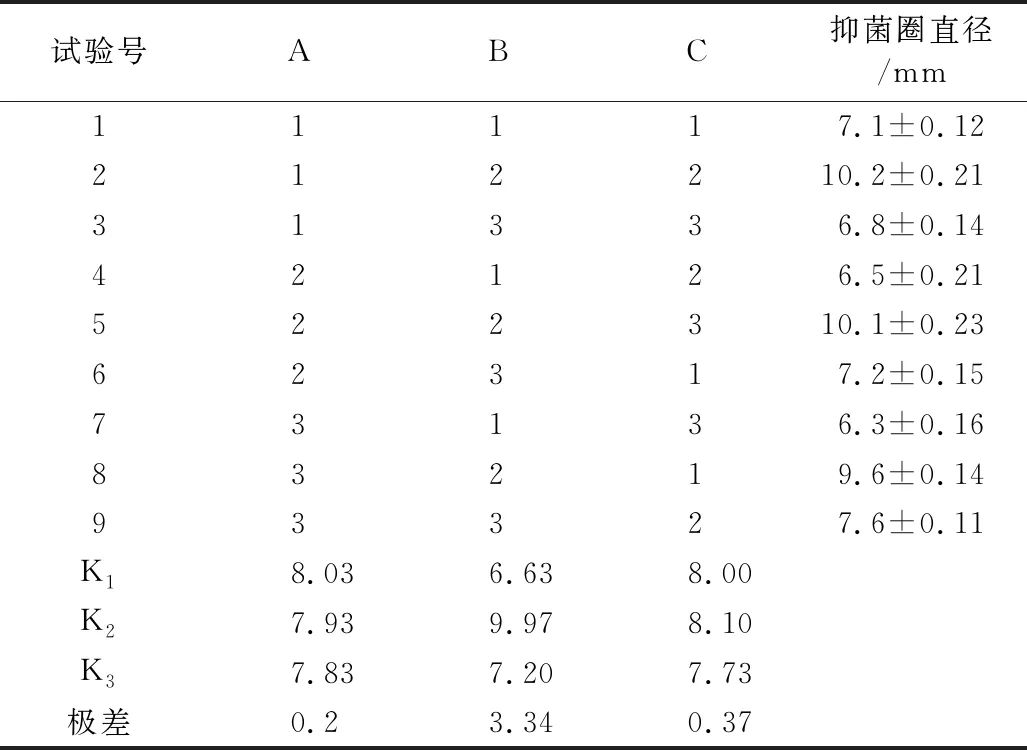
表2 正交实验结果
3.2 抑菌实验结果
3.2.1 小米粥油抑菌作用及最低抑菌浓度的测定。
根据3.1制备出小米粥油测定其抑菌作用,金黄色葡萄球菌、痢疾志贺菌、肺炎克雷伯菌出现明显抑菌圈,说明小米粥油对金黄色葡萄球菌、痢疾志贺菌和肺炎克雷伯菌有抑制作用,其他供试菌种抑菌作用不明显。表3小米粥油MIC测定结果中,实验组与对照组相比,对照组菌落总数显著多于实验组(P<0.05),3种供试菌种均在料液比为1∶20制备的小米粥油开始出现菌落,可知小米粥油对这3种供试菌种最小抑制浓度(MIC)即料液比均为1∶20。
根据实验结果表明,设置的最低样品浓度(料液比1∶35)与对照组相比较,金黄色葡萄球菌降低了大约60%,痢疾志贺菌降低了大约40%,肺炎克雷伯菌降低了大约58%;所以小米粥油对菌种的抑制顺序为:金黄色葡萄球菌>肺炎克雷伯菌>疾痢志贺菌。

表3 小米粥油最低抑菌浓度结果
3.2.2 对菌体生长曲线的影响
从图2~图4可看出,对照组供试菌种生长曲线均呈现典型的S型,细菌生长稳定,均有对数生长期和稳定生长期。而加入小米粥油后,3种供试菌生长速率显著减缓,延滞期明显增加,对数增长期延后。最大生物量与对照组相比也明显降低,基本在17 h后进入稳定期,生长曲线趋于平缓,由此可见小米粥油对供试菌种的生长繁殖有抑制作用。
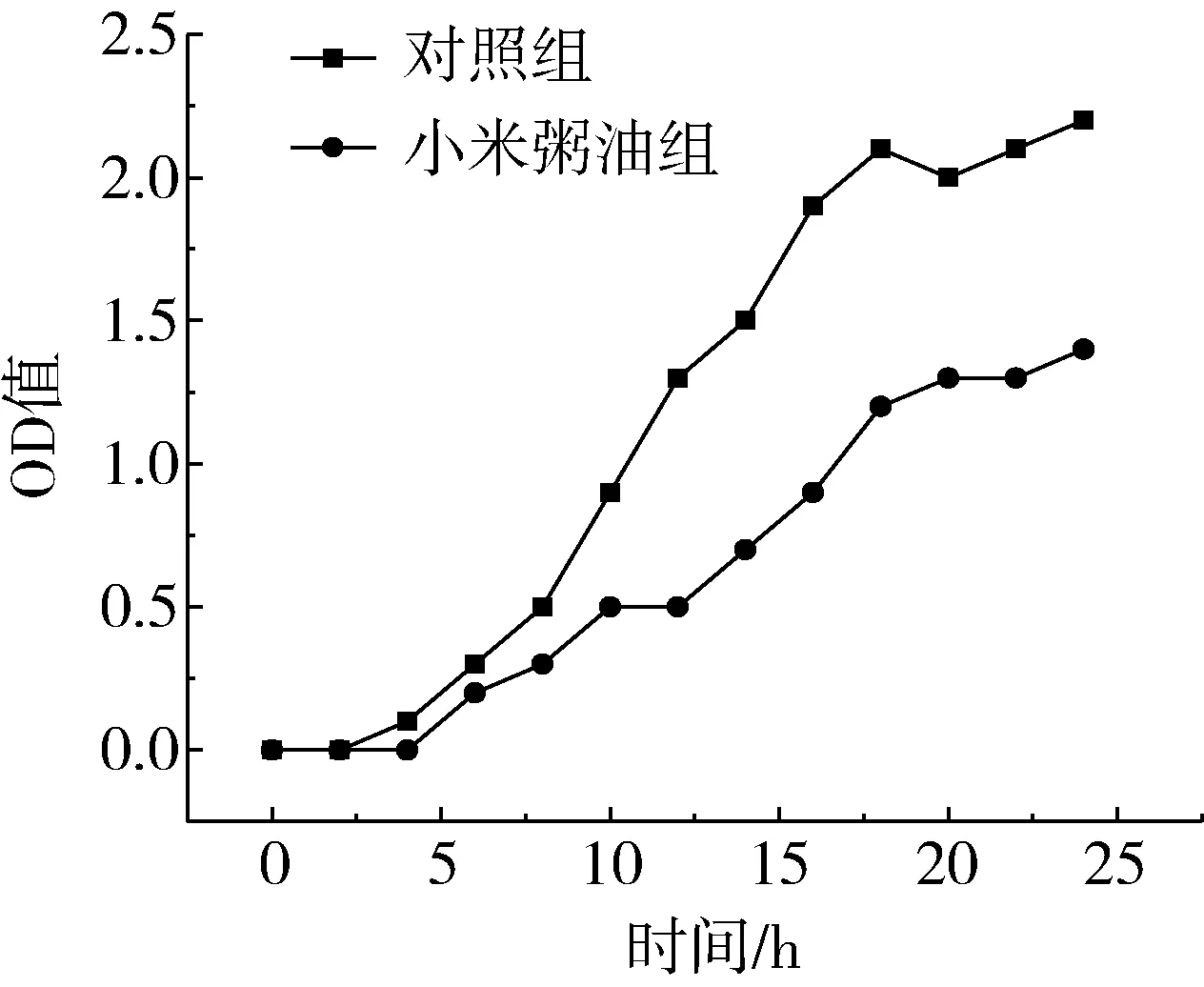
图2 金黄色葡萄球菌生长曲线
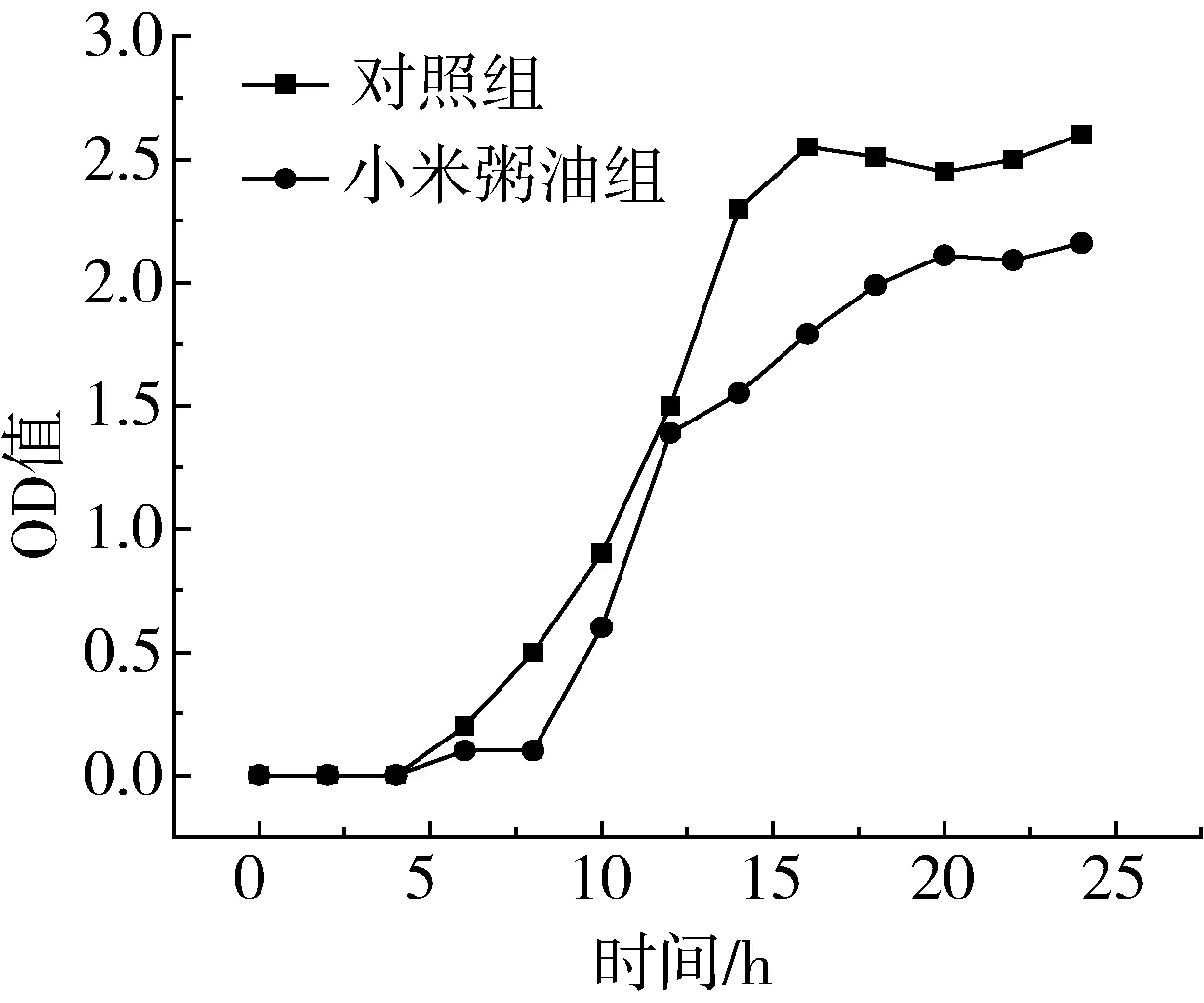
图3 痢疾志贺氏菌生长曲线
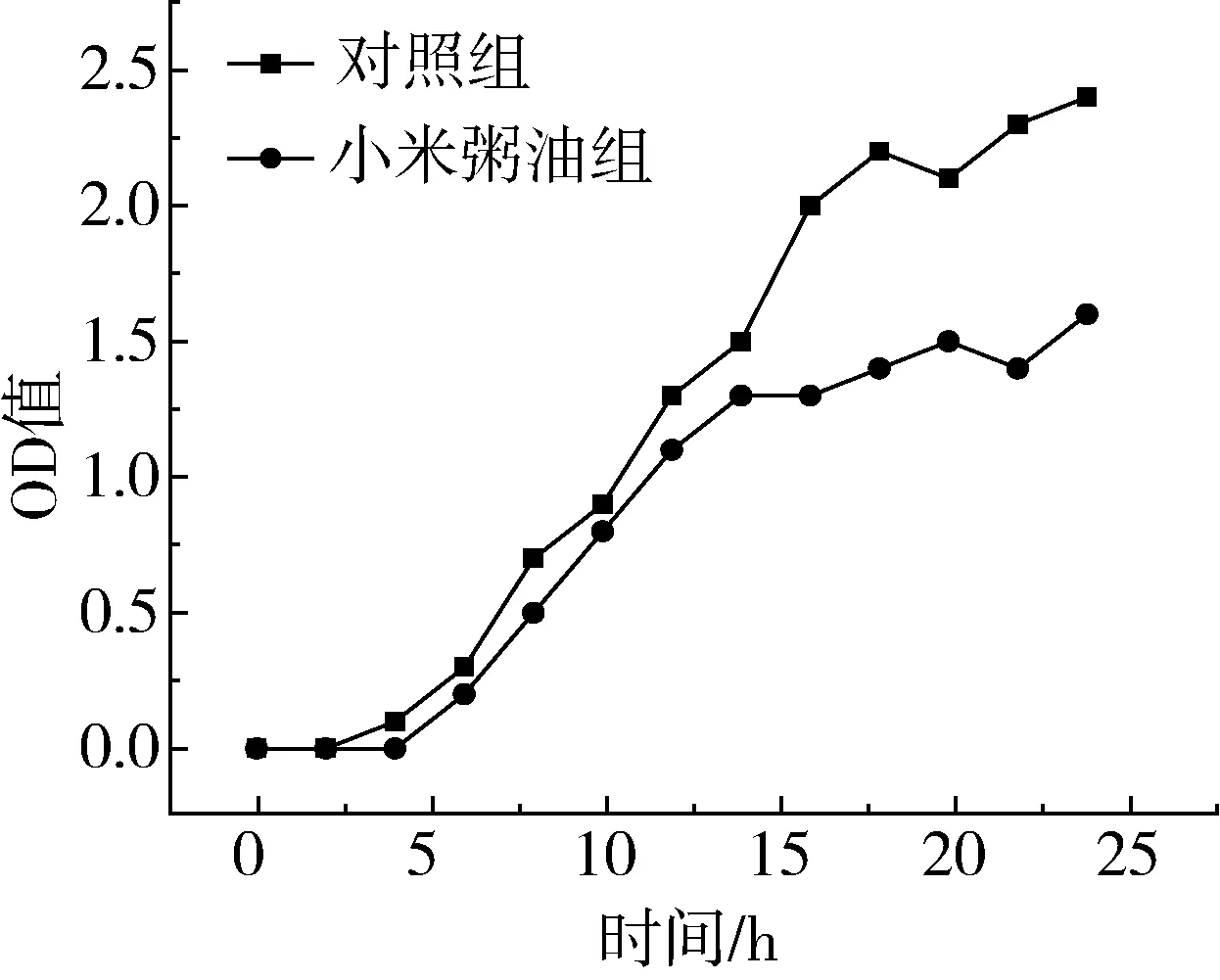
图4 肺炎克雷伯菌生长曲线
3.2.3 核酸含量的测定
小米粥油对供试菌种核酸溶出的影响如图5所示,加入小米粥油的供试菌种吸光度值显著增加(P<0.05),表示菌液中核酸释放量增大,小米粥油破坏了细胞膜的完整性,核酸等大分子物质外泄,导致细胞代谢受损,细胞失去保护,最终导致菌体死亡[23]。
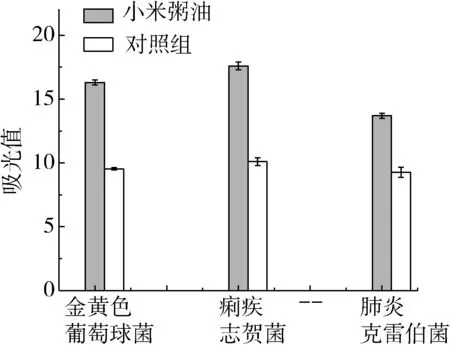
图5 对供试菌种核酸溶出的影响
3.2.4 电导率的测定
由图6可知,对照组电导率增长平缓,有轻微的增长趋势,是由于菌体细胞的自然衰亡与溶解[23]引起的;由于小米粥油本身含有离子导致初始电导率大于对照组,加入小米粥油供试菌种菌悬液的电导率开始增大,显著高于对照(P<0.01),电导率反映了小米粥油对菌体细胞膜通透性的影响。K、Na、H等可以通过细胞膜进入细胞,这些离子在维持细胞膜电位以及维持菌体细胞正常代谢等方面起重要作用,从而维持细胞的正常功能[24]。而小米粥油能使菌体细胞破裂,使菌体细胞内的离子稳态遭到破坏,细胞内电解质外泄,菌体代谢无法进行,最终导致菌体死亡;这与菌悬液核酸含量增加结果一致。
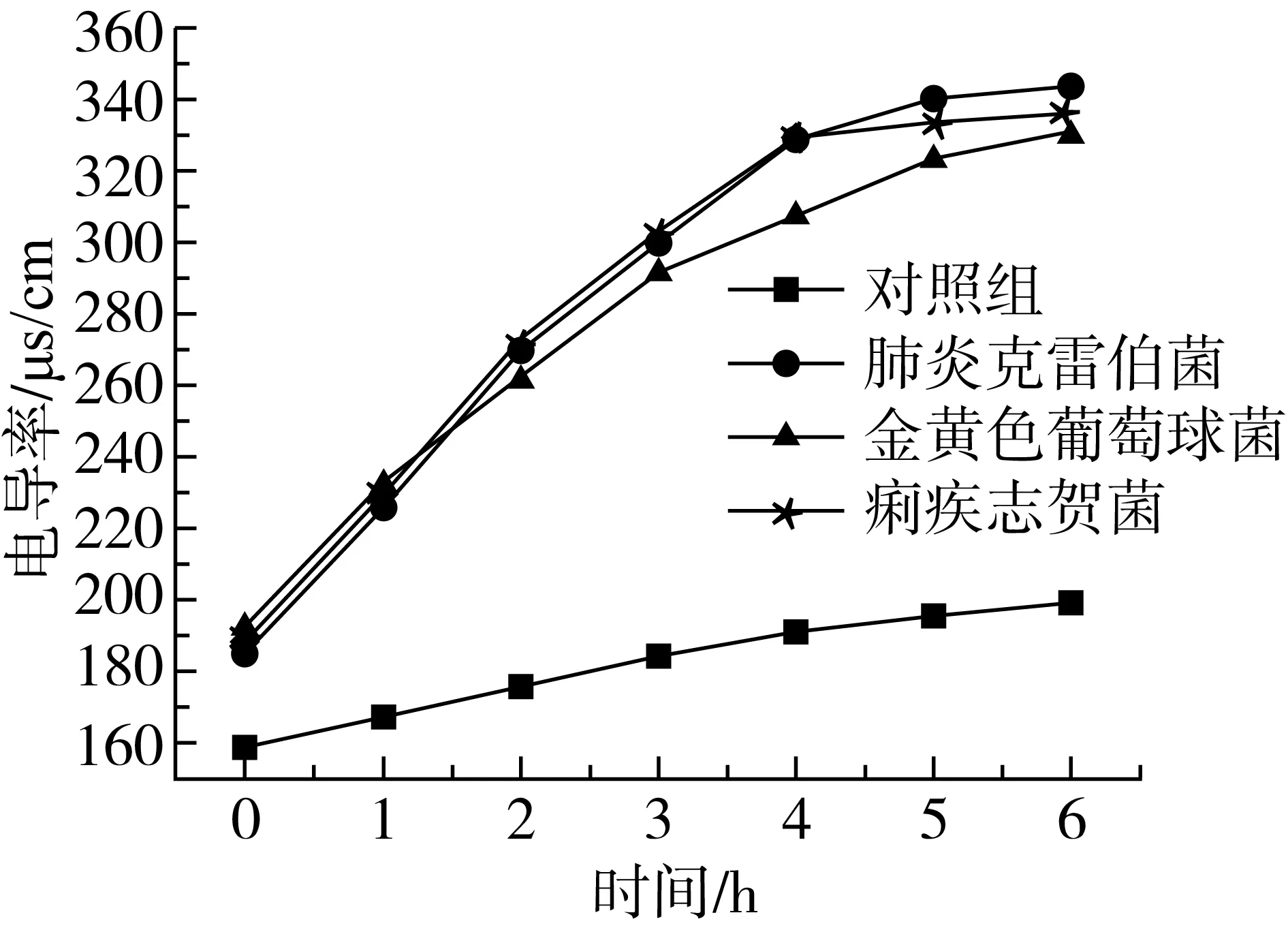
图6 对供试菌种电导率的测试
3.3 内毒素吸附实验结果
建立标准曲线:Y=2.416 8X+0.030 6,R2=0.996 9。
根据表4可得出,随着小米粥油粉浓度的增加,内毒素的吸附率逐渐增加,吸附性效果显著,内毒素为细菌壁的最外侧成分,细菌繁殖扩散的过程中,细菌壁释放内毒素而进入人体肠道中[25]。内毒素的上升能够诱导炎症反应,增加肠上皮细胞等的损伤,促进器官功能的衰竭。
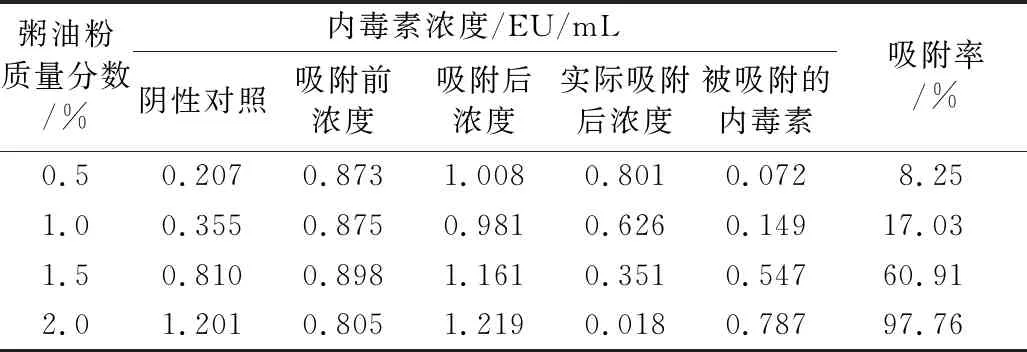
表4 小米粥油粉内毒素试验结果
4 结论
药物治疗小儿腹泻症状是目前主要方法,对人体具有潜在危害性且患儿接受药物治疗难度系数大,所以采用食品进行治疗与预防腹泻受到重视。小米作为一种常见的谷物,其对治疗腹泻具有辅助作用。本实验采用正交试验方法对小米粥油制备工艺条件进行了优化,得到在浸泡时间30 min,料液比1∶20(g/mL),熬煮时间25 min条件下,小米粥油的抑菌圈最大。在此条件下制备的小米粥油进行真空冷冻干燥制得小米粥油粉。结果表明小米粥油对导致小儿腹泻的病原菌有很好的抑制作用,小米粥油会引起细菌细胞壁破碎,延长细菌延滞期,降低对数期,阻碍了细菌正常生长繁殖。而小米粥油制成的小米粥油粉能吸附内毒素,对肠细胞的吸收和分泌功能起到了维持作用,阻止病原微生物的攻击[26]。给予细菌性腹泻病儿,小米粥油治疗能有效抑制病原菌生长、吸附内毒素,效果显著。
