不饱和脂肪酸对卵清蛋白糖基化反应的影响
2021-03-16王羽璇
赵 鑫 王羽璇 叶 博 刘 玲
(沈阳农业大学食品学院1,沈阳 110866)(辽宁省现代农业生产基地建设工程中心2,沈阳 110031)
美拉德反应是一种非酶促褐变反应,主要发生在还原糖和氨基化合物之间,形成不稳定的Amadori产物,并进一步生成不同分子量的产物[1]。羰基化合物是美拉德反应重要的中间体,它们与氨基化合物反应可生成醛酮类化合物,褐色物质以及晚期糖基化终产物(AGEs),适当的美拉德反应可以提高蛋白的功能性,赋予了食品特殊的风味、色泽等感官属性[2,3]。然而,过度的美拉德反应导致氨基酸损失,产生一些潜在的有毒物质,不利于人体健康,例如AGEs的积累,被认为具有诱变性,细胞毒性或致癌性[4-7]。目前为止已发现超过20种AGEs,包括交联产物和非交联产物,其中羧甲基赖氨酸(CML)极具代表性[8],它主要经由糖基化反应生成,同时油脂氧化对其积累具有促进作用。
糖基化和油脂氧化是食品加工和贮藏过程中两个很重要的反应,它们具有一些共同的中间产物和反应途径[9]。脂质氧化主要由不饱和脂肪酸中自由基所引发[10],这种氧化优先发生在多不饱和脂肪酸上,如亚油酸、花生四烯酸、二十碳五烯酸和二十二碳六烯酸等[11]。氧化反应导致食品营养价值降低,食品保质期缩短,还可能形成有毒和致癌化合物[12,13]。在富含蛋白、糖和脂肪的食品中,脂质氧化反应生成的脂过氧自由基、羟基自由基以及超氧自由基,可促进美拉德反应的进行和AGEs的累积[14]。
蛋类是蛋白质含量丰富的食品,其中卵清蛋白(OVA)是蛋清中的主要蛋白,约占蛋清总蛋白质的55%,具有蛋清大部分功能特性[15]。OVA为球状单体糖蛋白,以紧凑的球状构象存在[16]。蛋白质在加工中易发生高级结构变化而引发相关化学反应,从而改变食品的加工贮藏性能。蛋制品种类丰富,加工中常使用糖和油脂,因此蛋制品加工中更容易发生化学反应。探究蛋类蛋白在加工中营养成分的化学反应机理有利于改善蛋品的加工性质,改进工艺,确保蛋制品质量安全。虽然目前已有报道关于糖、脂和蛋白质之间的相互作用,但是研究不够深入,而且针对蛋类蛋白的研究尚少,故本研究以OVA糖基化反应为研究对象,旨在探究脂肪对OVA糖基化反应及AGEs累积的影响,为蛋制品加工性质的改善和降低AGEs累积提供参考。
1 材料与方法
1.1 试剂与设备
甲醇、乙二醛、吡咯素(PRL)、3-脱氧葡萄糖醛酮(3-DG)、亚油酸(LIN)均为色谱纯;油酸、二十碳五烯酸、羧甲基赖氨酸、D-葡萄糖(GLC)、邻苯二胺(OPD)均为分析纯。
超高效液相质谱检测仪。
1.2 方法
1.2.1 糖基化模拟组的制备
建立4个模拟组:单独糖的GLC组,单独蛋白的OVA组,蛋白与糖的糖基化GLC+OVA组及含有不饱和油脂的糖基化GLC+OVA+UFA组。油脂组分别含三种不同油脂。组分含量为3 g GLC,1.0 g OVA;油脂组中含2.0 g吐温20,OLE、LIN、EPA分别 0.25 g。以上6组均用50 mmol/L hepes缓冲溶液(pH 8.0)在室温下充分溶解并定容至25 mL。加热温度50 ℃,每隔12 h时计时取样,每次取样3 mL,迅速冷却至室温并于-20 ℃下冷冻保存待用。
1.3.2 主要指标的测定
1.3.2.1 二羰基化合物的衍生化及GO、3-DG的测定
羰基化合物性质活泼,本文通过检测相应的衍生物为其定量,根据先前的方法稍作修改[17],取样250 μL,加入750 μL甲醇,涡旋振荡30 s后在4 ℃,12 000 r/min条件下离心10 min,取100 μL上清液,加入900 μL 50 mmol/L OPD甲醇溶液,4 ℃避光衍生12 h。衍生后样品过0.22 μm微孔滤膜并转移至1 mL进样瓶,UPLC-MS/MS检测。
色谱质谱条件:Shim-pack GIS C18 UPLC色谱柱(75 mm×2.1 mm,2 μm),流动相A为含有0.1%甲酸的超纯水,B为甲醇(70∶30)。进样量1 μL,流速0.2 mL/min,柱温30 ℃,等度洗脱模式,运行时间5 min。质谱部分使用ESI离子源,离子源温度100 ℃,脱溶剂温度350 ℃,接口温度300 ℃,DL温度250 ℃,加热块温度400 ℃。载气高纯氮气,碰撞气氦气,喷雾电压5.0 kV。以正离子模式获得MS数据,并通过选择离子监测(SIM)模式和多反应监测(MRM)模式鉴定所测得的化合物核质比。实验重复3次。
用50 mmol/L hepes缓冲溶液(pH 8.0)配制3-DG、GO衍生物的梯度浓度标准溶液,并进行液相质谱检测。得到4种物质的浓度-峰面积标准曲线,计算相关性系数R2。使用加标回收法分析检测方法的有效性,使用日内和日间相对标准偏差验证实验方法的精密度。
1.3.2.2 蛋白酸水解及CML、PRL的测定
取样500 μL,加入6 mol/L浓盐酸4.5 mL,加入一滴正辛醇,真空封口后,在110 ℃条件下酸水解24 h。将反应后的水解液过滤定容至10 mL,取200 μL用50 ℃氮气吹干,超纯水复溶至1 mL,涡旋振荡30 s,过0.22 μm微孔滤膜并转移至1 mL进样瓶,UPLC-MS/MS检测[18]。
1.3.2.3 TBA值的测定
取样300 μL,加入1 000 μL三氯乙酸(TCA)溶液(0.5 mol/L,含0.3 mmol/L EDTA-2Na),50 ℃振摇30 min后,4 ℃离心10 min(12 000 r/min)。取1 mL上清液加入1 mL三氯乙酸和等体积0.02 mol/L硫代巴比妥酸(TBA),摇匀密封沸水浴加热1 h后冷却10 min。二次离心后,532 nm波长下测定吸光度值。使用1,1,3,3-四甲氧基丙烷作为丙二醛标准液进行标曲的绘制[19]。
1.3.2.4 POV值的测定
取样1 mL加入2 mL三氯甲烷-甲醇(70∶30),4 ℃,12 000 r/min离心10 min。取2 mL上清液加入50 μL硫酸亚铁(FeSO4·7H2O,13 mmol/L)和50 μL硫氰酸钾(KSCN,3 mol/L)涡旋振荡,室温下静置5 min,500 nm下测定样品的吸光度[20]。
1.3.2.5 圆二色谱的测定
样品用50 mmol/L hepes缓冲溶液(pH 8.0)稀释50倍,置于光径为0.1 cm的样品池中分析,设置灵敏度为20 medg,扫描速度50 nm/min,扫描范围190~250 nm[21]。
1.3.2.6 数据分析
实验结果用平均值±标准偏差的形式来表示。用SPSS 21进行数据间的线性回归分析及ANOVA显著性分析(P<0.05),并且使用最小显著差数法(LSD)进行全配对多重比较。使用smart PLS 3.0软件进行PLS-SEM建模及路径分析。
2 结果与分析
2.1 产物GO、3-DG、CML、PRL的分析
用3-DG、GO、CML、PRL标准品分别配制质量浓度1 μg/mL的标准溶液,对4种标准品分别进行液相质谱检测。4种标准品所对应的保留时间、分子离子及特征碎片离子如表1所示。

表1 标准品质谱信息
2.2 不同脂肪酸对模拟体系中GO、3-DG生成的影响
图1a所示3-DG含量变化。在24 h反应中,GLC组中3-DG含量略有增加。对照GLC+OVA组在72 h 时3-DG含量增加32.97%,是GLC组的2.5倍(P<0.01)。GLC组与对照组中3-DG生成规律差异归因于3-DG的生成途径不同。GLC组中3-DG通过还原糖的自氧化途径生成且含量较低,积累到一定水平则达到反应平衡状态不再变化。OVA的加入使3-DG生成更多地来自美拉德反应中席夫碱和Amadori产物的裂解,这个途径的反应速率远大于GLC的自氧化速率。三组油脂中,EPA组中3-DG含量增加42.66%,与其他组比较差异显著(P<0.05),说明 EPA对3-DG的形成有显著的促进作用,而且这种促进作用来自于对糖基化反应的促进,而不是对糖自氧化的促进作用。
图1b为GO含量变化,各组在36 h之后GO含量均趋于稳定。在GLC组中GO含量是3-DG的2.5倍,说明GO比3-DG更易生成。对照组中GO含量与GLC体系差异不大(P>0.05),说明糖基化反应过程对GO积累贡献不大,GO主要经葡萄糖自氧化生成。三组脂肪酸中GO含量比对照组都有显著升高(P<0.01),说明油脂对于生成GO的促进作用,在油脂组中GO主要是经过油脂氧化生成。已有研究表明在食物烹饪和储存过程中,鱼油中生成的GO要明显高于植物油中的GO含量,正是由于鱼油中含有大量PUFA的缘故[22]。另外,EPA组中GO含量明显高于OLE和LIN组,表明这种促进作用随不饱和度的增高而增大。因为EPA含有大量的不饱和双键,能有效地促进羟基自由基和二次氧化产物的生成,有助于形成二羰基化合物和AGEs[23,24]。
随反应时间的延长,两种羰基化合物含量都随着油脂不饱和度升高而增加,3-DG主要历经糖基化反应途径,因此油脂通过促进糖基化反应促进3-DG形成,而GO的含量增加更多的是油脂自氧化的结果,正因为此,在反应到36 h后,GO含量的增加明显趋于缓和,这也反映了美拉德反应产物(MRPs)积累对油脂的抗氧化作用。
图1c显示了PRL含量的变化。4种模拟体系中PRL含量均随反应时间增加而显著的上升(P<0.05)。对照组PRL含量增长了4.86%(72 h),加油脂组PRL含量高于对照组(P<0.05),说明脂肪酸会显著促进体系中PRL的生成,且脂肪酸不饱和度与CML的生成量之间成反比。图1d为反应中CML含量变化。四组中CML含量变化都随反应时间的增加而显著上升(P<0.05)。油脂组CML含量高于对照组,说明脂肪酸可有效促进CML生成。且脂肪酸不饱和度与CML的生成量之间成反比。蛋白的适当氧化可以促进AGEs生成,然而蛋白质过度氧化会导致大量二硫键交联形成蛋白质的聚集,使蛋白质在x结构上形成空间位阻效应[25]。这种结构不利于羰基化合物与氨基酸结合生成AGEs。脂肪酸的不饱和度高,对PRL和CML的促进作用减弱可能与PUFA对OVA的过度氧化有关,也可能因MRPs具有较高的抗氧化活性,MRPs生成量越多对氧化抑制作用越强,从而使后期糖基化反应减弱。

注:*为同一反应时间内不同组之间含量的差异显著性P<0.05。图1 不同模拟组中AGEs产物含量随热处理时间的变化
2.3 不同脂肪酸对模拟体系中TBA值的影响
图2a为油脂初级产物的POV值变化。3组油脂在24 h内POV值均呈明显下降趋势,24 h后随反应时间的延长逐渐放缓。含EPA组与含LIN组趋势下降的最显著。这种下降是来自MRPs的抗氧化作用。从图2b看出,除了含有EPA的组之外,其他组的TBA值都增加很少(P>0.05),这也说明了MRPs的影响。EPA组前36 h TBA值增加了6.39%,是OLE组的2.33倍(P<0.01),可以看出高不饱和脂肪酸氧化很快。脂肪酸氧化可以生成大量次级产物,促进羰基化合物生成,羰基化合物使脂质氧化与美拉德反应协同作用。
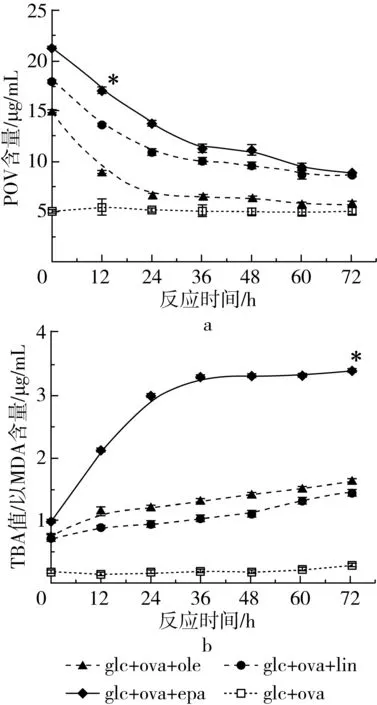
注:*为同一反应时间内不同组之间含量的差异显著性P<0.05。图2 不同模拟组中氧化产物含量随热处理时间的变化
为进一步探究脂质过氧化与美拉德反应之间的联系,将脂质过氧化与蛋白糖基化产物含量进行回归分析(表2)。TBA值与3-DG、GO、CML、及PRL之间均表现出良好的线性关系(P<0.01),POV值与4种糖基化产物之间也有显著的负相关性(P<0.01),这一现象在EPA组中体现得尤为明显,这说明脂肪酸氧化会显著影响蛋白糖基化进程。

表2 不同模拟组中AGEs与氧化产物之间的相关性
2.4 糖基化蛋白的圆二色谱分析
圆二色谱是探究蛋白质高级结构变化的一种重要方法。图3中200 nm和230 nm处的峰值是蛋白质α螺旋的特征峰。与天然OVA相比,经过加热的OVA在200 nm处的正椭圆率降低,负椭圆率增大,经过计算α螺旋减少7.1%,说明热反应破坏蛋白二级结构,使蛋白结构变得松散无序。糖基化反应后蛋白分子结构适度展开,二级结构破坏率低于直接加热,可能二羰基化合物与氨基酸残基结合阻碍了侧链之间的共价交联,缓解了蛋白由于热处理引起的结构变化。油脂的加入使蛋白结构变化增大,并随着不饱和度升高对OVA结构的影响更加明显,这说明脂质氧化导致蛋白氧化引发蛋白空间结构进一步展开。已有研究表明,脂类氧化易导致蛋白质氧化,这些氧化主要包括蛋白质肽键断裂、分子结构的展开、以及氨基酸残基的氧化等[26]。脂肪在氧化过程中生成的氢过氧自由基以及活性氧自由基可诱导蛋白质氧化的发生[27]。这些氧化损伤会导致在蛋白天然构象中分子内部的氨基酸残基暴露,使体系中的二羰基化合物与氨基酸残基之间充分接触,从而促进AGEs的生成。

图3 不同模拟组OVA圆二色谱

图4 模型路径图
2.5 糖基化模拟体系的SEM结构模型路径分析
2.5.1 理论模型构建和信度与效度分析
本实验用smart PLS 3.0软件进行SEM建模,研究脂质氧化反应对糖基化早中期产物(GO、3-DG)及晚期产物(CML、PRL)的影响。信度反应系统的变异程度,考察数据之间的稳定性。信度越大说明测量结果具有较好的内部一致性。采用克隆巴赫值(cronbach′s alpha)进行检验,检验值大于0.7说明数据之间内部一致性良好,数据可靠性较高。平均抽取变异量(AVE)考察数据间的收敛情况,AVE值越大,潜在变量越能够表征对应项。检验值大于0.5说明潜在变量间相对收敛。本模型的信度与效度分析结果如表3所示,说明数据相对收敛且具有良好的一致性,可以进行下一步分析。
表3 信度与效度分析
2.5.2 模型路径的关系
模型通过变量之间的路径系数揭示了脂质过氧化反应中的初级产物及次级产物与糖基化中间产物及终末期产物之间的关系(表4)。模型中标准差均在0.049~0.160之间,潜变量与测量指标之间的外部模型载荷、潜变量间载荷的P值均小于0.05,表明模型中所有估计计算的变量间差异均显著。

表4 路径相关性
从表4中可以看出脂质氧化次级产物到糖基化中间产物之间的路径系数为0.814,说明其他条件均不变的情况下,“脂质过氧化次级产物”潜变量每变化一个单位,“糖基化中间产物”潜变量将变化0.814个单位,由此可见脂质过氧化次级产物对糖基化中间产物的影响力强,对糖基化终产物的影响力较弱。这是因为脂质氧化的次级产物主要为醛酮类物质,它们既是糖基化反应的中间产物,也是促进氧化的主要物质,因此对促进糖基化反应中间产物的形成也有很大作用。表4也可见脂质氧化初级产物对糖基化终产物的影响力强于对中间产物的影响力,但是作用都不大。这是因为脂质氧化初级产物和糖基化终产物都一定程度上受到MRPs的抗氧化影响。该模拟体系的模拟路径分析如图4所示。
3 结论
AGEs是由糖基化反应和油脂氧化反应的中间产物进一步反应形成。在对二羰基化合物GO和3-DG的分析看出,油脂是通过自氧化和提供自由基氧化糖基化过程中底物的方式形成羰基化合物。在糖基化途径中,UFA通过改变OVA蛋白高级结构来促进糖基化反应进行。脂肪酸的不饱和度与二羰基化合物含量、TBA值、POV值均成正比,与CML和PRL含量成反比,这表明了高不饱和脂肪酸对形成MRPs具有强烈的促进作用,加速了MRPs的累积,对后期AGEs的形成和不饱和脂肪酸氧化都明显抑制。通过结构模型的路径分析可知,脂质氧化初级产物对AGEs累积的作用更大,而脂质氧化次级产物对二羰基化合物的影响非常强劲。
