小米多酚的分离纯化及其组分分析
2021-03-16朱俊玲闫巧珍陈振家王晓闻柳青山
朱俊玲 梁 凯 闫巧珍 陈振家 荆 旭 伊 莉 王晓闻 柳青山
(山西农业大学食品科学与工程学院;山西功能食品研究院1,太谷 030801) (山西省农业科学院高粱研究所2 ,晋中 030600)
谷子(Setariaitalica)又名粟、粱,一年生本草,性喜高温,耐旱稳产,属禾本科植物。多酚类物质具有多种生理功能,对人体健康起着积极的作用[1]。谷物是多酚类物质的丰富来源之一,没食子酸、咖啡酸、阿魏酸、槲皮素、香豆酸、香草酸、山奈酸、鞣花酸、原花青素、氯化锦葵色素、芦丁、矢车菊素半乳糖苷等均在谷物中发现。小米中含有丰富的多酚类物质,其质量分数可达0.3%~3%。
大孔树脂理化性质稳定,不溶于酸、碱和各种有机溶剂,具有使用周期长,可再生使用等优点。王若兰等[2]选择AB-8大孔树脂对小米多酚分离纯化,并优化其工艺条件为:上柱速率2 mL/min,上样液的pH为4左右,浓度为0.12~0.14 mg/mL,洗脱液为70%的乙醇溶液,洗脱速率为1 mL/min。冯进等[3]使用HPD400树脂对蓝莓叶多酚进行了分离纯化,其纯度由38.75%提高到了69.38%。
多酚类物质的鉴定方法有化学鉴定法、红外光谱法、紫外-可见光谱法、液相色谱-质谱联用法和核磁共振法等。申芮萌[4]将蓝莓花色苷分离到的组分进行紫外扫描,确定了4种花色苷物质,3种非花色苷物质。李薇茹[5]将研究提取的芹菜多酚在4 500~500 cm-1内进行红外光谱扫描,结果显示该物质的红外光谱图具有酚羟基和苯环的特征吸收峰,故初步得出该物质含有多酚类化合物。万政敏[6]基于高效液相色谱法在核桃仁中检测到17种酚酸类物质,8种黄酮类物质,其中没食子酸和芦丁含量是最高的。Ravisankar 等[7]运用超高效液相串联四极杆质谱法研究了在埃塞俄比亚和美国种植的白色和棕色teff(俗称苔麸,一种粮食作物)中游离酚和结合酚的结构,并鉴定出了34种多酚物质,主要为黄酮和酚酸物质。Kang[8]采用液相色谱-质谱联用的方法在负离子模式下在高粱中鉴定出了许多黄酮类物质,进一步说明高粱是植物多酚类化合物的丰富来源。
本研究使用AB-8大孔树脂对提取的小米多酚进行了分离纯化,并对纯化后的小米多酚进行初步分析鉴定,旨在为小米多酚的深入研究提供参考。
1 材料与方法
1.1 材料与试剂
小米(东方亮1号);AB-8大孔树脂、福林酚、无水甲醇、无水碳酸钠、氢氧化钠,均为分析纯。
1.2 仪器与设备
UV-2600型紫外-可见分光光度计,SCIENTZ-18N型真空冷冻干燥机,BT-100B型数显恒流泵,DBS-100型电脑全自动部分收集器,IRPRESTIGE-21型傅里叶红外光谱仪,Waters ACQUITY SQD2型液相色谱-质谱联用仪,玻璃层析柱 (Φ2.6 cm×30 cm)。
1.3 方法
1.3.1 小米多酚的提取
小米多酚的提取参照闫巧珍等[9]复合酶法提取小米多酚的方法。
1.3.2 AB-8大孔树脂静态吸附和解吸动力学研究
1.3.2.1 AB-8大孔树脂静态吸附实验
精确称量5 g AB-8大孔树脂,并加入50 mL小米多酚粗提物溶液(质量浓度3.02 mg/mL),振荡,条件为25 ℃,180 r/min。此后每1 h取1 mL上清液,做适当稀释后测定其多酚浓度。根据公式计算出静态吸附量、吸附率并绘制静态吸附动力学曲线[10]。
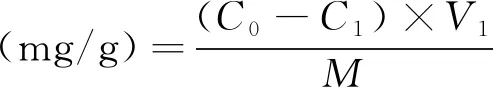

式中:C0为实验前加入小米多酚粗提液的质量浓度/mg/mL;C1为吸附平衡后溶液中多酚的质量浓度/mg/mL;V1为实验前加入小米多酚粗提液的体积/mL;M为树脂质量/g。
1.3.2.2 AB-8大孔树脂静态解吸实验
用滤纸将吸附完全的树脂吸干置于250 mL锥形瓶中,倒入80 mL 70%的乙醇溶液,振荡,条件为25 ℃,180 r/min。24 h后,取锥形瓶中的上清液,做适当稀释后测定其多酚浓度。根据公式计算出静态解析率。

式中:C2为小米多酚质量浓度/mg/mL;V2为加入解吸液的体积/mL;M为树脂质量/g;Q为吸附量/mg/g。
1.3.3 AB-8大孔树脂动态吸附和解吸动力学研究
将AB-8大孔树脂正确装柱(Φ2.6 cm×30 cm),柱床体积为3/4,将小米多酚冻干粉配制成一定浓度的多酚溶液后上柱分离纯化,每5 mL洗脱液为1管。具体方法为:取100 mL小米多酚粗提液通过0.45 μm有机滤膜,根据王若兰等[2]大孔树脂分离纯化小米多酚的方法与条件对小米多酚进行分离纯化,并绘制乙醇洗脱曲线,计算洗脱率。
1.3.4 AB-8大孔树脂分离纯化后小米多酚纯度计算
根据公式计算纯化前后小米多酚纯度[11]。
式中:C为多酚溶液浓度/mg/mL;V为多酚溶液体积/mL;M为冻干后多酚粉末质量/g。
1.3.5 AB-8大孔树脂等温吸附热力学研究
准确称取5份AB-8大孔树脂5 g,分别加入浓度为1 mg/mL、1.5 mg/mL、2 mg/mL、2.5 mg/mL、3.0 mg/mL的小米多酚粗提液50 mL,振荡,设置条件为温度25~35 ℃,180 r/min。24 h后测定多酚浓度,以溶液中的多酚浓度作为横坐标,平衡时的吸附量为纵坐标绘制出AB-8大孔树脂等温吸附曲线[12]。
Langmuir等温吸附公式为:
式中:Ce为达到平衡后溶液中多酚的质量浓度/mg/mL;Qe为平衡时的吸附量,mg/g;Qm为所能达到的最大吸附量/mg/g;KL为吸附平衡常数。
1.3.6 小米多酚的组分分析
1.3.6.1 化学简单定性实验
本实验设计了三氯化铁实验、氯化钠-明胶实验、中性醋酸铅实验、香草醛-浓盐酸实验,通过观察其颜色变化或沉淀生成,初步鉴定是否含有多酚类物质。
1.3.6.2 红外光谱分析实验
精确称量1 mg小米多酚冻干物,加入100 mg溴化钾混匀,烘干至恒重。倒入研钵中于红外灯下研磨后进行压片处理。选择波长范围为4 000~400 cm-1,先对压片后的纯品溴化钾用傅里叶红外光谱仪进行背景扫描,然后对处理后的样品进行扫描[13]。
1.3.6.3 紫外-可见光谱分析实验
称取适量小米多酚冻干物,配制成浓度为1 mg/mL的多酚甲醇溶液。将多酚溶液进行适当稀释后,甲醇作为空白试剂,进行紫外扫描,设置波长范围为800~200 nm,得到小米多酚紫外-可见光谱图。
1.3.6.4 液相色谱-质谱分析实验
将称取0.521 6 g冻干后的小米多酚,用甲醇定容到100 mL,溶液过0.45 μm有机滤膜,为淡黄色液体。
色谱条件:色谱柱:ACQUITY UPLC BEH C18(1.7 μm,2.1×50 mm) ;流动相:A(超纯水),B(色谱级乙腈);流速:0.40 mL/min;柱温:30 ℃;检测波长:280 nm;进样量:2 μL;洗脱条件见表1。
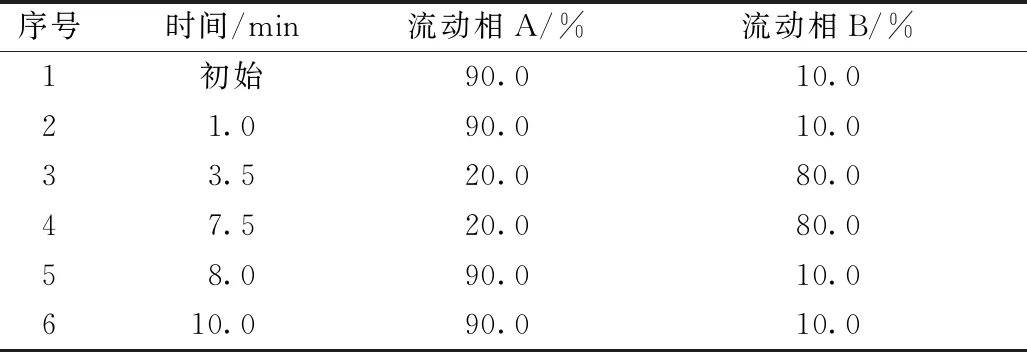
表1 梯度洗脱条件
质谱条件:离子源:电喷雾离子源(ESI源);扫描方式:全离子扫描,正离子扫描范围m/z为50~1 500,负离子扫描范围m/z为50~1 500;雾化气体为N2,喷雾气压为30 psi;N2流速:800 L/Hr;N2温度:400 ℃;毛细管电压:2 500 V。
1.3.7 数据分析与处理
所有实验重复3次,数据采用Origin9.1绘图,用SPSS23.0进行统计分析,采用Duncan多重比较进行差异性分析。
2 结果与分析
2.1 AB-8大孔树脂静态吸附和解吸动力学研究结果
由表2可知,AB-8大孔树脂对小米多酚的吸附率和解吸率相对较高,这可能是因为小米多酚与AB-8大孔树脂都具有弱极性,AB-8大孔树脂是含有酰基的树脂,其可以从极性溶剂中吸附非极性物质,也可从非极性溶剂中吸附极性物质。因此选择AB-8大孔树脂分离纯化小米多酚。
由图1可知,吸附时间14 h时完全达到饱和,此时吸附量为12.70mg/g。在0~5 h内吸附速度较快,这是因为大孔树脂在浸泡完全后,吸附表面积增大,大量的吸附位点暴露出来,加入小米多酚后会与吸附位点迅速结合[14]。5 h后吸附量基本趋于平缓,树脂表面暴露出来的吸附点基本趋于饱和,吸附过程进行的速率大大减慢,导致吸附量趋于平缓,10 h后基本已经达到饱和。

图1 AB-8大孔树脂静态吸附曲线
2.2 AB-8大孔树脂动态吸附和解吸动力学研究结果
由图2可知,经70%乙醇洗脱后洗脱峰相对集中,基本无拖尾现象。多酚物质被洗脱完全后所需洗脱液为300 mL,洗脱率达84.00%。

图2 乙醇洗脱曲线
2.3 小米多酚纯化前后纯度的计算
小米多酚粗提物纯度为31.80%,纯化后其纯度为72.80%,为纯化前的2.3倍,说明纯化效果较好。
2.4 AB-8大孔树脂等温吸附热力学研究
2.4.1 AB-8大孔树脂等温吸附曲线
由图3可知,在25~35 ℃内,随着平衡时上清液浓度的增大,平衡时的吸附量也随之增大,表现出良好的吸附能力,其吸附规律符合Langmuir吸附理论。同时,初始浓度相同的情况下,随着温度的逐渐升高,平衡时的吸附量依次降低,说明该树脂的吸附是放热过程,在适宜的温度下吸附量尽可能地增大。

图3 AB-8大孔树脂的等温吸附曲线

表2 AB-8大孔树脂对小米多酚的静态吸附和解吸实验结果
2.4.2 Langmui吸附等温线
由图4和表3中的R2可知,吸附实验符合Langmuir吸附理论。随着温度的逐渐升高相关参数Qm、KL逐渐降低,这可能是因为温度相对较高多酚分子运动迅速,动能增大,导致吸附量降低[15]。同时,Langmuir吸附理论说明AB-8大孔树脂对小米多酚的吸附是属于单分子层吸附,故本吸附实验适用于较低浓度的小米多酚进行上样,若浓度过高则会导致不必要的浪费。
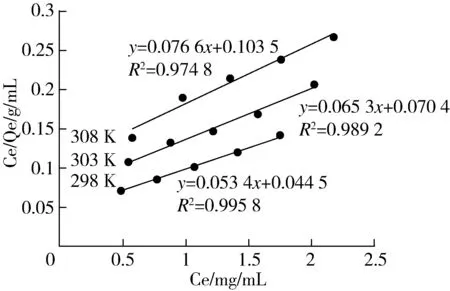
图4 25~35 ℃下的Langmui吸附等温曲线
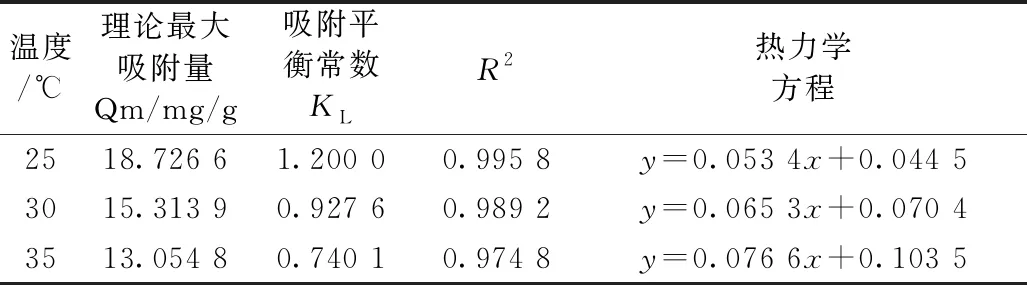
表3 Langmuir等温吸附方程及相关参数
2.5 小米多酚的组分分析
2.5.1 化学简单定性实验结果
由表4可知,各种实验反应现象均可证明小米提取液中含有多酚类物质,且与推测结果相一致,有利于小米多酚组分的进一步分析。

表4 化学定性实验结果
2.5.2 红外光谱分析实验结果


图5 小米多酚红外吸收光谱图

表5 小米多酚振动峰波数及其振动类型
2.5.3 紫外-可见光谱分析实验结果
由图6可知,小米多酚在272、330 nm处有2个吸收峰,通过对比芦丁标准品的紫外-可见吸收光谱图可知,两者的紫外吸收峰稍微有移位,但基本符合黄酮类物质的特征。谱带Ⅰ(300~400 nm)和谱带Ⅱ(220~280 nm)属于黄酮类化合物的紫外吸收带,因此,可推断出小米多酚中含有黄酮类化合物。
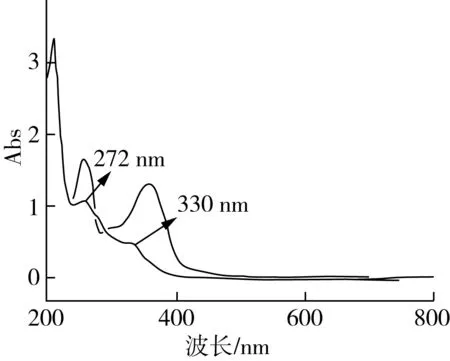
图6 小米多酚和芦丁对照品紫外-可见吸收光谱图
2.5.4 液相色谱-质谱分析实验结果
结合图7离子流色谱图,由图8可知在0.35 min左右处化合物1的负离子峰[M-H]-质荷比为195,所以推测该化合物的分子质量为196。通过查阅欧洲Phenol-Explorer多酚数据库与已有研究,可推测出化合物1为羟基咖啡酸。

图7 小米多酚的离子流色谱图

图8 化合物1质谱图(ES-)
结合离子流色谱图,由图9可知在3.47 min左右处化合物2的负离子峰[M-H]-质荷比为483,所以推测该化合物的分子质量为484。通过查阅欧洲Phenol-Explorer多酚数据库与已有研究,可推测出化合物2为氯化矢车菊素-3-O-半乳糖苷。
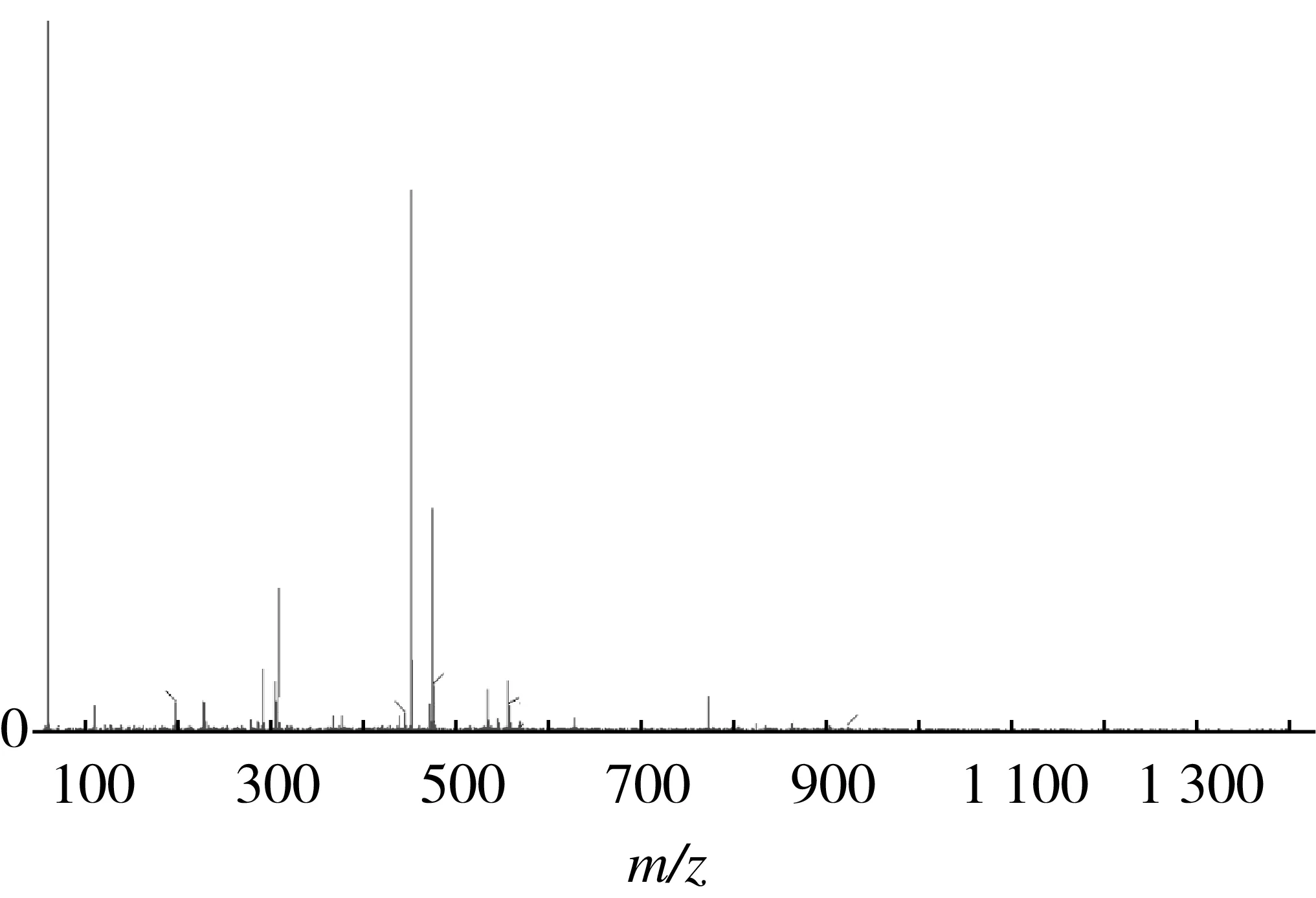
图9 化合物2质谱图(ES-)
结合离子流色谱图,由图10可知在5.80 min左右处,化合物3的负离子峰[M-H]-质荷比为279,所以推测其分子质量为280。通过查阅欧洲Phenol-Explorer多酚数据库与已有研究,可推测出化合物3为对香豆酰苹果酸[16],该物质为香豆酸衍生物。
咖啡酸在抗油脂氧化方面要强于阿魏酸等其他羟基肉桂酸类化合物[17]。矢车菊素-3-O-半乳糖苷属于黄酮类物质,其可以提高细胞活力,提高氧化酶活性,抑制自由基氧化[18]。

图10 化合物3质谱图(ES-)

表6 小米多酚液相色谱-质谱分析结果
3 讨论
采用化学定性实验、红外吸收光谱法、紫外-可见吸收光谱法、液相色谱-质谱联用法相结合对小米多酚组分进行分析。由紫外-可见吸收光谱图可推断出小米多酚中含有黄酮类化合物,本实验提取得到的小米多酚为淡黄色粉末,经分离纯化后颜色进一步加深,而黄酮类化合物是一类以2-苯基色原酮作为母核的黄色色素,母核上常含有羟基、甲氧基等助色基团,所以黄酮类化合物大多都显黄色,由此更可证明小米多酚中含有黄酮类物质。由得到的高效液相色谱图可知小米多酚色谱峰较少,故小米多酚所含组分比较单一。此外,由于多酚类化合物分子量范围很大,当分子质量大于1 200 U时,仅仅依靠HPLC-MS无法得到准确的分子质量,同时对于多酚类物质的空间构象和基团之间的连接方式也不能给出准确信息,为了进一步鉴定小米多酚的准确结构需采用其他更为先进的分析鉴定技术。本实验仅对小米多酚仅做了一级质谱的测定,没有进一步做二级质谱,对小米多酚组分仅做了初步推断,并没有对二级质谱中的碎片信息以及裂解规律进行分析,所以需进一步进行二级质谱的测定,以确定小米多酚中化合物的种类。
4 结论
使用AB-8大孔树脂对小米多酚粗提物进行分离纯化,对其静态和动态吸附与解吸动力学进行探究。纯化后小米多酚纯度达72.80%。对小米多酚组分进行分析,初步推断出小米多酚中含有黄酮类化合物。采用HPLC-MS对各组分质荷比和分子质量测定,初步推断出小米多酚中含有的主要化合物可能为:羟基咖啡酸、氯化矢车菊素-3-O-半乳糖苷和对香豆酰苹果酸,而且这3种化合物均为谷物中最为常见的多酚化合物。
