补肾解毒方抗核辐射损伤作用机制研究
2021-03-16杨云霜李延晖石鹏展SABURSanzhar哈萨克斯坦
杨云霜,赵 雪,杜 磊,李延晖,石鹏展 ,SABUR Sanzhar(哈萨克斯坦),张 蓉
(1.北京市隆福医院治未病科,北京 100010;2.火箭军特色医学中心,北京 100088;3.北京中医药大学中医学院,北京 100029)
辐射极易造成免疫系统的损害,抑制保护性免疫因子的生成以及释放大量内源性危害因子,这些免疫系统的改变均能造成机体免疫功能障碍并伴随组织损伤,故辐射损伤中免疫系统防护为当今亟待解决的辐射防护问题之一。Ito等[1]对1945年广岛原子弹爆炸暴露人群追踪调查发现此类人群均有不同程度胸腺萎缩。同时有研究显示辐射可引起血液、脾脏、淋巴中免疫细胞数目减少[2]。这与本研究小组前期对胸腺、脾脏指数观察所得结果一致[3]。文献表明辐射主要通过TLR4信号通路介导相关炎症反应,故此通路相关受体与蛋白的表达在机体遭受辐射后常存在不同程度的改变[4],但对此通路上下游相关因子与辐射相关性的系统阐述尚未可知。本研究中补肾解毒方为滋阴补肾、清热解毒之方,有扶正祛邪之效,通过长期动物实验研究发现其能够调节辐射后炎性细胞因子的表达[5-6],本研究通过测定辐射后第1、14、30 天TLR4通路上下游因子水平的变化,以探索补肾解毒方抗辐射后免疫损伤防护作用机制。
1 材料与方法
1.1 实验材料
1.1.1 研究动物:SPF级健康雄性小鼠276只,平均体重(20±2) g,由南京大学-南京生物医药研究院提供,实验动物合格证号SCXK(苏)2010-0001。其中138只为直接从南京大学南京生物医药研究院购买C57BL/10SCNJ(TLR4-/-)基因敲除小鼠,另外138只小鼠为南京大学模式动物研究所从美国JAX公司代购的C57BL/10SCNJ(TLR4+/+)小鼠繁育的子代。小鼠自由摄食饮水,进食普通颗粒饲料,北京师范大学生命科学院实验动物中心动物房饲养,动物房保持恒温,22 ℃,湿度60%~90%。
1.1.2 主要试剂与仪器:小鼠TOLL样受体4酶联免疫试剂盒(RGB & CHN公司,Lot:20150109、60293M),CD14/Treg细胞流式试剂盒(BD PMG公司)。电子天平(赛多利斯科学仪器北京有限公司,型号:00000246)、60Coγ射线辐射装置(北京师范大学化学学院)、高速台式冷冻离心机(上海天美科学仪器有限公司,型号:CT15RT)、Thermo 全自动酶标仪(芬兰Thermo Scientific公司,型号:Multiskan MK3)、流式细胞仪(德国 BD Calibur公司,型号:双激光四色)、流式细胞分析软件(德国 BD Calibur公司,版本:CellQuest Pro)。
1.2 实验方法
1.2.1 补肾解毒方:由熟地、山药、牡丹皮、茯苓、泽泻、白花蛇舌草各10 g,山茱萸12 g,冬虫夏草3 g组成本方。
1.2.2 建模分组及给药:采用随机数字表法将138只TLR4+/+小鼠随机分为TLR4+/+空白对照组18只、TLR4+/+辐射模型组60只、TLR4+/+补肾解毒方组60只;138只TLR4-/-小鼠随机分为TLR4-/-空白对照组18只、TLR4-/-辐射模型组60只、TLR4-/-补肾解毒方组60只。按人体给药量换算成小鼠等效剂量作为小鼠给药量,给药剂量为13.5 g/(kg·d)[7],将中药颗粒加无菌水配至18 ml混合液,现配现用,给药剂量为0.2 ml/d。分组后每天上午8:00补肾解毒方组给予中药灌胃,容积0.2 ml,空白对照组、辐射模型组给予生理盐水灌胃,容积0.2 ml,连续灌胃10 d,第11 天,除空白对照组外,其他四组分别进行一次性6Gy60Co γ-射线照射,照射后第1 天开始继续灌胃,连续30 d。
TLR4+/+空白对照组、TLR4-/-空白对照组分别于辐射后第1、14、30天各取材6只。其余四组分别于辐射后第1天取材7只;辐射后第14天取材每组存活小鼠数量的50%;辐射后第30天每组剩余存活小鼠全部取材。眼球采血后颈椎脱臼法处死;采血(1±0.2)ml,放入1.5 ml含有肝素抗凝剂的离心管中,置4 ℃,离心半径8 cm离心机,3000 r/min,离心5 min,分离血清,置-80 ℃冰箱保存。
1.2.3 ELISA检测法:将标准品稀释后加样,置37 ℃温育30 min,20 ml的30×PBS缓冲液、580 ml纯水配制成600 ml、pH值为7.4的洗液,孵育完成后撤掉封板膜,弃液后甩干,加洗涤液静置30 s后弃去,重复5次,加酶50 μl,再次温育、洗涤,加显色剂A、B显色,37 ℃避光显色15 min后加终止液50 μl,依序测量各孔吸光度,读取数值。
1.2.4 流式细胞学法:加入抗体,分别加入CD14、CD4、CD25抗体各5 μl,加样本100 μl,充分摇匀,室温避光孵育20 min。取出试管,每管加溶血素2 ml,室温避光放置10 min。待红细胞全部溶解,1500 r/min,离心5 min,去上清。每管加入2 ml的PBS缓冲液洗细胞两次,1500 r/min,离心5 min,去上清,每管加入0.5 ml的PBS,放4 ℃冰箱,4 h内上机检测。
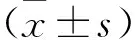
2 结 果
2.1 辐射后各组小鼠CD14的动态变化 辐射后第1天,各辐射模型组小鼠CD14与空白对照组相比均有不同程度的降低(P<0.01),且TLR4+/+补肾解毒方组与TLR4+/+辐射模型组比较,差异无统计学意义(P>0.05)。TLR4-/-补肾解毒方的CD14与TLR4-/-辐射模型组比较,差异无统计学意义(P>0.05)。辐射后第14天,各辐射模型组CD14明显升高,且均高于空白对照组水平(P<0.01)。TLR4+/+补肾解毒方组的CD14高于TLR4+/+辐射模型组,组间差异有统计学意义(P<0.01)。TLR4-/-补肾解毒方组的CD14与TLR4-/-辐射模型组比较,差异无统计学意义(P>0.05)。辐射后第30天,各辐射组CD14水平与第14天比较均有所下降,但TLR4+/+补肾解毒方组仍高于TLR4+/+辐射模型组,差异有统计学意义(P<0.01)。TLR4-/-补肾解毒方组的CD14与TLR4-/-辐射模型组比较,差异无统计学意义(P>0.05)。见表1(图1)。

表1 各组小鼠辐射后CD14水平比较(%)
2.2 辐射后各组小鼠TLR4动态变化 辐射后第1天,各辐射组TLR4无明显变化;辐射后第14天及第30天TLR4+/+补肾解毒方组的TLR4均高于TLR4+/+辐射模型组,且辐射后第30天,组间比较差异有统计学意义(P<0.05),见表2。
2.3 辐射后各组小鼠MD2动态变化 辐射后第1天,各辐射模型组MD2无明显变化;辐射后第14天及第30天,TLR4+/+补肾解毒方组的MD2高于TLR4+/+辐射模型组;辐射后第1天TLR4-/-补肾解毒方组与TLR4-/-辐射模型组比较,差异无统计学意义(P>0.05);各时间点的MD2水平TLR4-/-补肾解毒方组、TLR4-/-辐射模型组与TLR4-/-空白对照组比较,差异有统计学意义(均P<0.05),见表3。
2.4 辐射后各组小鼠CD4+CD25+Treg细胞动态变化 辐射后第1天,与空白对照组比较,TLR4-/-辐射模型组CD4+CD25+Treg细胞均低;其他三组均高于空白对照组,组间比较差异有统计学意义(P<0.05)。TLR4+/+补肾解毒方组低于TLR4+/+辐射模型组,辐射后第14天及第30天,各辐射模型组CD4+CD25+Treg细胞与空白对照组比较均升高,组间差异有统计学意义(P<0.05)。TLR4+/+补肾解毒方组的CD4+CD25+Treg细胞高于TLR4+/+辐射模型组,TLR4-/-补肾解毒方组与TLR4-/-辐射模型组比较,差异无统计学意义(均P>0.05)。见表4(图2)。

图1 各组小鼠辐射后各时间点CD14动态变化

图2 各组小鼠辐射后各时间点Treg细胞动态变化
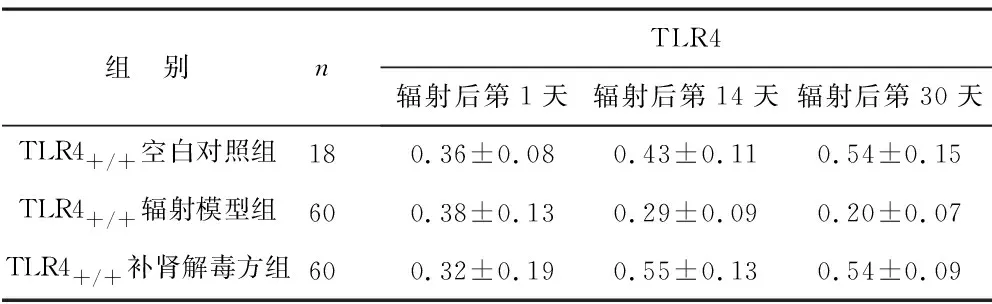
表2 各组小鼠辐射后TLR4动态变化(ng/ml)

表3 各组小鼠辐射后MD2动态变化(ng/ml)

表4 各组小鼠辐射后Treg细胞动态变化(%)
3 讨 论
中医认为辐射是一种由外作用于人体,具有强烈致病作用的毒邪,来势剽悍、易伤阴耗气、损伤各脏腑功能、损伤正气,进而导致人体抗病能力下降[8]。通过对气血双补方剂、扶正解毒方剂与滋补肾阴方剂的对比研究,发现应用滋补肾阴方剂可显著缓解辐射对免疫器官(胸腺、脾脏)的影响[9]。滋补肾阴方剂不仅可填精益髓,增强机体抗病能力,亦可壮水之主,以制阳光,缓解由辐射火毒之邪导致的火毒炽盛的表现,如口燥咽干、血热出血、疮疡肿毒等症[10]。补肾解毒方是以六味地黄丸为基础,减少熟地用量以防滋腻,另加冬虫夏草、白花蛇舌草化裁而成,冬虫夏草能抗氧化、抗炎、调节免疫功能,白花蛇舌草可以刺激网状内皮系统,提高白细胞吞噬能力,增强机体抵抗力。诸药合用,具有滋阴益肾、凉血解毒的功效,发挥保护机体、减轻辐射损伤的作用,并且中药方剂安全性较高、防治结合,作为辐射防护药物易被接受。
TLR4分布广泛,其相关通路具有识别病原体及其产物、释放炎性因子,进而介导炎症反应的作用。TLR4是介导内毒素/脂多糖所诱导炎症反应的重要受体,且与辐射损伤密切相关,通过激活TLR4通路可以有效产生辐射抵抗现象[11]。TLR4受体的结构分为胞外域、跨膜域、胞内域,其中胞外域为结合CD14与MD2的重复亮氨酸序列(Leucine richrepeat,LRR),具有识别病原体的作用;胞内域的高度保守序列在TLR4与配体结合后,介导激活相关炎症细胞因子基因的表达[12],CD14、TLR4、MD2共同形成跨膜复合物,在介导内毒素引起的炎症反应中起到重要作用。CD4+CD25+Treg细胞为TLR4信号通路中一种调节性T细胞,主要介导免疫耐受,抑制T细胞免疫功能,下调免疫应答[13]。本此研究旨在通过检测外周血中CD14、TLR4、MD2、Treg细胞水平动态变化,探讨辐射对免疫系统TLR4信号通路影响和制约,以及补肾解毒方抗辐射损伤是否通过本信号通路发挥作用。
CD14在胞外与TLR4受体结合,可识别病原体LPS,并将其固定于胞外,具有结合、富集、递呈LPS给下游信号受体的作用[12]。CD14是TLR4上游启动因子,本实验结果显示TLR4+/+小鼠辐射后CD14水平先降低后升高,说明CD14在辐射急性期受到抑制,而辐射后第14 天,补肾解毒方通过刺激CD14大量释放从而激活TLR4信号通路,积极对辐射所致的免疫抑制做出调整与恢复,有研究显示通过TLR4通路的激活,下游释放出具有保护作用的炎性因子IL-6、IL-10等[14]。辐射后第30天,TLR4+/+补肾解毒方组的CD14下降更为明显,接近空白对照组水平。TLR4-/-小鼠辐射组与补肾解毒方组CD14变化水平与趋势基本一致,说明补肾解毒方对其并未产生保护作用,CD14水平的波动多由机体受到辐射刺激产生的无区别应激反应导致,由此可以推断,补肾解毒方是通过TLR4信号通路发挥免疫防护作用。
TLR4受体水平辐射后波动较小,仅于辐射后第30天出现显著升高,说明补肾解毒方对TLR4受体具有远期防护作用。MD2存在于免疫细胞表面,与TLR4受体形成一种异质二聚体复合物,协同CD14共同介导炎症反应,产生相应炎性因子[15-16]。本实验中各组MD2水平区别不明显。以上研究结果显示TLR4+/+补肾解毒方组小鼠CD14、TLR4、MD2水平变化趋势大致一致,均在辐射后第14 天上升,随后逐渐下降,说明补肾解毒方通过激活TLR4通路,释放保护性炎症因子,包括IL-10、IL-12、TGF-β1等[5-6],进而发挥免疫防护效应,杨丽梅等[17]认为IL-12具有抗辐射损伤效应;而TLR4-/-两组小鼠因体内缺乏TLR4受体,因此不能通过TLR4信号通路进行干预和调控,辐射后第14天及第30天 CD14、MD2表达水平明显高于空白对照组,且两组之间没有统计学差异。并且通过测定下游炎性因子[5],发现TLR4-/-小鼠释放的IL-17,IL-18,IFN-γ等损伤性炎性因子增加,而保护性炎症因子IL-10,TGF-β1减少,故出现严重的免疫损伤及较高的病死率。
CD4+CD25+Treg细胞作为一种能够抑制免疫功能的T细胞亚群,当机体受到辐射时,能够维持机体免疫系统的稳态,提高机体的自身修护能力,以减轻机体炎症反应,降低辐射后损伤发生[18-19]。本研究结果显示,辐射模型组与TLR4+/+补肾解毒方组CD4+CD25+Treg细胞均出现不同程度增高,但补肾解毒方组Treg细胞表达水平增加更加平稳与长效。由此可见,补肾解毒方可通过TLR4信号通路促进辐射后机体内CD4+CD25+Treg细胞的分化、发育、成熟,发挥免疫抑制作用,防止机体受外界刺激后免疫机能亢进,从而保护机体免受辐射伤害。
所述,辐射所致机体免疫功能障碍通过作用于TLR4信号通路形成,而本研究团队的补肾解毒方具有滋阴益肾、凉血解毒功效,可通过对此通路的调节起到减少损伤性炎症因子释放,增强机体正常免疫功能,从而减轻辐射所致免疫功能障碍,为涉核人员、接受放射疗法癌症患者预防性用药及核接触后防护性用药。
