呼吸神经肌肉刺激仪在重症肌无力致呼吸机依赖患者脱机中的应用
2021-03-16江海娇叶小铭吴郊锋孙瑞祥袁莉萍姜小敢鲁卫华陶秀彬
张 鹏 江海娇* 周 全 叶小铭 吴郊锋 孙瑞祥 袁莉萍 姜小敢 鲁卫华 陶秀彬
机械通气是救治危重患者常用的呼吸支持手段,而撤机是逐渐地降低呼吸机对患者呼吸的支持,使患者完全过度到自主呼吸后撤除机械通气的过程[1]。困难撤机是指患者需要3次SBT尝试,或从第1次SBT尝试后7 d才能撤离呼吸机。呼吸机依赖(Dysfunctional Ventilatory Weaning Response,DVWR)是指患者机械通气时间大于24 h或断开呼吸机不能维持自主呼吸[2]。有研究表明,ICU机械通气时间大于7 d的患者约占6%,而机械通气时间的延长和呼吸支持困难撤离是影响ICU患者住院时间和病死率的独立危险因素[3]。呼吸机依赖与机械通气模式、参数,患者的营养状况,尤其是长期卧床等因素导致的膈肌功能障碍或萎缩有关[4-6]。正确评估患者呼吸机依赖的原因,针对性合理训练,是脱机成功的关键。本文通过报道1例59岁既往有重症肌无力8年病史,因肌无力危象机械通气继发膈肌萎缩致困难脱机呼吸机依赖患者,经过呼吸神经肌肉刺激仪锻炼膈肌功能成功脱机,旨在为医疗工作者提供治疗此类患者的经验。
1 病例资料
患者,女,59岁,因外伤致右踝关节疼痛5 h于2019年7月7日入院,关节骨科治疗。7月8日患者主观感受胸闷、喘憋经会诊后转入ICU。患者8年前患有胸腺瘤(BII型),重症肌无力,治疗后好转出院,自行长期口服溴吡斯的明10 mg,q8 h,今年5月开始胸闷症状加重,行乙酰胆碱抗体检测阳性,溴吡斯的明增至15 mg,q8 h,症状缓解不明显,2天前活动后突发肢体无力,摔倒致右踝关节,畸形入院,头、胸、腹CT、肝、胆、胰、脾、肾超声、超声心动图均无异常。查体轴向肌群(转头、转脖)、眼肌、骨骼肌尚可,呼吸肌差。7月10日19:35突发氧饱和度下降至76%、心率进行性下降至56次·min-1,给予气管插管呼吸机辅助通气等急救后转入ICU,患者入科气管插管中,呼吸机辅助通气,四肢肌力1~2级,诊断:肌无力危象,重症肌无力IV型(迟发重症型)。给予溴新斯的明30 mg,q8 h治疗后四肢肌力改善为3~4级状态,膈肌超声示膈肌位移1.4 cm,膈肌增厚率30.1%,提示膈肌功能恢复正常。7月13日行右下肢切开内固定术,术后患者生命体征平稳,原发病控制,符合SBT标准给予低水平PSV模式(PS:7 cmH2O,PEEP:3 cmH2O,FiO2∶0.3)行SBT试验,SBT进行20 min,患者呼吸频率由18次·min-1增至31次·min-1,心率由82次·min-1增至106次·min-1,SBT试验失败,7月14日 行SBT也失败,7月16日患者通过SBT试验,达到拔管指征,给予拔除气管插管,经鼻高流量给氧,3 h后患者突发呼吸困难,血氧饱和度进行性下降至81%,改为无创呼吸机辅助通气,S/T模式,IPAP:15 cmH2O,EPAP:3 cmH2O,FiO2∶0.3,无法改善患者症状,再次给予气管插管有创呼吸机辅助通气,模式P-A/C,f:15次·min-1,Pi:14 cmH2O,Ti:1 s,FiO2∶0.3。测患者气道阻力:7.2 cmH2O/(L·s),呼吸系统顺应性50.4 L/cmH2O,最大吸气负压(MIP):-8 cmH2O;膈肌超声显示膈肌位移0.92 cm,膈肌增厚率12.8%,提示患者膈肌功能障碍,给予呼吸神经肌肉刺激仪行呼吸神经刺激,膈肌和腹肌锻炼,每日3次,配合肢体功能锻炼,每日超声评估膈肌位移与膈肌增厚分数。7月17日植入食管气囊导管测量呼吸神经肌肉刺激仪使用前后的食道压和胃内压。7月18日患者每日3次下床坐位训练,每次30 min,根据患者情况逐步降低呼吸机支持力度。7月25日行经皮气管切开;拔除食管气囊导管。7月28日开始每日脱呼吸机,行呼吸机耐力训练,从2 h开始依次递增,非脱机状态呼吸机给予自主呼吸模式锻炼呼吸肌。8月1日患者膈肌位移2.48 cm,增厚分数为32.4%,停止呼吸神经肌肉刺激仪刺激。8月7日患者成功脱离呼吸机48 h,8月9日更换为金属气切套管,8月13日成功堵管,患者入院31天成功脱离呼吸机。
2 呼吸治疗评估与处理措施
2.1 呼吸治疗评估
2.1.1呼吸力学评估:7月16日患者二次插管后给予镇静肌松无自主呼吸状态下,评估患者气道阻力:7.2 cmH2O/(L·s),呼吸系统顺应性50.4 L·cmH2O-1。气道内可吸出大量白色黏痰。患者主动配合测出最大吸气负压(MIP):-8 cmH2O,患者有咳嗽努力,但无咳嗽动作,测其咳嗽峰流速30 L/min。
2.1.2肌力评估:四肢肌力测定,双上肢肢体肌力2级,双下肢肢体肌力1级。
膈肌肌肉评估,7月16日患者二次插管后采用超声行膈肌形态学评估:凸阵探头在B型模式下测量膈肌位移0.92 cm(见图1a),线阵探头在M型模式下测量不同时相下膈肌厚度:呼气相为1.25 mm、吸气相为1.41 mm,计算出DTF为12.8%,评估为膈肌功能障碍。7月17日经鼻置入食道压导管监测食道压和胃内压,计算出平静吸气下跨膈压-1.7 cmH2O,最大吸气跨膈压2.7 cmH2O,评估结果显示患者膈肌功能障碍。
2.1.3吞咽功能评估:吞咽功能评估在患者气管切开后进行,患者吞咽功能评为5级,吞咽功能较差。
2.2 呼吸治疗措施
2.2.1基础呼吸治疗措施:为预防呼吸机相关性肺炎(VAP)将患者床头抬高大于30°,人工气道气囊压力维持在25~30 cmH2O,每日行气流冲击法清除气囊上滞留物4次,振动排痰8 h进行1次,按需吸痰。
2.2.2肢体功能锻炼:每日3次肢体功能锻炼,依患者主动锻炼,包括肩外展、曲肘、伸髋、曲髋、伸膝、踝背伸等,每次2组,每组10次,每个关节活动做动作停留6~8 s。训练次数及强度依次递增,患者脱机时四肢可以抵抗外界阻力的运动,为4级。
2.2.3膈肌功能锻炼:采用北京雅果呼吸神经肌肉刺激仪行呼吸神经刺激,膈肌和腹肌锻炼,每日3次,每次10~15 min,刺激电流依次递增至为5~7 mA,刺激频率为40 Hz,刺激时间根据患者吸气时间确定,一般为1 s,刺激频率根据患者的呼吸频率设置,使用过程发放刺激冲动时嘱患者吸气,每次刺激前后行膈肌超声检查对比,膈肌位移和增厚分数均有不同程度的增加(见图1b、图2、图3所示)。同时在膈肌刺激前后行跨膈压监测,在刺激前测出胃内压10.9 cmH2O,食道压12.6 cmH2O,跨膈压为-1.7 cmH2O,最大吸气胃内压为14.8 cmH2O,最大吸气食道压为12.1 cmH2O,最大吸气跨膈压为2.7 cmH2O,刺激后测出胃内压16.4 cmH2O,食道压11.8 cmH2O,跨膈压为4.6 cmH2O,最大吸气胃内压为21 cmH2O,最大吸气食道压为8.6 cmH2O,最大吸气跨膈压为12.4 cmH2O,每次刺激前后行跨膈压监测,患者跨膈压有不同程度的增加(见图4)。
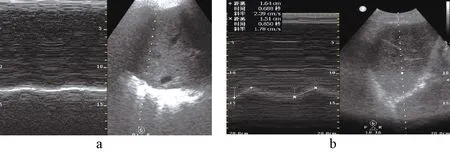
a刺激前膈肌位移;b刺激后膈肌位移

图2 每日呼吸神经肌肉刺激仪使用前后DTF变化
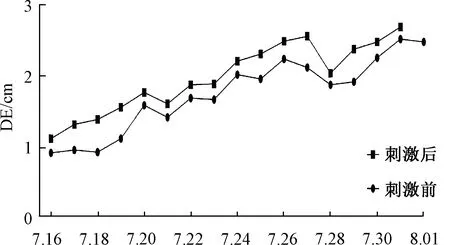
图3 每日呼吸神经肌肉刺激仪使用前后DE变化
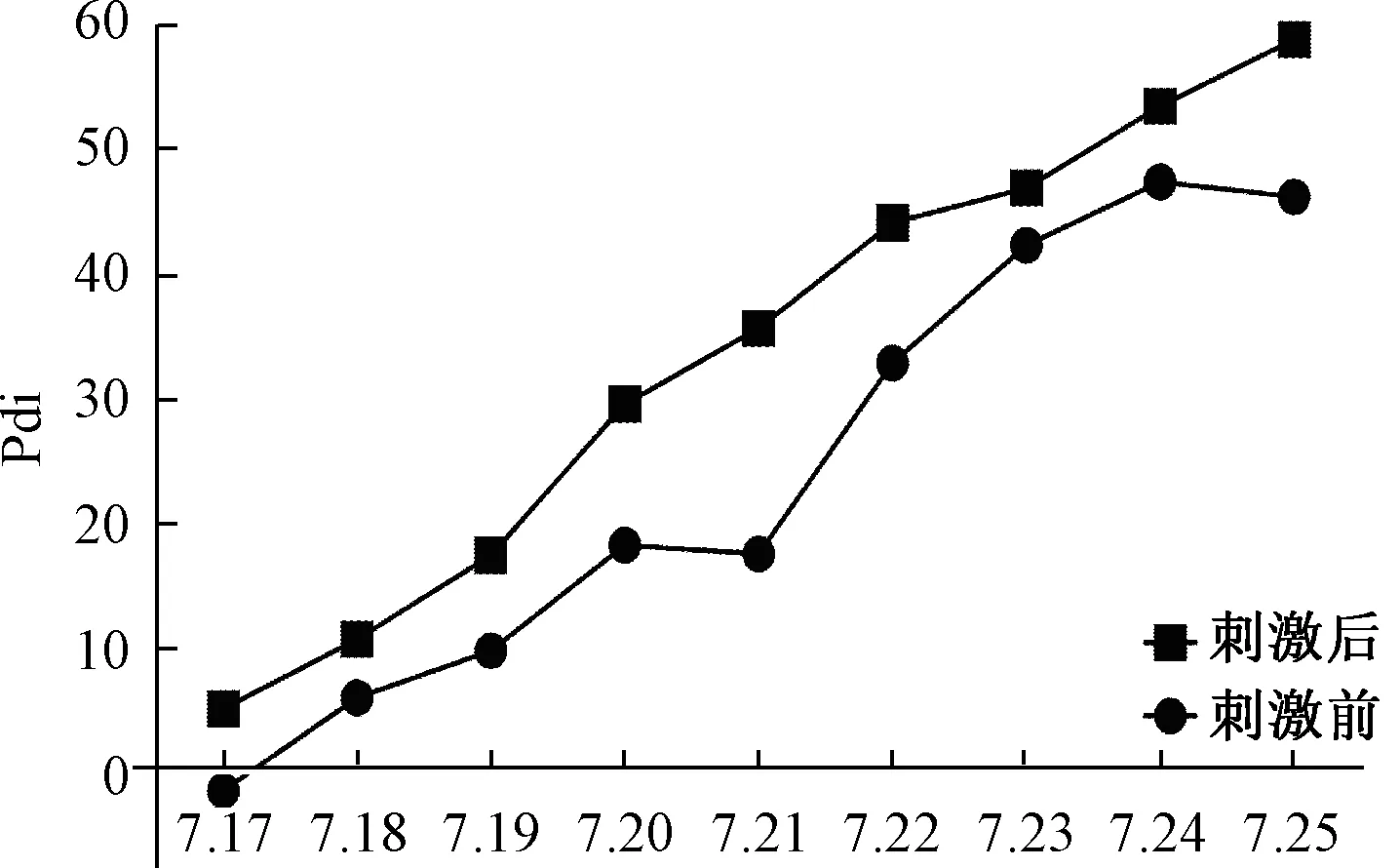
图4 每日呼吸神经肌肉刺激仪使用前后Pdi变化
2.2.4吞咽功能锻炼:气管切开后用冰棒刺激治疗和进食黏稠糊状食物锻炼吞咽功能,自制冰棒是采用一次性筷子缠绕纱布制成,浸泡葡萄汁或苹果汁后放冰箱急冻制成冰棒。让患者保持坐位,用冰棒在患者的腭弓、咽喉部轻轻滑动,不引起恶心、呕吐反应为宜。在使用有颜色饮品进行洼田饮水试验发现患者虽然不呛咳,但从气管切开吸痰时会发现饮品颜色的液体吸出,患者吞咽时依然会有少量误吸。
3 讨论
重症肌无力是一种主要累及神经肌肉接头突触后膜上乙酰胆碱受体(acetylcholine receptor,AChR),由AChR抗体介导、细胞免疫依赖、补体参与的自身免疫性疾病。约2/3的患者以眼外肌麻痹为首发表现,也可表现为延髓麻痹,症状逐渐向四肢发展[7]。大约3%~8%晚期重症肌无力患者累及呼吸肌肉会出现呼吸衰竭,可伴有重症肌无力危象[8]。国外也有以呼吸衰竭为首发症状的病例报道,约14%~18%的患者可以呼吸衰竭为首发症状[9]。重症肌无力危象是指由于肌无力加重而引起的严重呼吸困难状态,通常需要气管插管以行机械通气支持治疗[10]。其发展快,病情凶险,是常见急危重症之一。研究结果显示,医院感染(尤其是肺部感染)是重症肌无力患者并发呼吸衰竭的一个重要的危险因素,同时也是导致重症肌无力并发呼吸衰竭患者死亡的重要原因[11]。
ICU中气管插管行呼吸机治疗的患者,在脱机拔管前须行自主呼吸试验(spontaneous breathing trial,SBT)。SBT是指运用T型管或低支持水平的自主呼吸模式于有创通气患者,通过短时间(30~120 min)的动态观察,以评价患者是否能够耐受自主呼吸,是判断能否成功撤机较为可靠的手段。但临床上仍有部分患者在SBT试验通过后拔管失败,拔管失败的原因有呼吸肌负荷过重、咳痰无力、上气道梗阻、气道保护能力弱、过量呼吸道分泌物、脑病、脓毒症和心功能不全等[12]。拔管失败会带来较高的病死率。因此提高拔管成功率可以有效降低拔管患者的病死率。部分格林巴利综合征、重症肌无力、运动神经元病因已存在不同程度的膈肌功能障碍,在肺部感染控制后尝试SBT试验时,其他呼吸肌通过增加做功来维持正常潮气量,此时患者的膈肌功能障碍容易被掩盖[13]。然而,由于辅助呼吸肌的能力及耐力均远不及膈肌,辅助呼吸肌疲劳将可能在随后的数小时内发生。所以这类患者即使能够通过SBT试验,在随后的数个小时中也会再次病情恶化,脱机失败。
3.1 呼吸机依赖原因分析
机械通气是急性呼吸衰竭患者挽救生命的重要措施之一。然而,越来越多的患者在急性期生存下来会面临撤机困难,甚至无法撤机,出现呼吸机依赖[14]。据朱江等报道[15],患者出现呼吸机依赖发生率为13%~15.25%。在困难脱机的患者中尽管采取了各种干预措施,仍会出现呼吸机依赖,原因包括呼吸神经肌肉或呼吸系统疾病、急性呼吸道综合征的后遗症、并发的心功能障碍、瘫痪、ICU获得性衰弱综合因素[16-17]。研究显示,呼吸肌群疲劳或无力是导致撤机困难的主要因素,膈肌是人体呼吸的主要肌肉,在呼吸衰竭的病理生理过程中起着重要的作用[18-21]。研究表明,膈肌超声评估膈肌厚度变异率(DTF)小于20%提示患者存在膈肌功能障碍,对于膈肌麻痹,DTF检测灵敏度高,特异性低,而跨膈压≤0 cmH2O诊断膈肌麻痹萎缩特异性高[22],本例患者用药后肌无力症状改善,超声测量膈肌位移及膈肌增厚分数分别为1.4 cm,30.1%,提示肌无力引起的膈肌功能障碍恢复,7月16日二次插管后再次评估膈肌功能,膈肌超声提示膈肌位移0.92 cm,膈肌增厚分数为12.8%,跨膈压为-1.7 cmH2O,提示患者为呼吸机相关膈肌功能障碍。
3.2 肢体功能锻炼对脱机的影响
长时间住ICU或卧床的患者可导致肌肉功能障碍、免疫功能下降、呼吸机使用时间和住院时间延长等[23]。早期肢体运动有利于危重患者肌力恢复[24]。本例患者每天右上肢主动功能锻炼,同时右上肢辅助左上肢肢体活动。患者右上肢肌力恢复较好,帮助患者做精细动作,有助于肢体运动协调。
3.3 膈肌功能锻炼
膈肌是人体的主要呼吸肌肉,70%~80%的潮气量是由膈肌做功完成的。膈肌功能障碍可出现运动耐力下降、呼吸困难等,是呼吸衰竭发生的重要病理生理机制之一[25]。除神经肌肉损伤外,某些疾病,如:COPD、支气管哮喘等;药物应用,如糖皮质激素、镇静肌松剂等,机械通气等均可导致膈肌功能障碍[26],表现为通气功能的降低。早期膈神经刺激可预防或减轻机械通气所致膈肌功能障碍[27]。本例患者通过跨膈压测定确定为膈肌功能障碍-膈肌萎缩,在使用呼吸神经肌肉刺激仪行膈神经刺激有较好效果,患者在呼吸神经刺激仪刺激前后膈肌运动幅度、厚度及厚度变异率均有改善,同时患者跨膈压、最大吸气跨膈压与刺激强度成正相关。但7月28日患者膈肌位移,膈肌增厚分数及跨膈压较前均有小幅度下降,这可能与第一天脱机导致膈肌疲劳有关系,此时将呼吸机支持力度改为辅助控制通气模式,提高呼吸机支持力度,缓解疲劳,第2天脱机前改为自主呼吸模式适应后予以脱机锻炼,预防患者再次疲劳,脱机时间依然为2 h,患者适应后膈肌功能指标稳定后依次递增脱机时间,8月5日开始彻底脱离呼吸机辅助通气,8月7日成功脱离呼吸机48 h。这说明患者在首次脱机锻炼时要及时观察患者有无膈肌疲劳表现,可在脱机前测量膈肌增厚分数与脱机过程中的增厚分数相比较,如有增厚分数下降应考虑患者是否出现呼吸机疲劳,其次可以通过动脉血气中的PaCO2评估患者是否有呼吸肌肉疲劳,锻炼过程中增加血气分析的检测次数,发现PaCO2上升说明患者出现呼吸肌肉疲劳;同时应注意患者的生命体征如心率、呼吸、血压等,变化不超过基础值的30%为宜。首次脱机训练,应在患者适应后再逐渐增加脱机时间,避免膈肌再次疲劳事件发生。
综上所述,膈肌功能障碍是机械通气常见而严重的并发症之一,及时评估脱机指征是减少并发症、降低患者死亡率、提高生存率的关键,正确评估患者膈肌功能障碍的原因,以及适当的通气模式和锻炼方式,选择合理的时机循序渐进脱机,最终才可以成功脱机。
