城市生活垃圾热处理中氯元素转化的热力学平衡分析
2021-03-15何祺东马晓茜王耀汉唐玉婷陈晓斌
何祺东,马晓茜,王耀汉,唐玉婷,陈晓斌
(华南理工大学 电力学院,广东 广州 510641)
经济发展使垃圾产生量日益增加,垃圾无害化、资源化处理是当务之急[1]。Cossu[2]认为热处理方法符合环保趋势。焚烧具有无害化处理率高、减量化大和可资源化利用等优点[3]。而热解相对于焚烧,更能实现清洁、高效处理[4]。
李季等[5]对垃圾焚烧时氯转化规律进行了模拟分析;Ma等[6]对垃圾焚烧时氯转化规律进行了实验研究;任强强等[7]对垃圾、秸秆混合热解时氯的析出特性进行了实验研究;Zhu等[8]采用热重红外联用技术对PVC在热解时加入Ca基脱氯剂的HCl脱除效果进行了实验研究;Yang等[9]对垃圾焚烧产物中的氯化物等有害物质在水洗工艺下的脱除效果进行了实验研究。已有大量针对垃圾在常规空气焚烧中氯转化或脱除的研究,但氯转化规律与热利用方式、气氛以及吸附剂的联系尚处于探索阶段。因此,本文利用化学热力学软件FactSage模拟MSW热处理过程,探究燃烧气氛、温度、过量空气系数及脱氯剂对氯转化规律的影响。
1 热力学平衡分析原理与方法
各物质的热力学参数来自FactSage的热力学数据库:FactPS、FToxid、FTmisc和FTpulp[10]。在FactSage的Equilib模块中输入初始反应物的种类和组成(包括燃烧气氛转化为元素组成来输入)、反应温度范围、反应压力,以Gibbs自由能最小法为判据,假定反应停留时间足够长,系统达到平衡时输出数据。并选择所需研究的元素占该元素原始输入量≥1%的数据,输出及记录。为研究脱氯剂的脱氯效果,分别加入5%CaO、10%CaO、15%CaO、5%CaCO3、10%CaCO3、15%CaCO3。
1.1 垃圾的元素组成
由于垃圾中的有机氯来源主要为PVC,故先对一组PVC样本[5]进行模拟。并选取华南某市的MSW样本1[11]和华东某市的MSW样本2[12]为研究对象。数据处理为符合输入Equilib的干燥基,再计算成每千克的摩尔值后列入表1。

表1 模拟样本组成Table 1 Composition of simulated sample
1.2 反应气体的组成、压力和温度
反应气体的组成如下:(1)空气气氛:近似为O2∶N2=2∶8;(2)富氧气氛:O2∶CO2=2∶8、O2∶CO2=2.5∶7.5、O2∶CO2=3∶7、O2∶CO2=3.5∶6.5;(3)热解气氛:纯N2。PVC样本的过量空气系数取α=0,0.4,0.8,1,1.2,1.6,1.8。MSW样本1和MSW样本2的过量空气系数取α=1.6。反应压力取101 325 Pa。 反应温度取300~1 100 ℃,以100 ℃为区间选取数据。
2 热力学平衡计算结果与分析
2.1 PVC热平衡计算结果
由图1中PVC样本的模拟结果可知,当α<1时,HCl中的氯约占输入值的90%,3条曲线基本重合,且维持在同一水平;而当α≥1时,在600 ℃前随温度提高HCl含量从较低水平明显升高,在800 ℃后,几乎全部转化成HCl。过量O2会将HCl中的Cl-氧化成Cl2;高于某一温度后,氯完全转化为HCl,与李季等[5]研究结果基本吻合。

图1 空气气氛下不同过量空气系数时HCl与输入氯的摩尔比Fig.1 Molar ratio of HCl to input chlorine in different excess air ratio under air atmosphere
2.2 MSW热平衡计算结果
2.2.1 不同气氛下热处理氯转化规律 由图2中针对MSW样本1的模拟结果可知,空气气氛下,Cl2(g)在500 ℃前占一定比例,并随温度升高转化成HCl;Cl2在温度高于500 ℃时,基本全转化成HCl,HCl在超1 000 ℃时分解出现少量Cl(g)。两个MSW样本在空气气氛下,氯的产物与输入氯比值的变化规律基本一致。但MSW样本2模拟结果中HCl含量在低温时要高些,Cl2的含量要低些。
由图3中针对MSW样本1的模拟结果可知,富氧气氛下,在600 ℃前,HCl中氯占输入值的比值由75%左右增长到接近100%,600 ℃后,几乎全转化为HCl,规律与空气气氛类似;但富氧燃烧在较低温度时,HCl含量较空气要低,且O2比例越高,HCl含量越低,这与大量O2把Cl-氧化有关系。在全部实验温度范围内,氯在热解气氛下几乎全转化为HCl,这是因为热解气氛缺氧,无法将Cl-氧化成Cl2。对较高温的区域,如过热器烟道,如果没提前做好脱氯工作,会造成烟道金属高温腐蚀问题[13]。两个MSW样本在不同气氛下,HCl与输入氯比值的变化规律基本一致。但MSW样本2模拟结果中,HCl含量在低温时要高些,氯完全转化为HCl的温度低;非热解气氛下,HCl在高温时有少许分解,可忽略不计。

图2 空气气氛下氯的产物与输入氯的摩尔比Fig.2 Molar ratio of chlorine product to input chlorine under air atmosphere
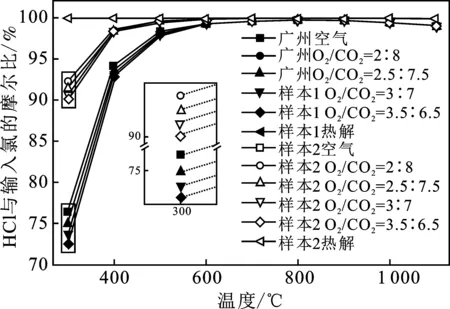
图3 不同气氛下HCl与输入氯的摩尔比Fig.3 Molar ratio of HCl to input chlorine under different atmosphere
2.2.2 常规燃烧时添加剂对氯转化规律的影响 由图4中针对MSW样本1的模拟结果可知,脱氯剂在低于800 ℃时效果明显,氯主要以CaCl2(s)的形式存在。随温度升高,吸收能力下降,HCl含量升高;600 ℃后,部分CaCl2生成CaO(CaCl2)4(s),温度继续提高才分解为HCl。脱氯剂在高于800 ℃时完全失效,低温脱氯效果明显,与李季等[5]得到的研究规律相似。
由图4中针对MSW样本2的模拟结果可知,Cl2在500 ℃前缓慢转化成HCl,500 ℃后基本全转化成HCl;输入的钙元素几乎都以CaSO4的形式存在,而输入碳则基本以CO2的形式存在。MSW样本2脱氯效果较差,可实施脱氯的温度范围变窄,大大减小了可脱氯的操作空间。这是因为MSW样本1元素组成中硫含量为0.266 mol/kg,远低于MSW样本2中硫含量为6.57 mol/kg;硫和氯会就与CaO结合形成竞争关系,CaO中的钙离子优先与硫结合;MSW样本2的硫含量高,趋于发生脱硫反应,抑制脱氯效果。

图4 空气气氛下5%CaO,氯的产物与输入氯及CaSO4与输入钙的摩尔比Fig.4 Molar ratio of chlorine product to input chlorine and CaSO4 to input calcium when adding 5% CaO under air atmosphere
由图5中针对MSW样本1的模拟结果可知,空气气氛下以脱氯剂种类为变量的规律曲线很接近,两类脱氯剂的效果在低于800 ℃时较明显,随温度上升而减弱,高于800 ℃时完全失效。CaO的吸附能力相对CaCO3较好,但同种脱氯剂不同剂量效果差别不大,15%CaO的效果最好。MSW样本2空气气氛下脱氯效果并不明显,HCl与输入氯的摩尔比在空气气氛下有无脱氯剂的变化规律基本一致。

图5 空气气氛下脱氯剂剂量不同时HCl与输入氯的摩尔比Fig.5 Molar ratio of HCl to input chlorine when adding different addition ratio of dechlorinating agent under air atmosphere
2.2.3 不同气氛热处理添加剂对氯转化规律的影响 由图6中针对MSW样本1的模拟结果可知,不同气氛下脱氯效果随着温度的走势相似,氯在600 ℃(富氧)或800 ℃(空气)后基本转化为HCl。富氧气氛下,HCl的整体含量比空气和热解都要高,脱氯效果较热解要弱,为探究其原因,分别对不同气氛下CaCO3的含量和Ca的迁移转化(图7)进行模拟。
由图7中针对MSW样本1的模拟结果可知,富氧气氛下,CaCO3含量比空气高,较高温度时,也比热解高;富氧气氛中CO2比例减少,CaCO3含量也减少。这是因为富氧气氛下大量CO2与脱氯剂结合生成CaCO3,抑制脱氯效果。空气和富氧气氛下,CaSO4的含量远大于热解,消耗了大部分脱氯剂中的钙离子,恰好反映了低温热解时为什么图7中CaCO3含量大,但图6中却脱氯效果好。这是因为热解缺氧,无法把硫元素氧化成S6+与脱氯剂结合生成CaSO4,提升脱氯效果。

图6 不同气氛下5%CaO,HCl与输入氯的摩尔比Fig.6 Molar ratio of HCl to input chlorine when adding 5% CaO under different atmosphere

图7 不同气氛下5%CaO,钙的产物与输入钙的摩尔比Fig.7 Molar ratio of calcium product to input calcium when adding 5% CaO under different atmosphere
由图6中针对MSW样本2的模拟结果可知,空气和富氧气氛下,脱氯效果并不明显,热解气氛下脱氯剂在低于500 ℃时有一定吸附效果,MSW样本2在热解气氛下的效果也远不如MSW样本1,适宜的温度范围也大幅缩小。其原因在分析图4时已提到,MSW样本2中硫含量远大于MSW样本1,CaO中的钙离子优先与硫结合,抑制脱氯效果。
由图7中针对MSW样本2的模拟结果可知,空气或富氧气氛下硫元素氧化生成大量CaSO4,而热解缺氧,绝大部分钙离子生成CaS(MS-c#1)(固溶体);有少量钙离子在500 ℃前可与氯结合生成氯化钙,证明了图6中MSW样本2模拟结果,为什么只有在低于500 ℃的热解气氛下脱氯有明显效果。钙离子在高于500 ℃时全部转化为CaS,脱氯剂失效,CaS也由于缺氧而未能向CaSO4转化。
由图8中MSW样本2的模拟结果可知,热解气氛下以脱氯剂为变量的规律曲线基本一致,脱氯效果在低于500 ℃时效果明显,随温度增加减弱,500 ℃后完全失效。CaO的吸附能力比CaCO3好,但同种脱氯剂不同剂量效果差别不大,15%CaO的效果最好。
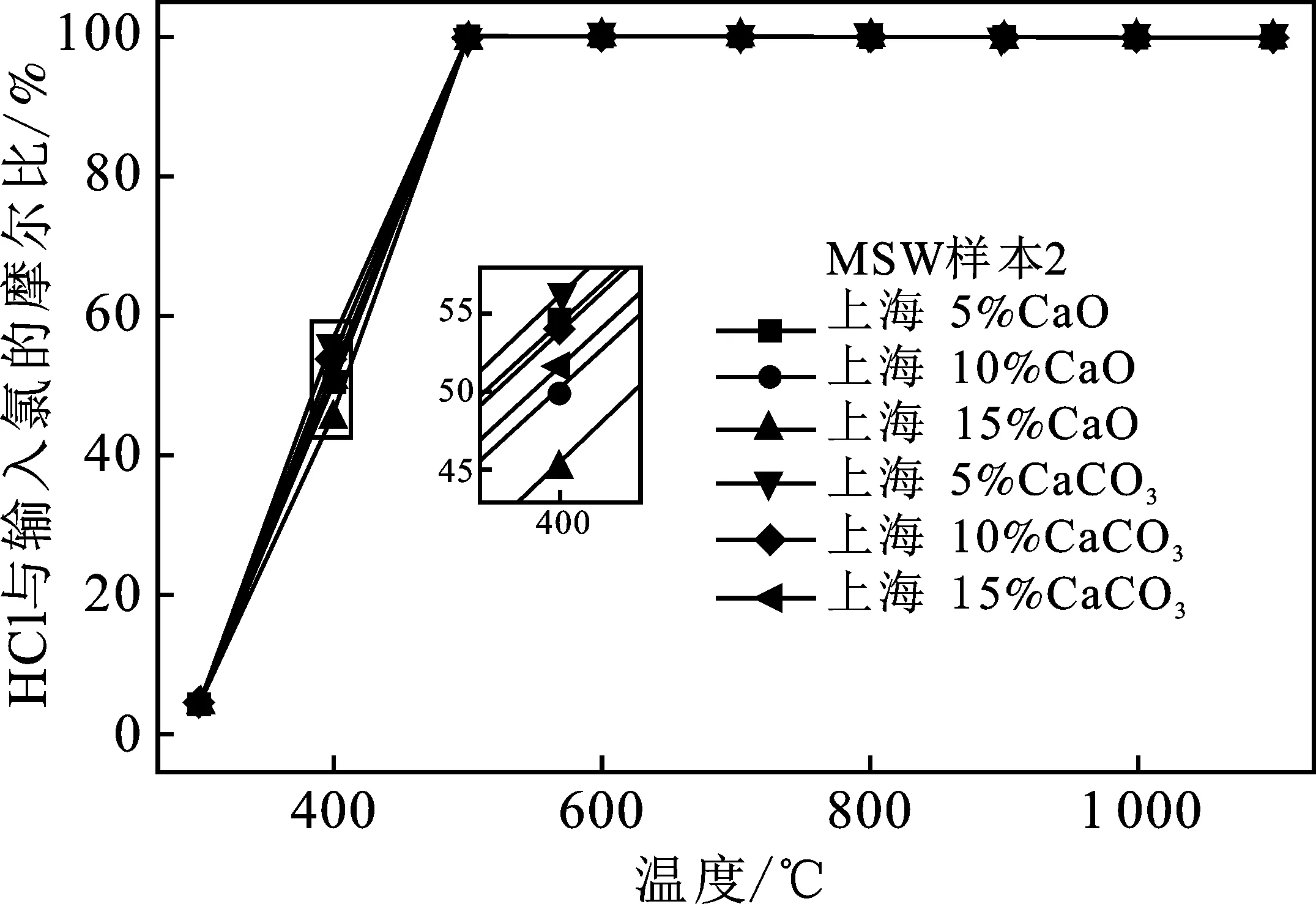
图8 热解气氛下脱氯剂剂量不同时HCl与输入氯的摩尔比Fig.8 Molar ratio of HCl to input chlorine when adding different addition ratio of dechlorinating agent under pyrolysis atmosphere
3 结论
(1)MSW在空气或富氧气氛下焚烧时,低温时,氯元素的主要产物为Cl2和HCl,其中富氧气氛下,O2含量越高,低温段生成的Cl2越多,而HCl越少;超过一定温度后,全部转化成HCl的形式,这一温度节点会随着垃圾的具体组分不同而变化;与MSW样本2相比,MSW样本1在低温焚烧时,Cl2含量高,而HCl含量少,全部转化成HCl的温度节点高一些。因缺氧无法将Cl-氧化成Cl2,在全实验温度范围内热解,氯元素几乎全部转化为HCl。
(2)超过一定温度(不同工况下400~800 ℃)时,受CaCl2本身的热稳定性影响,CaO或CaCO3的脱氯剂丧失效果。脱氯剂的效果:CaO>CaCO3;15%>10%>5%;热解>空气>富氧气氛。因为富氧时大量的CO2与脱氯剂中的Ca2+结合,形成CaCO3,O2含量越少,脱氯效果越好;空气或富氧气氛下,O2将组分中的硫元素氧化成S6+结合形成CaSO4,抑制脱氯效果,而热解气氛下,则因缺氧,还原成S2-结合生成CaS。脱氯效果与垃圾组分有关,本次模拟计算中MSW样本2中含有远多于MSW样本1的硫元素,硫元素氧化生成CaSO4,抑制脱氯效果,故MSW样本1脱氯效果优于MSW样本2,适宜脱氯温度范围较广。热处理过程中,在低温范围内添加一定高剂量的脱氯剂会达到良好的效果。
