新疆紫草不同极性提取部位体外抗氧化活性研究
2021-03-15侯亚申吉腾飞王小青康莹莹李建光
侯亚申,李 敏,许 芳,吉腾飞,王小青,康莹莹,李建光
(1新疆医科大学药学院,乌鲁木齐830011;2中国医学科学院药物研究所,北京100050)
自由基是一类具有强氧化性带电的分子或基团,机体中主要有超氧阴离子(O2-)、OH-、H2O2、脂质过氧化物(RO-、ROO-与ROOH)等[1]。自由基可直接作用于蛋白质,改变其功能与结构、攻击DNA组成结构的碱基或五碳糖,引起DNA断裂,引发细胞膜脂质过氧化,破坏细胞膜的结构[2-4]。研究表明大量的自由基堆积是导致机体衰老、肿瘤和心脑血管疾病发生与发展的主要原因之一,抗氧化物质的使用能使体内自由基的产生和消除处于平衡状态,从而预防和治疗一些疾病[5]。新疆紫草[Arnebia euchroma(Royle)Johnst.]又名新疆软紫草,为紫草科(Boraginaceae)多年生草本植物。研究发现新疆紫草具有较好的抗氧化、抗菌、抗炎、抗病毒、抗肿瘤及保肝和免疫调节等功效[6-10],新疆紫草不同极性萃取部位可有效清除自由基,抑制脂质过氧化[11]。本实验采用5种体外抗氧化活性检测方法,测定新疆紫草不同极性提取部位的抗氧化活性,现报道如下。
1 材料与方法
1.1 仪器GO-1510型全波长酶标仪(赛默飞世尔(中国)仪器有限公司),ML-204型精密天平(瑞士梅特勒-托利多仪器有限公司),KDC-2044型低温冷冻离心机(安徽中科中佳科学仪器有限公司),R-100型旋蒸仪(郑州长城科工贸有限公司),WB-2000型水浴锅(郑州长城科工贸有限公司),SHB-III型循环水多用真空泵(郑州长城科工贸有限公司)。
1.2 试药蛋黄卵磷脂(北京索莱宝科技有限公司,批号123D021)、鲱鱼精DNA(北京索莱宝科技有限公司,批号917E041)、苯代苦味肼自由基(DPPH·,北京索莱宝科技有限公司,批号821T021)、偶氮二异丁脒盐酸盐(AAPH,北京索莱宝科技有限公司,批号116G021)、2,4,6-三吡啶基-S-三嗪(TPTZ北京索莱宝科技有限公司,批号404E023)、2-硫代巴比妥酸(TBA,北京索莱宝科技有限公司,批号827M031),二甲基亚砜(DMSO,北京索莱宝科技有限公司,批号710N031),维生素C(VC,北京索莱宝科技有限公司,批号1221T031)、水杨酸(北京索莱宝科技有限公司,批号314C052)、硫酸亚铁(FeSO4,北京索莱宝科技有限公司,批号20190211))、醋酸钠(北京索莱宝科技有限公司,批号20190506)、无水三氯化铁(上海麦克林生化科技有限公司,批号I828300)、浓盐酸(天津永晟精细化工有限公司,批号20150321)、冰醋酸(天津市富宇精细化工有限公司,批号121217)、三氯乙酸(TCA,天津永晟精细化工有限公司,批号20170328)、过氧化氢(天津益力化学试剂有限公司,批号20170182)、盐酸胍(北京索莱宝科技有限公司,批号429V021)、石油醚(60~90℃,天津益力化学试剂有限公司,批号20190308)、乙酸乙酯(天津益力化学试剂有限公司,批号20190811)、无水乙醇(天津益力化学试剂有限公司,批号20190104)。
1.3 实验动物雄性SD大鼠8只,体质量(180±20)g,新疆医科大学动物实验中心提供,实验动物许可证号:SCXK(新)2018-0003,饲养于温度22~25℃、湿度50%~80%的IVC清洁级环境中,自由进食饮水。
1.4 药材新疆紫草2018年2月购于亳州市华云中药饮片有限公司,批号:171102),经新疆医科大学药学院天然药物化学教研室帕丽达·阿不力孜教授鉴定为紫草科植物新疆紫草(Arnebia euchroma(Royle)Johnst.)的干燥根。
1.5 新疆紫草不同极性提取部位的制备称取新疆紫草1.0 kg,粉碎,加10倍体积石油醚(60~90℃)室温浸泡8 h,过滤,重复3次,合并滤液,35℃减压浓缩后获新疆紫草石油醚提取部位(APE,得率为4.40%);将上述滤渣干燥后,依次加10倍体积95%乙醇、50%乙醇和纯化水,加热提取2 h,过滤,重复3次,分别合并滤液,45℃减压浓缩干燥,既得95%乙醇部位(AEE-95%,得率为4.29%)、50%乙醇部位(AEE-50%,得率为2.10%)和水提部位,得率为3.33%;水提部位按体积比1∶3加95%乙醇沉淀,静置1 h后过滤,室温干燥,获得水提醇沉部位(AWE,得率为2.56%);将醇溶部位,50℃减压浓缩干燥获水提醇沉醇溶部位(AWW,得率为0.68%)。
1.6 新疆紫草不同极性提取部位清除DPPH·能力和抑制OH-生成测定
1.6.1 清除DPPH·能力测定 2 mL离心管中加入无水乙醇0.1 mL和0.04 mg/mL的DPPH·溶液0.2 mL,充分混匀后,避光反应30 min,在516 nm下测定吸光度A0;将0.1 mL无水乙醇换成0.1 mL系列样品溶液同法测定吸光度A1;将0.2 mL DPPH·溶液换成0.2 mL样品溶液同法测定吸光度A2,每个浓度测定3次,取平均值作为试验数据,以VC为阳性对照品[12]。依据公式计算抑制率S%[S%=(1-(A1-A2)/A0)×100%],根据浓度-抑制率关系拟合线性方程并计算半数抑制率S50(µg/mL),S50越小表明抗氧化活性越强。
1.6.2 抑制OH-生成测定 于2 mL离心管中加入9 mmol/L的FeSO4溶液0.5 mL、9 mmol/L的水杨酸-乙醇溶液0.5 mL和1 mL纯化水,室温孵育5 min后,加入8.8 mmol/L的H2O20.25 mL启动反应,室温避光反应30 min后于510 nm处测量吸光度A0,将纯化水换成样品溶液,同法测定吸光度A1;将H2O2换成样品溶液同法测定吸光度A2,每个浓度测定3次,取平均值作为试验数据,VC作为阳性对照[13]。依据公式计算抑制率S%[S%=(1-(A1-A2)/A0)×100%],根据浓度-抑制率关系拟合线性方程并计算半数抑制率S50(mg/mL),S50越小表明抗氧化活性越强。
1.7 新疆紫草不同极性提取部位铁离子还原能力测定(FRAP法)
1.7.1 FeSO4标准曲线的绘制 称取FeSO4·7H2O 27.81 mg,加纯化水定容至100 mL容量瓶中,并置入光亮铁钉1枚制备浓度为1.0 mmol/L母液,稀释母液制备浓度分别为0.2、0.4、0.6、0.8、1.0 mmol/L系列浓度FeSO4标准溶液;称取32.40 mg无水氯化铁,纯化水定容至10 mL容量瓶中,制备浓度为20 mmol/L的氯化铁溶液;称取2.46 g醋酸钠,加4 mL冰醋酸,纯化水定容至100 mL容量瓶中,浓盐酸调节pH值等于3.6,制备浓度为0.3 mol/L的醋酸钠缓冲溶液;称取31.23 mg TPTZ,加浓度为40 mmol/mL的盐酸溶液定容至10 mL容量瓶中,制备浓度为10 mmol/L的TPTZ溶液;将5 mL氯化铁溶液、100 mL醋酸钠缓冲溶液和5 mL TPTZ溶液混合后制备FRAP工作液。取10µL系列浓度FeSO4标准溶液,200µL 37℃预热的FRAP工作液,混匀,37℃水浴避光反应10 min,于593 nm处测定吸光度A1,无水乙醇做空白对照测定吸光度A0[14]。以FeSO4物质量浓度为横坐标(X),吸光度为纵坐标(Y),计算回归方程为Y=0.601 9X-0.000 1,r2=0.998 2,FeSO4浓度在0.2~1.0 mmol/L范围内线性关系良好。
1.7.2 新疆紫草不同极性提取部位FRAP值测定 取10µL浓度分别为0.2、0.4、0.6、0.8、1.0 mg/mL的样品溶液,200µL 37℃预热的FRAP工作液,混匀,37℃水浴避光反应10 min,于593 nm处测定吸光度A1,样品溶液作自身对照测定吸光度A2,无水乙醇做空白对照测定吸光度A0。根据同一浓度各样品(1 mg/mL)反应后的吸光度在标准曲线上对应FeSO4的浓度(mmol/L),即FRAP值,FRAP值越大表示抗氧化活性越强。每个浓度测定3次,取平均值作为试验数据,以VC为阳性对照品。
1.8 AAPH诱导蛋黄卵磷脂和DNA氧化损伤后MDA含量测定
1.8.1 AAPH诱导蛋黄卵磷脂氧化损伤后MDA含量测定 2 mL EP管中加入8 mg/mL的蛋黄卵磷脂溶液0.6 mL和0.2 mL纯化水,37℃水浴10 min后加入200 mmol/L AAPH溶液0.2 mL,混匀37℃水浴4 h,加入0.25 g/mL的TCA溶液0.4 mL沉淀蛋黄卵磷脂,室温静置10 min后10 000 r/min离心10 min,取上清液1.3 mL加15 mg/mL的TBA工作液0.2 mL于95℃水浴中反应15 min,取出后置于冰水中冷却5 min,于351 nm处测定吸光度A0,将纯化水换成样品溶液,同法测定吸光度A1,每个浓度测定3次,取平均值作为试验数据,VC作为阳性对照[15]。依据公式计算抑制率S%=(A0-A1)/A0×100%,根据浓度-抑制率关系拟合线性方程并计算半数抑制率S50,S50越小表示抗氧化活性越强。
1.8.2 AAPH诱导DNA氧化损伤后MDA含量测定2 mL EP管中加入5 mg/mL的DNA溶液0.4 mL和0.4 mL纯化水,37℃水浴10 min后加入200 mmol/L的AAPH溶液0.4 mL,混匀后37℃水浴4 h,加入0.25 g/mL的TCA溶液0.4 mL沉淀DNA,静置10 min后10 000 r/min离心10 min,吸取上清液1.2 mL加15 mg/mL的TBA工作液0.15 mL于95℃水浴中反应15 min,冰水中冷却5 min后加0.5 mL正丁醇萃取,静置5 min吸取正丁醇部位于532 nm处测定吸光度A0;将纯化水换成样品溶液,同法测定吸光度A1,每个浓度测定3次,取平均值作为试验数据,VC作为阳性对照[15]。依据公式计算抑制率S%=(A0-A1)/A0×100%,根据浓度-抑制率关系拟合线性方程并计算半数抑制率S50,S50越小表示抗氧化活性越强。
1.9 新疆紫草不同极性提取部位抑制红细胞溶血能力测定取一只大鼠,颌下静脉丛取血3~5 mL于EDTA-2Na的抗凝血管中,1 500 r/min 4℃离心5 min,弃血清,2倍体积生理盐水重悬下层红细胞,重复洗涤3次,1 500 r/min离心10 min,用生理盐水稀释成体积分数为10%红细胞悬液。在2 mL EP管中依次加入0.1 mL红细胞悬液和0.1 mL生理盐水,37℃水浴10 min,加入200 mmol/L的AAPH溶液0.2 mL,37℃水浴3 h后2 500 r/min离心10 min,取上清液于540 nm处测定A0值;以生理盐水代替样品溶液同法测定吸光度值A1,每个浓度测定3次,取平均值作为试验数据,VC作为阳性对照[16]。依据公式计算抑制率S%[S%=(A0-A1)/A0×100%],根据浓度-抑制率关系拟合线性方程并计算半数抑制率S50,S50越小表示抗氧化活性越强。
2 结果
2.1 新疆紫草不同极性提取部位清除DPPH·和抑制OH-能力AEE-95%、AEE-50%和AWW清除DPPH·的S50低于APE、ARC、AWE,其中AEE-50%清除能力最强(S50=56.24µg/mL),ARC的清除能力最弱(S50=684.43µg/mL),两者S50值相差12.2倍。极性较小的APE、ARC、AEE-95%和AWE抑制OH-生成能力的S50低于AEE-50%和AWW,其中ARC的抑制能力最强(S50=0.84 mg/mL),AWW抑制能力最弱(S50=4.00 mg/mL),两者S50值相差4.8倍。清除DPPH能力 :VC>AEE-50%>AWW>AEE-95%>AWS>APE>ARC;抑制OH-生成能力:VC>ARC>APE>AWE>AEE-95%>AEE-50%>AWW,见表1。
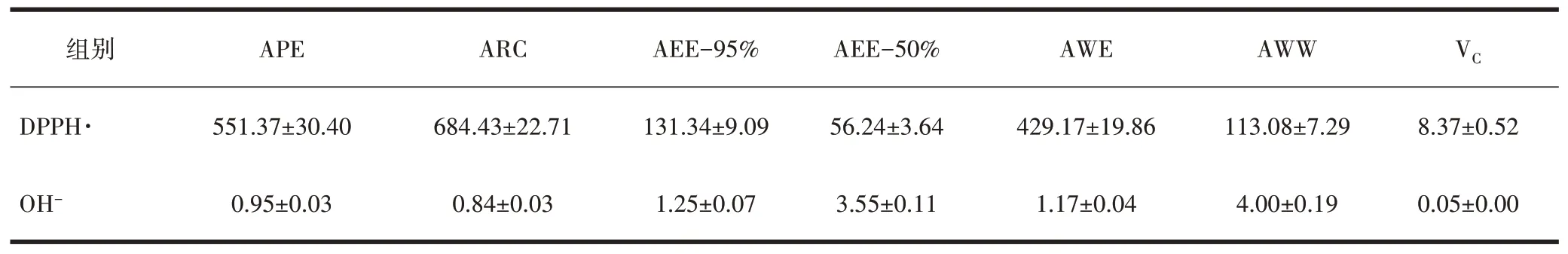
表1 新疆紫草不同极性提取部位清除DPPH·S50(μg/mL)和抑制OH-的S50/(mg/mL)
2.2 新疆紫草不同极性提取部位还原铁离子能力AEE-95%、AEE-50%和AWW的FRAP值高于APE、ARC和AWE,其中AEE-50%还原能力最强(FRAP=1.53 mmol/L),APE还原能力最弱(FRAP=0.43 mmol/L),前者还原能力是后者的3.6倍。还原能力 :VC>AEE-50%>AWW>AEE-95%>AWE>ARC>APE,见表2。

表2 新疆紫草不同极性提取部位的FRAP值/(mmol/L)
2.3 新疆紫草不同极性提取部位抑制蛋黄卵磷脂和DNA氧化损伤能力VC、APE和ARC对蛋黄卵磷脂氧化损伤无保护作用,低浓度的APE和ARC可促进蛋黄卵磷脂氧化损伤,AEE-50%抗氧化损伤能力最强(S50=0.69 mg/mL),其S50低于AWE、AEE-95%和AWW;APE和ARC对DNA氧化损伤无保护作用(抑制率S%<10%),其余提取部位均具有一定保护力,AEE-50%和AWW抗DNA氧化损伤能力(S50分别为0.84 mg/mL和0.86 mg/mL)强于AEE-95%和AWE(S50分别为2.66 mg/mL和1.06 mg/mL),见表3。
2.4 新疆紫草不同极性提取部位抑制红细胞溶血能力AEE-95%、AEE-50%、APE、ARC抑制溶血能力的S50低于AWE和AWW,AEE-95%抑制率最强(S50=3.12µg/mL),AWE抑制率最弱(S50=332.62µg/mL),两者S50值相差106.5倍。抑制溶血能力:AEE-95%>AEE-50%>VC>APE>ARC>AWW>AWE,见表4。

表3 新疆紫草不同极性提取部位抑制蛋黄卵磷脂和DNA氧化损伤的S50/(mg/mL)

表4 新疆紫草不同极性提取部位抑制抑制红细胞溶血S50/(µg/mL)
3 讨论
新疆紫草含有大量的脂溶性色素类化合物,主要有羟基萘醌类和苯醌类化合物;水溶性化合物主要有酚酸类化合物、黄酮类化合物、多糖和糖蛋白等[17]。本实验首次采用五种体外抗氧化检测方法,分别从离子、生物分子和细胞层面对新疆紫草不同极性提取部位的抗氧化能力进行检测。试验结果表明,新疆紫草不同极性提取部位在不同的体外抗氧化模型中具有不同的抗氧化特点,其原因可能与不同的提取部位因化合物种类及含量有较大差异,通过影响不同的抗氧化指标发挥抗氧化活性有关,其机制需进一步探究。
