3D打印PLA-nHA复合支架膜在犬牙周组织再生中的应用
2021-03-15刘佳怡马春丽汪振华
刘佳怡,王 媛,马春丽,王 卓,汪振华
(乌鲁木齐市口腔医院修复科,乌鲁木齐830002)
3D打印技术为临床上解决个性化的骨缺损和缺失的修复提供了新的思路和方法。3D打印聚乳酸(polylactic acid,PLA)-纳米羟基磷灰石(nanohydroxyapatite,nHA)复合支架材料应用于人体或动物实验的成骨性研究,取得了较为理想的效果,但是关于PLA与nHA的浓度配比还存在争议[1]。引导组织再生术(guided tissue regeneration,GTR)是目前临床上治疗牙周组织缺损的主要手段和方法,然而对于GTR术屏障膜种类的使用仍然存在争议。现阶段较多学者提倡在临床中应用以胶原膜为代表的可吸收膜作为GTR屏障膜,但胶原膜存在降解时间不可控、易浪费、成本高等问题。本课题组在前期实验中已通过3D打印技术打印出不同比例的PLA-nHA复合支架膜,并对不同比例支架膜的理化性能进行研究[2]。本研究是在课题组前期研究的基础上,对3D打印的不同比例的PLA-nHA复合支架膜进行细胞毒性检测,并将无明显细胞毒性的PLA-nHA复合支架膜植入牙周病犬实验区,利用该膜对牙周病犬模型进行GTR手术,并在术后进行组织学检测,探究不同比例3D打印PLA-nHA复合支架膜在组织工程领域中的成骨性能,观察牙周病动物口腔组织修复效果,为骨组织材料的改良提供更多的实验依据。
1 材料与方法
1.1 实验动物与材料实验动物:比格犬(Beagle)6只,雄性,1周龄,12 kg左右。购于青岛博隆实验动物有限公司,生产许可证号SCXK(鲁)20170006。实验材料:胶原膜(海奥口腔修复膜,烟台正海生物科技股份有限公司,B型,平均厚度:0.30~0.69 mm,规格:1.5 cm×2 cm);PLA(山东济南贷罡生物工程有限公司);n-HA(南京埃普瑞纳米材料有限公司);3D打印成型机(由新疆大学机械工程学院自主搭建);牙周探针(上海康桥);台式低速离心机(湖南赫西仪器装备有限公司)全自动组织脱水仪(天津爱华医疗器械有限公司);包埋仪(天津爱华医疗器械有限公司)切片机(德国SLEE)光学显微镜(上海佑科仪器仪表有限公司);小鼠成纤维细胞L-929(山东国际生物科技园提供);培养瓶、离心管、96孔细胞培养板(COSTAR);RPMI1640细胞培养液、胎牛血清(hyclone);MTT、PBS、DMSO、胰蛋白酶(solarbio);生物安全柜、低温高速离心机、CO2培养箱(thermo scientific);全自动酶标仪(BioTek)。
1.2 实验方法
1.2.1 3D打印不同浓度PLA-nHA复合支架膜 首先利用CAD软件设计支架材料,分别按照不同PLA∶nHA比例称量,与15%聚乙烯醇凝胶(polyvinyl alcohol gel,PVA)按l g∶l.6 mL的比例混匀,装入打印成型机内,调整打印速率及打印喷头并在熔融沉积造型术(fused deposition modeling,FDM)基础上选用生物挤压方法进行打印,打印出1.5 cm×1.5 cm大小,厚约1.0 mm的不同比例的PLA-nHA复合支架膜,清除并修整多余的材料,低温冻干备用。不同比例生物膜分组情况:对照组(胶原膜);实验1组(15%nHA∶85%PLA)、实验2组(30%nHA∶70%PLA)、实验3组(50%nHA∶50%PLA)、实验4组(75%nHA∶25%PLA)、实验5组(100%PLA)、实验6组(100%nHA);空白组(仅于术后缝合术区,不置屏障膜)。
1.2.2 不同比例PLA-nHA生物膜细胞毒性试验
1.2.2.1 细胞培养 小鼠成纤维细胞(L-929)用含10%胎牛血清的α-MEM培养液,在CO2浓度为5%,温度为37℃的培养箱中培养,换液1次/2 d。浓度0.25%胰蛋白酶传代培养,培养的第三代细胞用于后续实验。
1.2.2.2 浸提液的制备 采用正常的细胞培养液作为浸提介质,将待测的无菌生物膜4 cm2加入20 mL细胞培养液中,37℃静置24 h,此时上清液为100%浓度的材料浸提液;用细胞培养液稀释后制成50%浸提液备用。
1.2.2.3 MTT检测 细胞培养,取对数生长期的L-929细胞,经胰蛋白酶消化后,加入含有10%胎牛血清的α-MEM培养基,将细胞密度调整为6×104个/mL,每孔100µL容量接种于3块96孔培养板中,每块板设15组,每组设置4个复孔,孔板最外一圈不予接种细胞,加入等量PBS缓冲液进行边缘封闭,后置于37℃含5%CO2的培养箱中培养20 h;分别将50%、100%浓度的浸提液替换,空白对照设置为细胞营养液。继续置37℃、5%CO2培养箱中培养1、3、5d,每个时间点各取1块板。弃原培养液,每孔加入新鲜细胞培养液100µL,MTT 20µL,继续在37℃培养4 h。吸去液体,每孔加DMSO 150µL,37℃下振荡≥10 min,使结晶充分溶解,最后将培养板放入酶标仪内,设置波长490 nm,测定吸光度值。
1.2.2.4 细胞毒性评价 细胞毒性评价:根据美国药典五级毒性评级标准[3],评价PLA-nHA复合膜浸提液的细胞毒性:相对增值率(relative growth rate,RGR)≥100%,细胞毒性为0级;RGR=80%~99%,细胞毒性为1级,0或1级为合格;RGR=50%~79%,细胞毒性为2级,应结合细胞形态综合评价;RGR=30%~49%,细胞毒性为3级RGR=0%~29%时,细胞毒性为4级,3~4级为不及格。
1.2.3 比格犬牙周炎模型的建立[4-5]将麻醉后的犬固定在手术台上,暴露实验犬上、下颌第一磨牙,以第一磨牙为实验牙位行翻瓣术,注意动作轻柔,勿损伤骨面。用3.0正畸钢丝线于实验犬上、下颌第一磨牙颈部龈缘水平结扎,并沿根尖方向将钢丝尽量压入龈沟底部,复位缝合粘骨膜瓣。7~10 d后拆线,12周后去结扎丝,检查建模区的探诊深度(probing depth,PD)、牙龈退缩(gingival recession,GR)和探诊附着水平(probing attachment level,PAL),拍摄平行投照根尖片并确立牙周炎模型建成[5]。将6只比格犬按1~6顺序编号,随机将每只犬的左侧上颌第一磨牙为空白组(不放任何屏障膜,仅将黏膜复位缝合)、右侧上颌第一磨牙为对照组,后将6个实验组屏障膜置1~6号犬左、右侧下颌第一磨牙行RGT术。将麻醉的犬固定在手术台上,分别暴露实验犬上、下颌实验部位,对实验犬进行牙周刮治清除口内结石、软垢及菌斑等,无菌情况下取出3D打印的GTR屏障膜及胶原膜,置于无菌生理盐水中浸泡1 min以上,挤压充分浸透,缝合线穿好置于对应实验犬第一磨牙牙龈部位固定,空白组不做任何处理。4周重置固定1次,共3次。
1.2.4 免疫组织化学检测 术后12周末处死实验犬,分离手术部位骨块,10%甲酸甲醛处理脱钙35天,取材约1.5 cm×1 cm10%中性甲醛固定24 h,10%甲酸甲醛处理脱钙7 d,流水冲洗4~24 h;脱水、透明、浸蜡、包埋、切片(每组20张)、抗原修复、孵育抗体、滴加二抗、苏木素复染脱水、透明,封片。观察分析I型胶原和骨涎蛋白的表达,截取图像。
1.3 统计学分析采用SPSS13.0统计软件包进行方差分析,计量资料以均数±标准差(±s)表示,以P<0.05为差异有统计学意义。
2 实验结果
2.1 大体观察实验犬在建模初期进食量有所减少,但建模后几天饮水及进食逐渐恢复正常,精神状态逐渐恢复良好、毛发光亮、日常活动正常。在整个实验期内动物无意外感染及死亡。
2.2 细胞毒性检测结果
2.2.1 显微镜观察结果 空白组的细胞在1、3、5 d 3个时间段内形态正常,贴壁生长良好,形态呈梭形或类圆形,胞核卵圆,胞质均匀,未见异常核分裂相,细胞数目随时间延长而逐渐增多。与空白组相比,7组生物膜100%、50%浓度浸提液中的细胞在1、3、5 d 3个时段内细胞增殖无明显差异。空白组及7组生物膜100%浓度浸提液中的细胞形态。见图1。
2.2.2 细胞毒性评级 生物膜培养小鼠成纤维细胞L929体外细胞相对增殖率与细胞毒性结果显示,浓度为50%、100%的浸提液随着时间延长细胞相对增殖率有所下降,同一时期细胞相对增殖率相比,100%浓度材料浸提液略低于50%浓度,但多数保证在80%以上,RGR值分级多为1级,个别达到0级,细胞毒性评价合格(表1)。
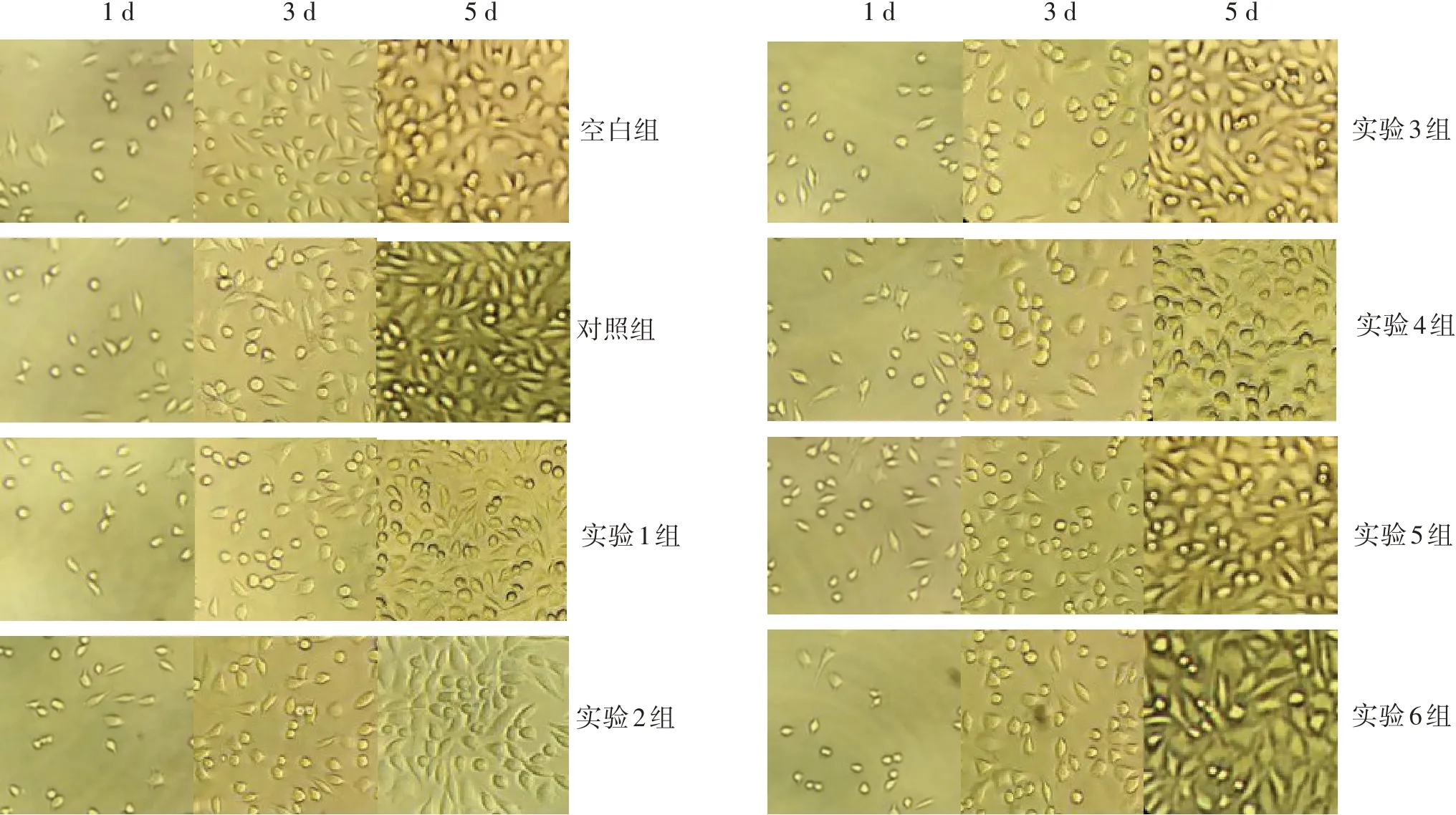
图1 各组生物膜100%浓度浸提液中的细胞形态(×100)
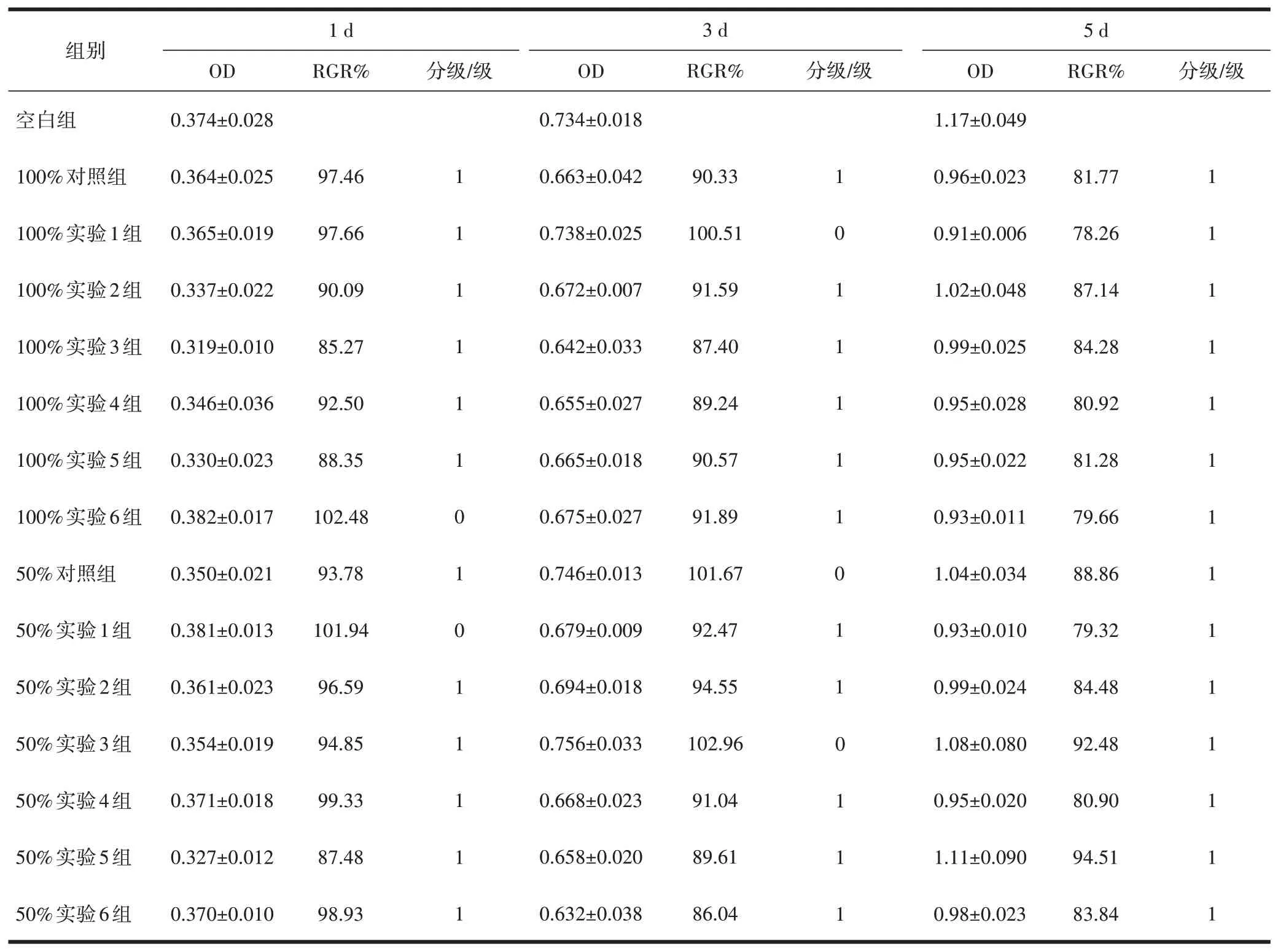
表1 生物膜培养小鼠成纤维细胞L929体外细胞相对增殖率与细胞毒性评价
2.3 免疫组织化学检测结果对于骨涎蛋白免疫组化镜下观察可见,各组均可见强弱不同的阳性表达,且免疫阳性信号位于细胞胞浆内和骨组织基质中。各组中,对照组骨界面组织表达骨涎蛋白阳性强度最高,空白组则阳性程度最低,其他各组中,实验4组、实验6组、实验3组、实验2组、实验1组、实验5组骨界面组织表达骨涎蛋白阳性强度呈逐渐减弱的趋势,其中实验5组与空白组相比,阳性强度差异不大(图2)。
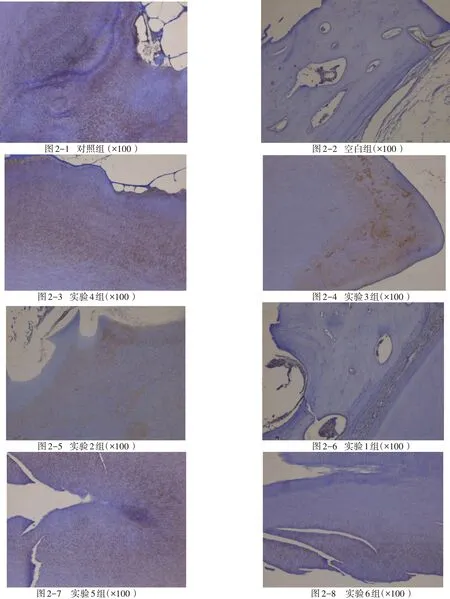
图2 各组术后12周末的骨涎蛋白表达情况
镜下观察可见,各组I型胶原蛋白均可见强弱不同的阳性表达,且免疫阳性信号主要在骨及软骨组织中表达。各组中,空白组阳性效果表达最弱,对照组阳性表达最强,其他各组中,实验4组、实验6组、实验3组、实验2组、实验1组、实验5组骨界面组织表达I型胶原蛋白阳性强度呈逐渐减弱的趋势(图3)。

图3 各组术后12周末的I型胶原表达情况
3 讨论
GTR术是目前临床修复牙周组织缺损的主要手段和方法,其原理是用外科的方法放置一个物理屏障来选择性的分隔不同的牙周组织,阻止牙龈上皮和牙龈结缔组织向根面生长,营造空间,诱导具有牙周组织再生潜力的牙周膜细胞冠向移动并生长分化,实现牙周膜、牙槽骨、牙骨质再生,形成牙周新附着。目前对于GTR屏障膜种类的使用主要集中为两类:一是以聚四氟乙烯膜为代表的不可吸收膜,二是以胶原膜、多聚乳酸等为代表的可吸收膜。不可吸收膜主要问题是后期需要二次手术取出,这不仅增加了患者的疼痛不适,也增加了术后感染和不良反应的风险。可吸收膜主要为成品胶原膜,具有固定的形态大小,造成临床中缺损与膜不匹配,需要术中裁剪,使得操作不便捷,还存在成本高、浪费等情况。
通过3D打印技术可以创建出非常复杂的结构,能够根据缺损情况、术中需求、个性化定制所需的生物膜形态,操作便捷。3D打印技术在基础研究方面以开始与各种生物学因子、细胞等结合,在临床医学中也得到了更广泛的应用和更深入的发展,包括组织缺损的个性化修复、复杂三维结构的重建、手术方案的制定等[6-7]。
PLA可完全生物降解,因其良好的生物可降解性和生物相容性广泛应用于包装、医学等领域。PLA单独使用时存在脆性大、热稳定性差以及降解周期难控制、其酸性降解产物释放触发体内炎症和异物反应等缺陷,使得PLA在医学方面的的应用受到较大限制[8-9]。
nHA是一种新型纳米生物材料,具备良好的生物相容性和骨传导性,可为骨细胞的黏附提供良好的生长环境,有助于新生骨的形成和生长,同时可提高材料的韧性,满足一定的力学强度要求。单独使用时具有可塑性及抗疲劳性差、脆性大、突释效应等缺点,需与其他材料联用,以获得更加优良的材料性能[9]。已经有学者通过体外实验证明了在PLA中加入不同比例的nHA可以改善膜的生物相容性和骨传导性[1]。
本实验通过3D打印方法打印出的支架膜具有一定的强度且具有一定的孔隙率,该结构可促进组织工程中新生骨及新生血管的生成[3],且可以在一定程度上支撑牙周软组织,防止软组织塌陷。通过小鼠细胞毒性检测发现,本研究通过3D打印的6组不同浓度的PLA-nHA复合支架膜均无明显细胞毒性。
骨涎蛋白是骨大量形成的标志物,多分布在趋向钙化的软骨组织附近或已钙化的骨基质中,I型胶原蛋白沉淀形成羟基磷灰石,可以加速矿化的完成,所以骨涎蛋白和I型胶原蛋白的表达与成骨情况成正比[10]。本研究免疫组化结果显示胶原膜组和实验4组、实验6组在骨涎蛋白和I型胶原蛋白均显示强阳性。
通过大体观察、组织学检测分析认为胶原膜组在行GTR治疗后效果最佳,实验6组及实验4组进行GTR术后结果较好,与胶原膜组行GTR术治疗效果较相近,但有研究显示3D打印100%HA支架膜在强度、降解性等方面均有欠缺[11],因此75%HA∶25%PLA比例的复合支架膜在材料降解性、成骨性等方面有进一步研究的价值,值得进行更进一步的实验研究。
