黄连对糖耐量异常大鼠肾损伤保护作用及Nrf2/HO-1通路的影响
2021-03-15杨欣妤李鹏远张清华
刘 月,杨欣妤,李鹏远,张清华,鄢 丹,金 锐
(首都医科大学附属北京世纪坛医院药剂科;临床合理用药生物特征谱学评价北京市重点实验室;临床合理用药生物特征谱学评价国际合作联合实验室,北京100038)
糖尿病肾病(Diabetic Nephropathy,DN)是由糖尿病引起的肾脏疾病,是终末期肾脏疾病的主要来源[1]。在糖尿病早期阶段,肾脏会出现可逆性肾损伤,及时治疗可恢复肾功能[2]。研究表明糖尿病与活性氧(Reactive oxygen species,ROS)的过量产生、抗氧化防御系统缺陷导致的氧化应激增加有关,可引起细胞凋亡、肾脏系统炎症以及肾脏系统的氧化损伤[3]。在DN的病理生理中,核因子E-2相关因子(Nuclear factor E2 related factor 2,Nrf2)被认为是防御氧化应激的枢纽[4]。Nrf2/血红素加氧酶1(Heme oxygenase 1,HO-1)通路与抗氧化应激条件下ROS的清除有关[5]。Nrf2(一种转录因子)负责II期解酶(谷胱甘肽S-转移酶)或抗氧化酶[超氧化物歧化酶(Superoxide dismutase,SOD)]的表达,减少氧化应激。特别是Nrf2与与抗氧化反应元件(ARE)(包括HO-1)结合,可增强许多抗氧化基因表达以应对氧化应激[6]。中药黄连具有减轻胰岛素抵抗、抗炎、抗氧化和保护心血管作用[7]。研究表明黄连通过Nrf2介导保护体外H2O2诱导肝细胞(L-02)损伤[8]。本研究采用D-半乳糖溶液制备糖耐量异常大鼠模型,探究黄连对IGT大鼠肾损伤保护作用及Nrf2/HO-1通路的影响,现报道如下。
1 材料与方法
1.1 仪器组织脱水机、包埋机、全自动轮转切片机(德国Leica公司);GLUCOCARDTMTest Strip II血糖仪及试纸(日本京都电子公司);xMark酶标分析仪和BIO-RAD垂直电泳仪(美国BD公司);凝胶成像仪(美国UVP公司)。
1.2 试药炒黄连(江苏省中西医结合医院中药房);二甲双胍(中国深圳中联药业有限公司);D-半乳糖(上海源聚生物科技有限公司);胱抑素C(cystatin C,Cys-C)和β2-微球蛋白(β2-microglobulin,β2-MG)ELISA试剂盒(上海酶联生物科技有限公司);丙二醛(malondialdehyde,MDA)和总抗氧化能力(Total antioxidant capacity,T-AOC)检测试剂盒(南京建城生物工程有限公司);RIPA裂解液(上海生工生物工程有限公司);Nrf2、HO-1、磷酸酰胺腺嘌呤二核苷酸醌氧化还原酶-1(NADPH quinineoxidoreductase-1,NQO-1)和β-actin抗体(美国Santa Cruz公司);辣根过氧化物酶HRP标记亲和纯化山羊抗鼠IgG二抗(武汉艾美捷科技有限公司);HE染色试剂盒(中国国药集团)。
1.3 实验动物雄性SD大鼠购自贵州医科大学实验动物中心,体质量(200±20)g,动物生产许可证号:SCXK(贵)2020-0001,动物质量合格证号:2020112304。
1.4 动物分组及模型制备选取50只成年雄性SD大鼠在SPF环境中自由进食和饮水,适应性喂养1周,按体质量随机抽取10只作对照组,腹腔注射生理盐水(2 mL/kg体质量),连续8周;其余大鼠腹腔注射D-半乳糖溶液(150 mg/kg体质量),每天1次,连续2周后将大鼠分成模型组(生理盐水0.1 mL/kg体质量)、黄连低剂量组(黄连1.25 g/kg体质量)、黄连高剂量组(黄连5 g/kg体质量)和二甲双胍组(150 mg/kg体质量),每组10只。灌胃6周,将D-半乳糖溶液剂量调至150 mg/kg体质量,持续注射至第8周。末次灌胃后禁食12 h,测定空腹血糖(Fasting blood-glucose,FBG)和餐后2 h血糖(2 h postprandial blood glucose,2 h BG)。将大鼠麻醉后心脏采血,分离血清,分离肾组织,左肾进行福尔马林固定,右肾-80℃保存备用。
1.5 苏木精-伊红(Hematoxylin-Eosin)染色大鼠左肾用10%甲醛进行固定24 h,经脱水、包埋,切成厚度为1µm切片,用HE染色,由具有临床经验的病理医生进行诊断,对肾组织进行病理学检测。
1.6 血清学指标的检测按照ELISA试剂盒说明书操作检测血清中Cys-C和β2-MG水平;按试剂盒说明书操作检测血清中MDA和T-AOC水平。
1.7 肾组织中Nrf2、HO-1和NQO-1水平检测取肾组织进行研碎,根据组织重量加入相应RIPA裂解液,冰浴2 h;离心后取上清,进行电泳(20µg/孔),将印迹转移到聚偏氟乙烯膜上,用5%脱脂牛奶在室温下封膜1 h,将膜与NRF2(1∶300)、HO-1(1∶200)、NQO-1(1∶500)和β-actin(1∶1 000)进行孵育,4℃过夜,将IgG二抗(1∶10 000)在室温下孵育30 min,进行显色,用Image LabTM软件(Bio-Rad)获取信号并分析,以β-actin作为内对照。
1.8 统计学处理采用SPSS23.0统计学软件进行统计分析,计数资料以均数±标准差(-x±s)表示,采用单因素方差分析进行判断,组间两两比较采用SNK-q检验,检验水准α=0.05。
2 结果
2.1 黄连对大鼠肾组织的影响对照组大鼠肾组织未见明显的组织学改变;模型组大鼠肾脏肾小管严重损伤和坏死、炎性细胞浸润;各黄连剂量组和二甲双胍组肾小管损伤、炎性细胞浸润减轻较模型组减轻,各黄连剂量组呈剂量依赖性,见图1。
2.2 黄连对大鼠空腹血糖及口服糖耐量的影响各组大鼠FBG水平差异均无统计学意义(P>0.05)。与对照组相比,其余各组大鼠2 h BG水平增加,差异有统计学意义(P<0.05);与模型组相比,各黄连剂量组和二甲双胍组大鼠2 h BG水平降低,差异有统计学意义(P<0.05),见表1。
表1 黄连对大鼠空腹血糖及口服糖耐量的影响(±s)
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05;与黄连低剂量组相比,cP<0.05;与黄连高剂量组相比,dP<0.05。
2 h BG/(mmol/L)5.29±0.62 7.26±0.35a 6.48±0.71ab 6.02±0.54abc 5.71±0.30abcd组别对照组模型组黄连低剂量组黄连高剂量组二甲双胍组FBG/(mmol/L)3.26±0.41 3.21±0.57 3.40±0.41 3.31±0.53 3.29±0.45
2.3 黄连对大鼠Cys-C和β2-MG水平的影响与对照组相比,其余各组大鼠血清中Cys-C和β2-MG水平增加,差异有统计学意义(P<0.05);与模型组相比,各黄连剂量组和二甲双胍组大鼠血清中Cys-C和β2-MG水平降低,差异有统计学意义(P<0.05),见表2。
表2 黄连对大鼠Cys-C和β2-MG水平的影响(±s)
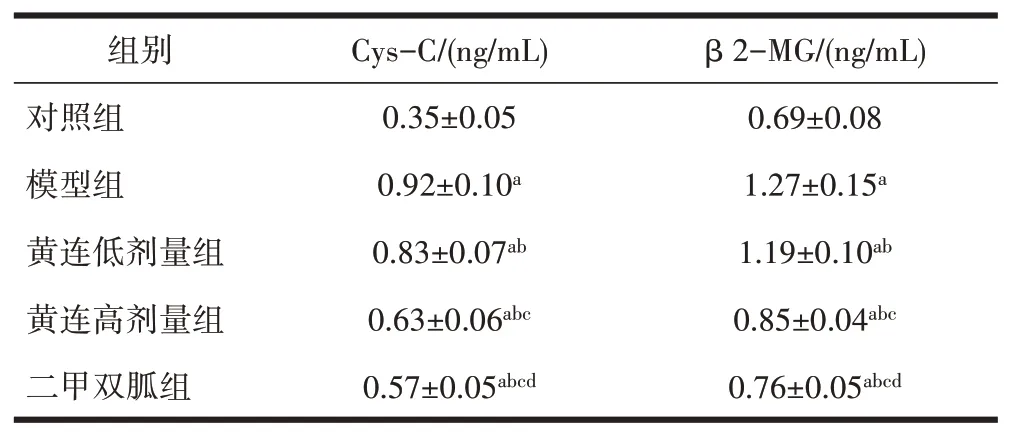
表2 黄连对大鼠Cys-C和β2-MG水平的影响(±s)
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05;与黄连低剂量组相比,cP<0.05;与黄连高剂量组相比,dP<0.05。
β2-MG/(ng/mL)0.69±0.08 1.27±0.15a 1.19±0.10ab 0.85±0.04abc 0.76±0.05abcd组别对照组模型组黄连低剂量组黄连高剂量组二甲双胍组Cys-C/(ng/mL)0.35±0.05 0.92±0.10a 0.83±0.07ab 0.63±0.06abc 0.57±0.05abcd
2.4 黄连对大鼠血清中MDA和T-AOC水平的影响与对照组相比,其余各组大鼠血清中MDA水平增加,T-AOC水平降低,差异有统计学意义(P<0.05);与模型组相比,黄连各剂量组和二甲双胍组大鼠血清中MDA水平降低,T-AOC水平增加,差异有统计学意义(P<0.05),见表3。
表3 黄连对大鼠血清中MDA和T-AOC水平的影响(±s)

表3 黄连对大鼠血清中MDA和T-AOC水平的影响(±s)
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05;与黄连低剂量组相比,cP<0.05;与黄连高剂量组相比,dP<0.05。
T-AOC/(U/mL)4.28±0.16 1.37±0.32a 1.82±0.35ab 2.94±0.50abc 3.47±0.28abcd组别对照组模型组黄连低剂量组黄连高剂量组二甲双胍组MDA/(mmol/mL)5.03±0.42 13.52±1.81a 10.27±1.03ab 8.53±0.90abc 7.27±0.89abcd
2.5 黄连对大鼠肾组织中Nrf2、HO-1和NQO-1水平的影响与对照组相比,其余各组大鼠肾组织中Nrf2、HO-1和NQO-1水平降低,差异有统计学意义(P<0.05);与模型组相比,二甲双胍组和黄连各剂量组大鼠肾组织中Nrf2、HO-1和NQO-1水平增加,差异有统计学意义(P<0.05),见表4、图2。
表4 黄连对大鼠肾组织中Nrf2、HO-1和NQO-1水平的影响(±s)
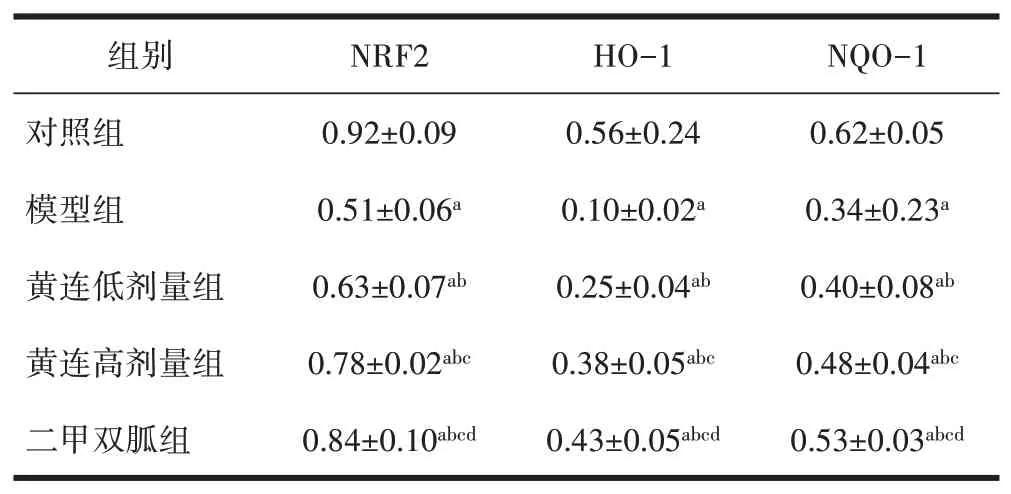
表4 黄连对大鼠肾组织中Nrf2、HO-1和NQO-1水平的影响(±s)
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05;与黄连低剂量组相比,cP<0.05;与黄连高剂量组相比,dP<0.05。
NQO-1 0.62±0.05 0.34±0.23a 0.40±0.08ab 0.48±0.04abc 0.53±0.03abcd组别对照组模型组黄连低剂量组黄连高剂量组二甲双胍组NRF2 0.92±0.09 0.51±0.06a 0.63±0.07ab 0.78±0.02abc 0.84±0.10abcd HO-1 0.56±0.24 0.10±0.02a 0.25±0.04ab 0.38±0.05abc 0.43±0.05abcd
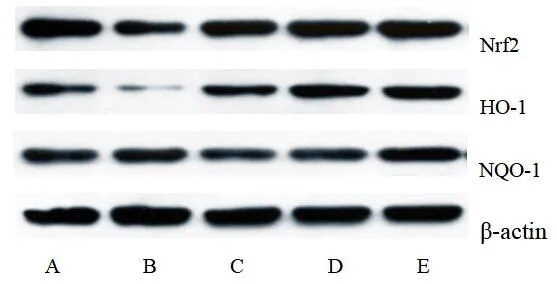
图2 黄连对大鼠肾组织中Nrf2、HO-1和NQO-1水平的影响
3 讨论
DN是全球范围内慢性肾脏疾病和终末期肾衰竭的重要原因,早期DN以蛋白尿和进行性肾小球硬化为特征。研究提示,糖尿病患者的β2-MG可能是早期DN的早期指标。大多数糖尿病患者的血清Cys-C和β2-MG显着升高,轻微肾损害也会导致血清中Cys-C和β2-MG水平显着升高,导致疾病进展[9]。这提示Cys-C和β2-MG与DN的发生和发展有协同作用。在本研究中,糖耐量异常引起的Cys-C和β2-MG水平明显升高。通过病理学检测发现,糖耐量异常鼠的肾脏出现了肾小管损伤、炎性细胞浸润的症状。上述结果表明,D-半乳糖成功诱导了糖耐量异常大鼠模型,并显示出糖尿病肾损伤。
氧化应激逐渐被认为是DN的重要致病因素。ROS的过量产生是糖尿病相关大血管和微血管并发症(包括DN)发病的重要机制。T-AOC是氧化的重要标志,主要反映非酶活性,但也包括少数小分子酶系统的活性。MDA是脂质过氧化和前列腺素生物合成的天然产物,具有诱变和致癌性。2型糖尿病肾病(Type 2 Diabetic Nephropathy,T2DN)肾病患者早期MDA水平升高,T-AOC水平降低[10]。本研究结果还表明,从DM 4周开始,肾组织中MDA水平升高,TAOC水平降低。本研究结果与上述研究一致。这些发现表明,在DN的早期阶段,抗氧化活性已经降低。黄连对病毒和真菌具有较好的拮抗作用,展现出降糖作用,但关于它对DN保护作用的研究较少[11]。在本研究中,黄连治疗显着抑制了肾功能的恶化,其作用不如二甲双胍,作为一个未知的新功能,还是有进一步研究的价值。研究表明,黄连通过清除ROS具有器官保护功能[12]。在本研究中,黄连抑制糖耐量异常大鼠氧化应激的发展,表明黄连具有抗氧化作用,可保护肾脏免受高血糖侵害。
近年来,在氧化应激中发挥重要作用的Nrf/HO-1通路受到了越来越多的关注。Nrf2是抗氧化防御途径的关键调节因子,可在DM和糖尿病性神经病中被激活[13]。在正常情况下,Nrf2信号通过与Kelch样ECH相关蛋白1(Keleh-like ECH-associated proteinl,Keap 1)结合而被隔离在细胞质中[14]。在病理条件下(如氧化应激),可以诱导Nrf2-Keap 1复合物的解离并转移到细胞核中,随后与ARE结合,诱导包括HO-1在内的II期防御酶,HO-1分解游离血红素并产生(Carbon monoxide,CO)、游离铁和胆绿素,可通过上调白细胞介素-10(Interleukin-10,IL-10)来赋予其抗炎特性[15]。HO-1在维持各种疾病中的抗氧化和氧化剂稳态方面具有重要作用,如放射性损伤、严重脓毒症和急性肾损伤,黄连可以激活Nrf2信号通路,抑制氧化应激[16]。在本研究中,黄连预处理促进了Nrf2及其靶基因(HO-1和NQO-1)的激活,黄连通过激活Nrf2/HO-1信号通路,改善高血糖引起的肾功能障碍,为DN治疗提供一种新的治疗策略。
