肝癌缺失基因1(DLC-1)甲基化在多发性骨髓瘤患者中的临床意义
2021-03-15孙晓洁
程 虹,孙晓洁,冶 薇
(新疆医科大学附属肿瘤医院检验科,乌鲁木齐830011)
多发性骨髓瘤(Multiple myeloma,MM)是浆细胞系统恶性增生的一种血液系统恶性肿瘤,发病人群以中老年人为主,发病年龄通常≥40岁,其中男性与女性的患病率之比约为3:2。据一项流行病学调查发现,MM的患病率在所有恶性肿瘤中约占1%,在所有造血系统肿瘤中约占12%~15%[1];我国MM发病率约为1/10万,低于西方工业发达国家(美国约4.3/10万)[2]。有研究显示,该病的发生与骨髓微环境中细胞因子变化、相关重要膜受体的改变、肿瘤前体细胞中癌基因的突变以及多种机制的相互协同作用有关[3]。目前临床有关MM的治疗方案主要是自体干细胞的移植和联合化疗,但MM的发病以老年人为主,化疗耐受性差,因此临床工作者急需发现一些新的分子标志物,以期对MM做到早期发现、早期诊断,进而改善MM患者的预后。
肝癌缺失基因1(DLC-1)是一种重要的抑癌基因,位于8p21.3-22区。目前已多次报道该基因在多种肿瘤中存在低表达或表达缺失,而在人体正常组织中检测均表达。鉴于此,越来越多的研究者对DLC-1基因开展调查研究发现,DLC-1基因启动子区域高甲基化可导致其在多种实体瘤及白血病中的表达沉默[4-5]。作为一种新的抑癌候选基因,现已证实DLC-1基因在血液肿瘤中存在启动子区CpG岛的高甲基化表达[6]。基于上述研究背景,本课题拟通过重亚硫酸盐测序PCR(BSP)法定量检测MM患者外周血中DLC-1基因的甲基化程度,为今后MM的去甲基化靶向治疗提供理论依据,并以此预测DLC-1基因甲基化作为判断MM独立预后因素的可行性。
1 对象与方法
1.1研究对象 所有MM患者来自新疆医科大学附属肿瘤医院血液淋巴瘤科2016年10月—2017年12月收治的初诊患者30例。病例组男性17例,女性13例,平均年龄(57.9±10.9)岁;20例健康对照组中,男性、女性各10例,平均年龄(58.4±14.5岁)。诊断标准符合文献[7],分期采用Durie-Salmon分期。30例MM患者入院后分别完成骨髓细胞学检查、免疫球蛋白定量检测、血清蛋白电泳(M蛋白)、X线检查等确诊。排除标准:(1)存在第二原发肿瘤的患者;(2)孤立性浆细胞瘤;(3)治疗后的MM患者不予入组。所有MM患者于入院后第二天签署知情同意书,清晨空腹抽取静脉血3 mL于EDTA抗凝管内,采集后的标本2 h内完成送检。所有外周血及骨髓标本的采集均已获得新疆医科大学伦理委员会的批准并签署知情同意书。
1.2 方法
1.2.1 骨髓细胞形态学检测 由新疆医科大学附属肿瘤医院检验科两名中级以上职称的人员对MM患者的骨髓标本进行细胞形态学的分类,骨髓中分类200个细胞,计算骨髓瘤细胞在骨髓有核细胞中所占的比例,取两名专业人员检测结果的平均值。根据分类结果将30例MM患者的骨髓瘤细胞比值按<30%、30%~50%、≥50%分为3组,然后对3组患者进行DLC-1基因甲基化情况的比较。
1.2.2 外周血DNA提取 所有标本采用全血溶液法提取DNA,试剂包括Trans2K DNA Marker、Easy Pure Genomic DNA Kit、EpiTect Fast DNA Biulfite kit、Trans Fast Taq DNA Polymerase,操作步骤严格按照试剂说明书进行。
1.2.3 目的基因的扩增 首先进行基因组甲基化的修饰,试剂包括RNase-free water、亚硫酸盐混合液、DNA保护溶液;然后用PCR仪进行DNA转化,亚硫酸盐修饰结束后,进行目的基因扩增,引物序列见表1。然后行目的片段的回收、连接及转化,测序成功的数据利用BIQ-Analyzer软件,进行甲基化位点及数量的统计。
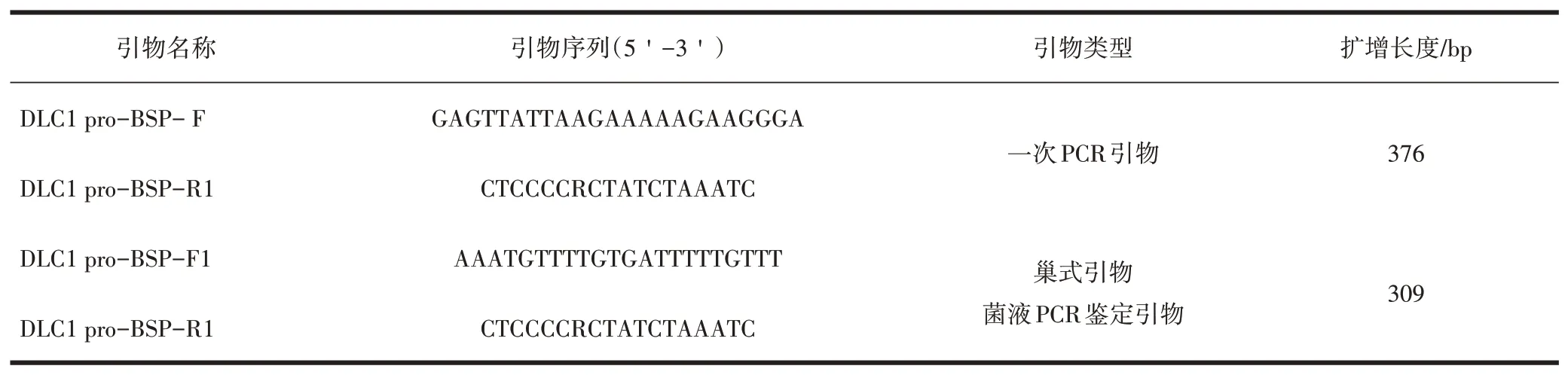
表1 引物序列
1.2.4 目的片段的回收、连接及转化 通过上一步骤得到目的条带,经SanPrep柱式DNA胶回收试剂盒进行回收,回收后的片段经pEASY-T1 Cloning Kit连接(全式金生物),于25℃连接5 min。后于-80℃低温冰柜中取出感受态菌1管(100µL),置于冰上融化,取溶解后的感受态菌25µL加入10µL的连接产物中,混匀置于冰上30 min。42℃加热45 s,后迅速置于冰中静置1 min。在超净工作台中向上述转化产物加入1 000µL的LB培养基(不含抗生素),轻轻混匀后固定于摇床的弹簧架上,37℃振荡培养1 h,取出后3 000 r/min离心5 min。在生物安全柜中弃去培养基上清,吹打混匀后,从剩余的转化混合液中吸取80µL,分别置于Luria-Bertani培养基(简称LB培养基)上培养。培养皿上做好标记后室温下20 min左右,当观察到培养皿表面的液体已完全渗入培养基后,倒置培养基,于37℃恒温培养箱中培养过夜。第二天观察平板上的菌落,挑取形态正常的单克隆菌落进一步进行摇菌扩繁,最后完成菌液PCR的鉴定(体系与程序见表2、3)。

表2 PCR体系
1.3 统计学处理本次实验数据采用SPSS19.0软件进行分析,计量资料用-x±SD表示,在进行两组比较之前,首先进行正态性检验,如果各组均满足正态性且两组间方差齐,采用t检验或卡方检验;多组间的比较采用单因素方差分析,若总体比较有差异,进一步两两比较采用SNK法或Dunnetts's T3法。P<0.05为差异有统计学意义。

表3 PCR程序
2 结果
2.1 MM分型及分期结果对入选的30例MM患者进行分型和分期,结果提示30例MM中IgG型有21例(70%),IgA型有6例(20%),轻链型有3例(10%);进一步进行分期,提示Ⅰ期MM有5例(16.7%),Ⅱ期MM有6例(20%),Ⅲ期MM有19例(63.3%)。
2.2 骨髓细胞形态学检查结果经对30例MM患者进行骨髓细胞形态学检测,以骨髓瘤细胞在骨髓有核细胞中所占的比值为依据,共分成3组。结果发现骨髓中骨髓瘤细胞比例<30%的有6例(20%),骨髓瘤细胞比例在30%~50%之间的有19例(63.3%),骨髓瘤细胞比值≥50%的有5例(16.7%)。
2.3 BSP检测DLC-1基因甲基化结果2.3.1 PCR扩增结果 对所有外周血标本利用DLC1 pro-BSP-F/R1扩增得到1次PCR产物,将一次PCR产物稀释50倍,进行巢式PCR扩增,结果如图1所示,扩增的条带单一,条带大小正确,说明扩增结果满意,可以进行后续的实验。
图1 巢式PCR电泳图
2.3.2 菌液PCR实验鉴定结果 菌液PCR鉴定引物为DLC1 pro-BSP-F1/R1,扩增的阳性目的片段为309 bp;结果如图2所示,电泳图条带单一,明亮,可以用于后续的测序实验。

图2 菌液PCR鉴定电泳图
2.3.3 测序峰图 测序峰图结果是较为单一的峰图,背景不高,与参比序列进行比对,测序序列可以与参比序列比对上,说明测序结果真实可靠,可以用以后续的分析(见图3)。
2.3.4 DLC-1基因甲基化在MM组与对照组中的结果分析 本实验共检测了30例MM患者、20例正常对照DLC-1基因启动子区甲基化的情况,结果发现对照组的甲基化发生率为(31.428±25.962)%,MM组的甲基化发生率为(60.000±23.774)%,两组差异具有统计学意义(P=0.009)。进一步对DLC-1基因上28个CpG位点甲基化率(%)进行分析。从表4可以看出,与对照组比较,DLC-1基因上CpG岛4、6、7、13、21位点的甲基化率出现了显著的统计学差异。CpG岛4位点在MM组中的甲基化率为(10.667±10.328)%,而在对照组中的甲基化率为(2.000±4.216)%,两组比较差异有统计学意义(P=0.017);CpG岛6位点在MM组中的甲基化率为(12.667±10.328)%,而在对照组中的甲基化率为(4.000±6.992)%,两组比较差异有统计学意义(P=0.030);CpG岛7位点在MM组中的甲基化率为(12.000±10.142)%,而在对照组中的甲基化率为(4.000±9.661)%,两组比较差异有统计学意义(P=0.023);CpG岛13位点在MM组中的甲基化率为(12.000±8.619)%,而在对照组中的甲基化率为(5.000±7.071)%,两组比较差异有统计学意义(P=0.017),结果见表4。
2.3.5 甲基化分析图 测序成功样本与参比序列进行比对,得到圆点图,图4为举例图示。

图3 测序峰图例图

图4 甲基化分析图片(对照组10号样本)
2.3.6 DLC-1基因甲基化与MM临床指标的相关性分析 本实验经对50例标本完成DLC-1基因启动子区甲基化的检测,结果提示对照组的20例标本DLC-1基因启动子区均处于非甲基化状态,30例的MM患者中有18例DLC-1启动子区检测到了甲基化状态,且其中1例表现为完全甲基化,MM组的甲基化概率为0.06(18/30)。进一步对MM组的甲基化比例进行分层研究,结果发现IIa+IIIa期与IIIb期组间、血清肌酐值正常与升高患者组间、骨髓异常浆细胞/骨髓瘤细胞比例50%≥与<50%组间DLC-1甲基化的比例也存在统计学差异(P均<0.05)。对DLC-1甲基化与临床各指标行相关性分析,DLC-1甲基化与性别、年龄、血红蛋白(Hb)、乳酸脱氢酶(LDH)、白蛋白(ALB)、β2-微球蛋白(β2-MG)以及免疫球蛋白(IgG、IgA、IgM)及轻链(Kappa、Lambda)的相关分析均未见统计学差异;而与血肌酐(Cr)、尿素氮(BUN)、骨髓异常浆细胞比例、DLC-1表达△Ct值的相关分析出现了统计学差异(表5)。本次实验数据提示,MM患者的DLC-1基因甲基化与其肿瘤负荷及肾功能受损具有相关性,DLC-1基因甲基化是导致MM患者DLC-1基因表达降低的表观遗传学机制之一。
表4 DLC1基因28个CpG位点甲基化率(%)统计分析(±s,n=50)

表4 DLC1基因28个CpG位点甲基化率(%)统计分析(±s,n=50)
位点CpG1 CpG2 CpG3 CpG4 CpG5 CpG6 CpG7 CpG8 CpG9 CpG10 CpG11 CpG12 CpG13 CpG14 CpG15 CpG16 CpG17 CpG18 CpG19 CpG20 CpG21 CpG22 CpG23 CpG24 CpG25 CpG26 CpG27 CpG28对照组3.000±4.830 3.000±6.749 7.000±8.233 2.000±4.216 4.000±5.164 4.000±6.992 4.000±9.661 12.000±16.193 13.000±14.944 12.722±16.668 7.000±8.233 8.000±11.353 5.000±7.071 1.000±3.162 1.000±3.162 0.000±0.000 0.000±0.000 0.000±0.000 9.000±9.944 7.000±13.375 2.000±4.216 2.000±6.325 3.000±4.830 3.000±6.749 5.000±7.071 4.000±5.164 7.000±8.233 9.000±9.944 MM组7.333±8.837 6.667±6.172 12.667±13.345 10.667±10.328 11.333±10.601 12.667±10.328 12.000±10.142 27.333±20.517 26.667±19.518 31.265±34.973 12.667±8.837 14.333±11.475 12.000±8.619 4.667±6.399 3.667±7.188 1.407±3.720 3.333±6.172 2.741±4.712 15.333±11.872 16.000±12.421 9.333±11.629 6.667±8.165 2.667±5.936 4.889±9.829 12.000±16.562 11.482±11.391 12.000±12.649 20.000±19.640 T/Z值-1.172-1.666-1.195-2.379-2.023-2.315-2.266-1.983-1.874-1.773-1.613-1.358-2.382-1.628-1.036-1.179-1.741-1.741-1.390-1.722-2.011-1.717-0.447-0.408-0.798-1.684-0.953-1.629 P值0.241 0.096 0.244 0.017 0.055 0.030 0.023 0.059 0.074 0.090 0.120 0.188 0.017 0.103 0.300 0.239 0.082 0.082 0.178 0.099 0.044 0.086 0.655 0.683 0.425 0.092 0.341 0.117

表5 DLC-1基因甲基化与各临床指标的相关性分析
3 讨论
MM起病隐匿,病程进展缓慢,早期易漏诊。生物学和临床特征的高度异质性是多发性MM的重要特征,而细胞遗传学的异常(CA)是造成MM异质性大的主要原因[8],CA进一步可细分为原发性的异常和继发性的异常两大类,分别驱动多发性骨髓瘤疾病的发生和进展[9]。作为血液病的第二大肿瘤,近年来有关肿瘤抑癌基因(Tumorsuppressor gene,TSG)CpG岛的异常甲基化与MM的相关性逐渐受到研究者的重视。其中肝癌缺失基因-1(Deleted in liver cancer 1,DLC-1)首次报道出现在1998年Yuan等[10]学者的研究中,是一种在肝癌细胞系中新发现的肿瘤抑癌基因(TSG)。随后的研究发现DLC-1基因在多种肿瘤中存在低表达或表达缺失,相关血液系统肿瘤中已被证实DLC-1基因在急性淋巴细胞性白血病、非霍奇金淋巴瘤中存在启动子区的异常甲基化,且异常甲基化比例超过80%[11-14]。
本研究通过对30例MM患者的研究发现,MM组DLC-1启动子区甲基化率显著高于正常组,其中尤其以CpG4、6、7、13、21位点的甲基化率出现了显著的统计学差异,此结果与该研究预测的结果大致一致。进一步对MM组的甲基化比例进行分层研究,结果发现IIa+IIIa期与IIIb期组间、血清肌酐值正常与升高患者组间、骨髓异常浆细胞/骨髓瘤细胞比例50%≥与<50%组间DLC-1甲基化的比例也存在统计学差异(P均<0.05),提示DLC-1基因异常甲基化导致基因表达受抑可能是MM患者的重要发病机制之一。另外,甲基化与临床指标中肌酐呈相关性,说明DLC-1基因甲基化可能对肾功能造成损伤,为今后MM疾病的进展和预后的判断可能起着一定的作用。但与性别、年龄、血红蛋白、乳酸脱氢酶、白蛋白、β2-微球蛋白这些临床指标进行分析,未见显著统计学差异,可能是样本例数少,且多为晚期阶段有关。
DLC-1基因异常甲基化有可能作为MM诊断和检测微小残留病灶的一个新的分子标志物。在目前的临床工作中,诊断多发性骨髓瘤的患者均需通过骨髓细胞形态学检查,大多数MM患者骨髓中的骨髓瘤细胞(或异常浆细胞)占比约为10%~90%,除了数量上的异常之外,浆细胞的形态学改变也是诊断MM的重要依据。在多发性骨髓瘤患者中,有关骨髓细胞核的发育异常较为常见的为双核或多核浆细胞,偶尔也可见到哑铃形或花瓣形浆细胞核,通常骨髓瘤细胞成堆状分布,形态大小不一,有很大异型性。在本次研究中,发现骨髓瘤细胞比例50%≥组与<50%组间DLC-1甲基化比例存在统计学差异,而骨髓瘤细胞的比例是判断预后的一个重要指标,由此提示DLC-1基因甲基化可能对MM的预后判断有提示作用,但因病例数较少,不能代表群体,故有待开展进一步的研究。
此次的课题研究仅是初步对MM组和对照组甲基化的表达情况进行了分析比较,并发现了有意义的甲基化位点,初步证实了MM患者存在DLC-1基因的异常甲基化。但本研究的病例数较少,在今后的研究中,课题组在现有基础上拟扩大样本量,除DLC-1基因外,可进一步筛选有关MM的新的表观遗传学标志,进而构建多发性骨髓瘤患者的DNA甲基化谱式,对今后探索该病治疗的新靶点及判断预后提供依据。
