LncRNA PCBP1-AS1对口腔鳞癌细胞增殖、侵袭和凋亡的影响
2021-03-15李晓宁
于 宇,李晓宁
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)属于头颈部常见恶性肿瘤之一[1]。临床主要采用手术与化疗等手段治疗OSCC,但由于缺乏早期诊断OSCC的有效标志物导致大部分病人确诊时已处于中晚期,目前关于OSCC发生及转移机制尚未完全阐明。长链非编码RNA(long non-coding RNA,LncRNA)可调控基因转录、翻译等生物学过程,LncRNA表达异常与多种肿瘤发生发展密切相关[2-3]。研究[4]表明长链非编码RNA PCBP1-AS1(long non-coding RNA PCBP1-AS1,LncRNA PCBP1-AS1)可抑制外阴鳞癌细胞增殖、侵袭及迁移并促进其凋亡。近来报道指出PCBP1-AS1在口腔鳞癌中呈低表达,但关于其具体作用机制尚未阐明[5]。Janus激酶2(JAK2)/信号转导与转录激活因子3(STAT3)信号通路可参与细胞增殖、凋亡等多种生物学过程,JAK2可促使STAT3活化从而促进肿瘤发生发展[6-7]。但PCBP1-AS1是否可通过调控JAK2/STAT3信号通路而参与OSCC发生发展进程尚需进一步研究。本研究主要探讨PCBP1-AS1在OSCC细胞中的表达状态及其对细胞增殖、侵袭及凋亡的影响,初步探究其对JAK2/STAT3信号通路的调控作用,旨在为揭示OSCC发生发展机制奠定理论基础。
1 材料与方法
1.1 材料与试剂 正常口腔上皮细胞HOK与口腔鳞癌细胞株CAL-27、Tca8113、KB购自美国ATCC公司。杜氏改良培养基(DMEM)、胰蛋白酶购自美国Gibco公司;pcDNA3.1购自上海吉玛制药技术有限公司;Trizol、反转录试剂盒、SYBR Green试剂盒购自日本TaKaRa公司;甲基噻唑基四唑(methylthiazolyl tetrazolium,MTT)购自美国APExBIO公司;细胞凋亡检测试剂盒购自上海泽叶生物科技有限公司;Transwell小室购自美国Corning公司;Mgtrigel基质胶购自美国BD公司;蛋白裂解液与二 喹 啉 甲 酸(BCA)蛋白定量试剂盒购自上海碧云天生物技术研究所;兔抗人细胞周期依赖蛋白激酶1(CDK1)、基质金属蛋白酶-2(MMP-2)、B淋巴细胞瘤-2(Bcl-2)、B淋巴细胞瘤-2相关蛋白(Bax)单抗购自美国CST公司;兔抗人Janus激酶2(JAK2)及其磷酸化激酶(p-JAK2)单抗购自北京博奥森生物技术有限公司;鼠抗人信号转导与转录激活因子3(STAT3)及其磷酸化(p-STAT3)单抗购自美国Santa Cruz公司;辣根过氧化物酶标记的山羊抗兔、山羊抗鼠IgG二抗均购自北京义翘神州科技有限公司。
1.2 方法
1.2.1 细胞转染及分组 细胞培养于DMEM培养基,培养条件:37 ℃、5%CO2培养箱,传代培养至第3代时。收集对数生长期CAL-27细胞,0.25%胰蛋白酶消化,加入DMEM培养基制备细胞悬液接种于24孔板,待细胞生长融合至50%时进行转染,转染前更换为不含胎牛血清的DMEM培养基,随机分为pcDNA-control组(细胞中转染pcDNA-control)、pcDNA-PCBP1-AS1组(细胞中转染PCBP1-AS1过表达质粒),各组细胞转染6 h后更换为含有10%胎牛血清的DMEM培养基,继续培养48 h。
1.2.2 实时荧光定量聚合酶链反应(qRT-PCR)检测细胞中PCBP1-AS1表达水平 收集各组细胞,根据Trizol试剂盒说明书操作提取细胞总RNA,应用Nanodrop2000c超微量分光光度计测定RNA浓度,将RNA反转录合成cDNA,严格按照试剂盒说明书进行操作,PCBP1-AS1正向引物5′-TGC CAA GAG CCT ATC CAT TC-3′,反向引物:5′-TCA CTC CCT TCA CCC TGT CT-3′;GAPDH正向引物5′-GCA CCG TCA AGG CTG AGA AC-3′,反向引物:5′-TGG TGA AGA CGC CAG TGG A-3′,引物由上海生工生物工程股份有限公司设计合成。以cDNA为模板进行qRT-PCR反应,反应条件:95 ℃ 2 min,95 ℃ 30 s,60 ℃30 s,72 ℃ 30 s,循环35次。PCBP1-AS1以GAPDH为内参,采用2-ΔΔCt法计算PCBP1-AS1相对表达量。
1.2.3 MTT检测细胞增殖 收集各组对数生长期CAL-27细胞,0.25%胰蛋白酶消化,制备单细胞悬液(3×104个/毫升),接种至96孔板(每孔200 μL),分别于转染24、48、72 h时每孔分别加入20 μL MTT溶液,室温孵育4 h,弃上清液,每孔分别加入150 μL二甲基亚砜(DMSO),低速振荡10 min,酶标仪检测各孔吸光度值(OD490 nm)。
1.2.4 Transwell实验检测细胞侵袭 预备实验:培养液预冷一定时间,以9∶1的比例稀释Matrigel基质胶,按照每孔40 μL的密度将Matrigel基质胶稀释液平铺于Transwell小室上室,37 ℃、体积分数5%CO2培养箱孵育5 h。实验步骤:取对数生长期CAL-27细胞,0.25%胰蛋白酶消化,加入不含胎牛血清的培养液制备单细胞悬液(5×104个/毫升),取200 μL接种于Transwell小室上室,另取500 μL含有10%胎牛血清的培养液加入Transwell小室的下室,37 ℃、体积分数5%CO2培养箱孵育24 h,PBS洗涤,多聚甲醛固定20 min,0.1%结晶紫染液染色10 min,湿棉签擦去小室内未侵袭细胞,显微镜下随机选取5个视野观察侵袭细胞数。
1.2.5 流式细胞术检测细胞凋亡率 分别取各组对数生长期CAL-27细胞,预冷PBS清洗,加入500 μL结合缓冲液,依次加入5 μL 膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)与5 μL碘化丙啶(PI),室温避光孵育10 min,应用流式细胞仪检测细胞凋亡率。
1.2.6 蛋白免疫印迹(Western blotting)检测CDK1、MMP-2、Bcl2、Bax、JAK2/STAT3信号通路相关蛋白表达 收集各组口腔鳞癌CAL-27细胞,加入蛋白裂解液,冰上裂解30 min提取细胞总蛋白,测定蛋白浓度时严格按照BCA试剂盒说明书进行操作,100 ℃高温煮沸蛋白变性,按照每孔加入30 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜,封闭2 h,孵育一抗稀释液(CDK1稀释比1∶800,MMP-2、Bcl2、Bax、p-JAK2、p-STAT3稀释比1∶1 000,内参β-actin稀释比1∶1 000),4 ℃孵育过夜,TBST洗涤3次×15 min,孵育二抗稀释液(1∶2 000),孵育1 h,TBST洗涤,曝光,显影,凝胶成像分析系统及应用ImageJ软件分析各条带灰度值。
1.3 统计学方法 采用t检验、单因素方差分析、LSD-t检验。
2 结果
2.1 PCBP1-AS1在口腔鳞癌细胞株中的表达 与正常口腔上皮细胞HOK相比,口腔鳞癌细胞CAL-27、Tca8113、KB中PCBP1-AS1的表达水平显著降低(P<0.01),PCBP1-AS1在口腔鳞癌CAL-27细胞中的表达水平相对降低,因而选用口腔鳞癌CAL-27细胞进行后续研究(见表1)。
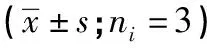
表1 qRT-PCR检测口腔鳞癌细胞株中PCBP1-AS1的表达
2.2 PCBP1-AS1对口腔鳞癌细胞CAL-27增殖的影响 pcDNA-control组与pcDNA-PCBP1-AS1组细胞中PCBP1-AS1表达量分别为1.00±0.13和3.05±0.38,差异有统计学意义(P<0.01)。相较于pcDNA-control组,pcDNA-PCBP1-AS1组口腔鳞癌CAL-27细胞增殖活力显著降低(P<0.01)(见表2)。
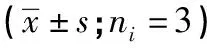
表2 PCBP1-AS1过表达对CAL-27细胞增殖的影响
2.3 PCBP1-AS1对CAL-27细胞侵袭的影响 实验结果显示,与pcDNA-control组相比,pcDNA-PCBP1-AS1组口腔鳞癌CAL-27细胞侵袭数显著减少(P<0.01)(见图1、表3)。
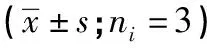
表3 PCBP1-AS1过表达对CAL-27细胞侵袭的影响

2.4 PCBP1-AS1对CAL-27细胞凋亡的影响 实验结果显示,相较于pcDNA-control组,pcDNA-PCBP1-AS1组口腔鳞癌CAL-27细胞凋亡率显著增加(P<0.01)(见图2、表4)。
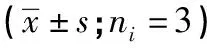
表4 PCBP1-AS1过表达对CAL-27细胞凋亡的影响
2.5 PCBP1-AS1对CAL-27细胞增殖、侵袭和凋亡相关蛋白表达的影响 与pcDNA-control组相比,pcDNA-PCBP1-AS1组口腔鳞癌CAL-27细胞中CDK1、MMP-2、Bcl2蛋白表达水平显著降低(P<0.01),Bax蛋白表达水平显著升高(P<0.01)(见图3、表5)。
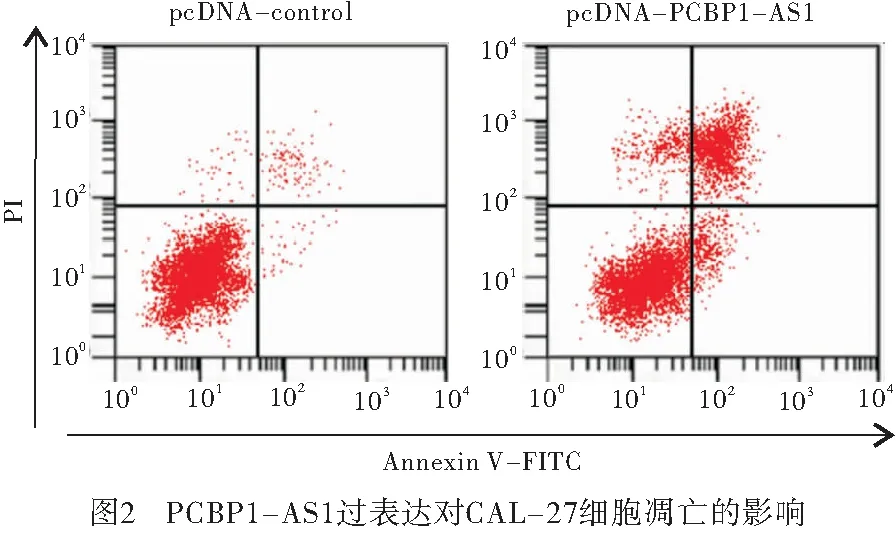

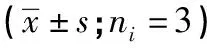
表5 PCBP1-AS1过表达对CAL-27细胞增殖、侵袭和凋亡相关蛋白表达的影
2.6 PCBP1-AS1对CAL-27细胞JAK2/STAT3信号通路相关蛋白表达的影响 实验结果显示,相比于pcDNA-control组,pcDNA-PCBP1-AS1组口腔鳞癌CAL-27细胞中p-JAK2、p-STAT3蛋白表达水平显著降低(P<0.01),JAK2、STAT3蛋白表达水平无明显变化(P>0.05)(见图4、表6)。
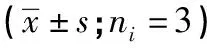
表6 PCBP1-AS1对CAL-27细胞JAK2/STAT3信号通路相关蛋白表达的影响
3 讨论
OSCC具有恶性程度高、浸润性强等特点,导致病人极易出现复发及转移,病人生存期较短且预后较差[8]。既往研究[9-10]显示LncRNA表达异常与OSCC发生发展密切相关。因此从LncRNA角度分析OSCC发病机制对早期诊断OSCC及评估病人预后均具有重要意义。

PCBP1-AS1在神经胶质瘤细胞中呈低表达,并可能参与肿瘤发生发展过程,PCBP1-AS1还可能在癌症等相关疾病发生发展过程中发挥重要作用[11-12]。为探究其表达水平及作用机制,本研究检测口腔鳞癌细胞系中PCBP1-AS1的表达量,结果显示PCBP1-AS1在口腔鳞癌细胞中的表达水平显著低于正常口腔上皮细胞,提示PCBP1-AS表达水平降低可能促进OSCC的发生。本研究通过上调PCBP1-AS1表达分析其对口腔鳞癌CAL-27细胞增殖、侵袭及凋亡的影响,结果显示PCBP1-AS1过表达可抑制CAL-27细胞增殖、侵袭,并可促进细胞凋亡,提示PCBP1-AS1过表达可降低OSCC细胞增殖及侵袭能力,诱导细胞凋亡。同时本研究进一步检测细胞增殖、侵袭及凋亡相关蛋白表达,结果显示PCBP1-AS1过表达后细胞中CDK1、MMP-2、Bcl2蛋白表达水平显著降低,Bax蛋白表达水平显著升高。CDK1可促进细胞周期由G2期进入M期从而促进细胞增殖,MMP-2可通过降解细胞外基质从而促进肿瘤细胞转移,Bcl2与Bax在细胞凋亡过程中发挥重要作用,Bax蛋白表达升高可促进细胞凋亡,Bcl2可抑制Bax表达从而发挥抗细胞凋亡作用[13-15]。因此,PCBP1-AS1过表达可通过上调Bax表达及下调CDK1、MMP-2、Bcl2表达从而减弱OSCC细胞增殖及侵袭能力,提高细胞凋亡水平。
JAK2/STAT3信号通路中STAT3经磷酸化的方式活化后可参与肿瘤细胞增殖、迁移及血管生成等多种生物学过程,研究表明通过JAK2/STAT3信号通路可参与结肠癌细胞增殖、凋亡、迁移及侵袭过程[16]。JAK2/STAT3信号通路还可参与肝细胞癌发生发展过程[17]。研究[18]报道指出抑制JAK2/STAT3信号通路可抑制多发性骨髓瘤生长并促进细胞凋亡。本研究结果显示PCBP1-AS1过表达后CAL-27细胞中p-JAK2、p-STAT3蛋白表达水平显著降低,说明PCBP1-AS1过表达抑制JAK2/STAT3信号通路激活。提示PCBP1-AS1过表达可能通过抑制JAK2/STAT3信号通路而影响OSCC细胞增殖、侵袭及凋亡行为。
综上所述,PCBP1-AS1过表达能够抑制OSCC细胞增殖、侵袭,促进细胞凋亡,其作用机制可能与抑制JAK2/STAT3信号通路激活有关,可为靶向治疗OSCC提供潜在靶点。但关于PCBP1-AS1如何调控下游miRNA/靶基因表达尚未可知,本研究仅从体外细胞实验探讨PCBP1-AS1对OSCC的作用,仍需进行体内实验及临床研究进一步明确PCBP1-AS1在OSCC发生发展中的重要作用。
