放射治疗流程中期评估作为临床治疗质控环节的必要性*
2021-03-13黄烨欧阳伟炜苏胜发李青松胡银祥王志勇张皓嘉栗蕙芹1洪卫卢冰
黄烨, 欧阳伟炜,, 苏胜发,, 李青松,, 胡银祥,, 王志勇, 张皓嘉,, 栗蕙芹1,2,, 洪卫, 卢冰,**
(1.贵州医科大学附属医院 肿瘤科, 贵州 贵阳 550004; 2.贵州医科大学 临床医学院 肿瘤学教研室, 贵州 贵阳 550004; 3.贵州医科大学附属肿瘤医院 & 贵州省肿瘤医院 肿瘤科, 贵州 贵阳 550004)
放射治疗的质量保证(quality assurance,QA)和质量控制(quality control,QC)越来越引起重视,保证放射治疗疗效的关键之一是建立完善的QA/QC体系。既往,QA/QC更多被理解为放射物理和技术领域的内容[1-3],然而除外放射物理技术QA/QC,放射治疗流程从放疗及技术的选择、靶区勾画、计划评估审核到计划实施和总结等各个环节均包含临床放射治疗领域内容,只有通过完成各环节中放射治疗QA/QC才能实现放射治疗肿瘤高效低毒、治疗利益最大化的目的[4]。至今,关于放射治疗流程中的步骤、环节作为临床QC并更合理的讨论较少,尤其是对放疗与药物联合的综合治疗流程的讨论更少。同步(期)放化疗已经是多种恶性肿瘤的标准治疗模式[5-7],与药物联合进行的放疗流程中肿瘤的变化规律与单纯放疗不同,放疗流程中期是否需要设定一个必须的放射治疗临床QC环节,这是保证肿瘤有效控制的同时,最大限度保护周围正常组织的原则。本研究以局部晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)为例,通过回顾性分析放疗流程中肿瘤产生不同治疗效应病例的急性放射性肺炎(radiation pneumonitis,RP)、放射性食管炎(radiation esophagitis,RE)、局部复发(local recurrence,LR)和局部无进展生存(local regional progressive-free survival,LRPFS)等指标,探讨局部晚期NSCLC在实施同期放化疗流程中将中期评估环节作为临床质控的必要性,为临床治疗实施和研究一致性提供参考。
1 对象与方法
1.1 对象
选择同期放化疗后近期疗效评价为部分缓解(complete remission,CR)和完全缓解(partial remission,PR)的Ⅲ期NSCLC患者资料,所有病例经病理学或细胞学证实、影像随访资料完整、KPS评分≥70分;所有患者完成放疗流程中期评估(治疗中期重新定位并图像融合)和同期放化疗(化疗≥2 个周期,放疗剂量≥50 Gy),治疗前签署知情同意书。
1.2 方法
1.2.1治疗方法 采用同期放化疗,放射治疗选择6MV-X线,调强放疗技术(intensity modulated radiation therapy,IMRT),热塑膜固定,初始(0 Gy)和放疗流程中期评估均采用相同的增强CT定位扫描(层厚5 mm)、靶区勾画、计划设计和评估原则,定义原发肿瘤(gross tumor volume,GTV)包括原发病灶(肺窗)和引流区转移淋巴结(纵膈窗)。临床靶区为结合解剖屏障肿瘤靶区(clinical tumor volume,CTV)三维方向外扩0.6 cm,计划靶区(planning target volume,PTV)为临床靶区边缘外扩0.5~1.0 cm,采用Pinnacle3系统完成计划设计。计划评估标准为95%处方剂量包括≥95%的PTV,或90%处方剂量包括≥98%的PTV。后程加速超分割放疗(首程分割剂量为2 Gy/次、1 f/d、 5 d/周;后程为1.5 Gy/次、 2 f/d、间隔6 h,5 d/周)。化疗以铂类为基础的两药联合方案,顺铂75~100 mg/m2、总剂量均分在第1~2天,或卡铂300~350 mg/m2、第2天;联合多西紫杉醇60~75 mg/m2、第1天,培美曲塞500 mg/m2、第1天,紫杉醇脂质体140~170 mg/m2、第1天。
1.2.2放射治疗及分组 患者在放疗至36~40 Gy时进行重新定位,CT扫描定位方式和条件与初治放疗计划(定义为0 Gy计划)一致,获取扫描图像后首先与0 Gy计划图像、GTV等进行融合。根据中期评估是否对靶区进行重新勾画,将入选病例分为修改靶区组和未修改靶区组,修改靶区组:定义融合后显示GTV体积明显缩小并重新勾画靶区,要求重新设计放疗计划的射野数目及路径、危及器官保护与0 Gy计划相同[8]。未修改靶区组:定义肿瘤体积无显著变化和移动,继续执行0 Gy计划。
1.2.3近期疗效评价 疗程结束后1个月内,采用实体肿瘤评价标准(response evaluation criteria in solid tumors,RECIST 1.0)评价近期疗效,完全缓解+部分缓解(CR+PR)为有效(RR)。
1.2.4肿瘤体积的计算 通过Pinnacle3计算GTV体积,肿瘤体积退缩百分比={[(0 Gy的GTV体积)-(中期评估的GTV体积)]/ 0 Gy的GTV体积}×100%。DVH获取正常肺V5(全肺接收5 Gy以上辐射剂量的体积百分比)和V20[整个放射疗程中,全肺(扣除靶区PTV)接受20 Gy以上的肺体积的百分比]、平均肺剂量(mean lung dose,MLD)和平均心脏剂量(mean heart dose,MHD)。
1.2.5随访分析 选取2008年12月—2014年12月符合标准的111例患者,末次随访时间为2017年3月,治疗结束后~2年内每3个月随访1次、2年以上每半年随访1次。采用CTCAE 4.03标准观察RP、RE、LR及 LRPFS,LR定义为原发病灶和(或)引流区转移淋巴结放疗后重新出现肿瘤病灶、残留病变进展,LRPFS定义为放疗开始至局部和(或)淋巴引流区受照射部位出现进展的生存时间。
1.3 统计学分析
采用SPSS 17.0软件,χ2、t检验分析基线数据、体积参数和毒性,Kaplan-Meier法并Log-rank检验进行生存分析,P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
将符合标准111例放化疗患者,分为修改靶区组78例和未修改靶区组33例,两组患者性别、年龄、分期、0 Gy时的GTV和PTV体积、处方剂量、正常肺和心脏剂量体积等基线资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
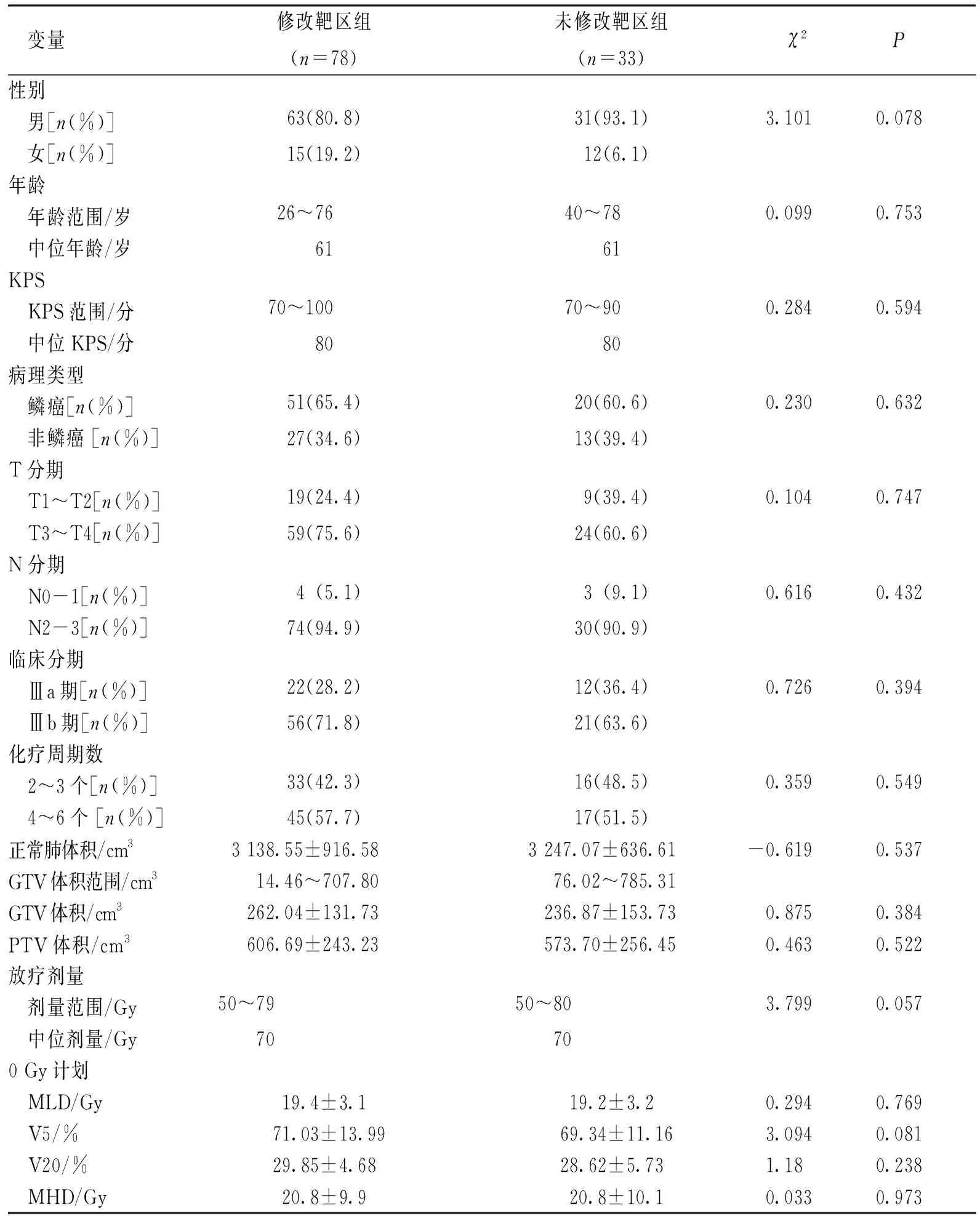
表1 111例Ⅲ期NSCLC患者同期放化疗流程中期评估临床特征Tab.1 The clinical features of 111 patients with NSCLC at stage Ⅲ during concurrent chemoradiotherapy at mid-term evaluation
2.2 靶区体积变化
111例入选病例中修改靶区组和未修改靶区组在36 Gy、40 Gy进行中期评估分别为74例和21例、4例和12例,修改靶区组中期评估时GTV缩小12.04%~84.95%,平均体积为(167.26±103.91)cm3,PTV平均体积为(461.06±205.46)cm3;未修改靶区组中期评估时GTV缩小0%~11.86%,平均体积为(227.95±148.87)cm3。结果表明,放射治疗中期修改靶区组和未修改靶区组GTV体积均有缩小,放疗流程的中期评估是必要的。
2.3 修改靶区组不同退缩体积患者中期评估比较
中期评估(36~40 Gy)后重新设计计划的正常肺和心脏剂量体积的MLD、V5和MHD分别为(18.67±3.98)Gy(t=2.160,P=0.034)、(68.60±14.91)%(t=2.971,P=0.004)和(19.64±10.20)Gy(t=2.158,P=0.034),V20为(28.70±5.26)%(t=1.958,P=0.054)。重新设计计划的正常肺和心脏剂量体积的MLD、V5和MHD较0 Gy(未修改靶区组)比较,差异有统计学意义(P<0.05)。根据GTV体积缩小15%为界[8],修改靶区组GTV体积缩小<15%、15%~29%、30%~49%、≥50%分别为7例、25例、22例、24例。与0 Gy计划比较,GTV体积缩小≥50%的患者正常肺和心脏剂量体积的MLD、V5、MHD显著降低,V20存在降低的趋势,而<50%患者的正常组织剂量体积差异无统计学意义(P>0.05)。见表2。

表2 修改靶区组GTV退缩后不同体积DVH的正常肺、心脏剂量体积参数比较Tab.2 Comparison of MLD, MHD, V5, and V20 at different dose-volume histogram (DVH) in after gross tumor volume (GTV) shrinkage in modified target group
2.4 急性放射性毒性
修改靶区组和未修改靶区组均无5级毒性、4级RE;修改靶区组和未修改靶区组0、1、2、3或3~4级2组病例RE、RP发生率比较,差异无统计学意义(χ2=5.590、0.942,P=0.133、0.815;表3);分层分析显示,修改靶区组GTV缩小<50%病例及≥50%的病例与未修改靶区组RE、RP值比较,差异均无统计学意义(P>0.05,表4)。

表3 修改靶区组与未修改靶区组急性放射性毒性比较[n(%)]Tab.3 Comparison of acute radiotoxicity between modified target and unmodified target groups[n(%)]
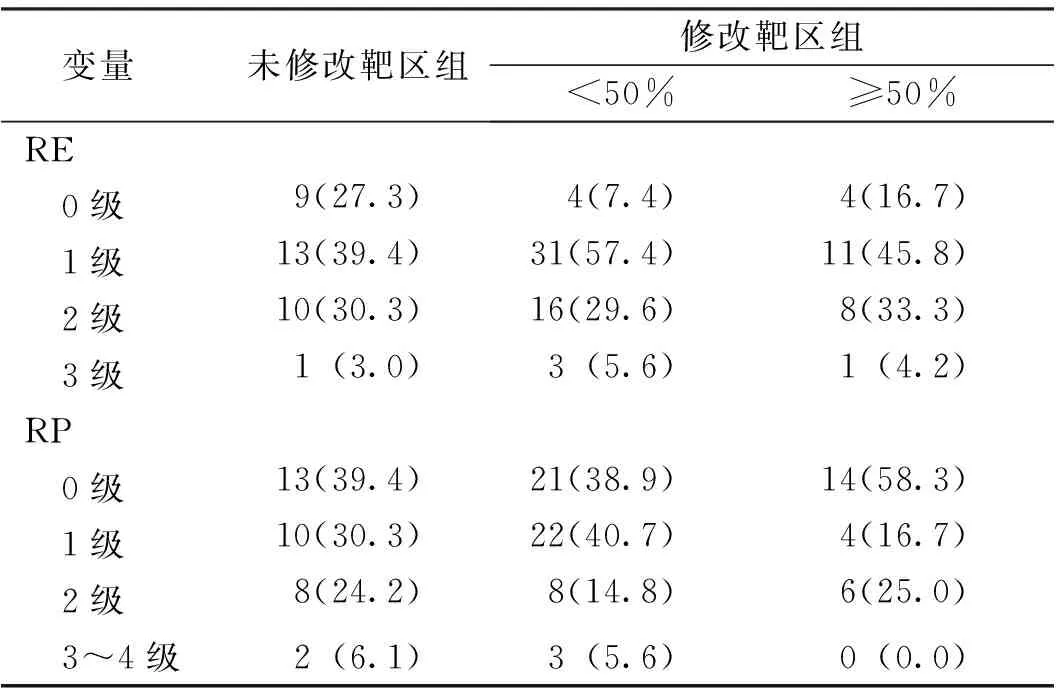
表4 修改靶区组GTV缩小≥50%和<50%与未修改靶区组急性放射性毒性比较[n(%)]Tab.4 Comparison of acute radiotoxicity between GTV shrinkage ≥50% and <50% in the modified target group and the unmodified group [n(%)]
2.5 中期评估修改靶区对LR和LRPFS的影响
修改靶区组和未修改靶区组的LR率分别为46.4%和42.3%,其中原发灶、引流区淋巴结、原发灶并引流区淋巴结复发率分别为61.1%(22例)、16.7%(6例)、22.2%(8例)和50.0%(8例)、12.5%(2例)、37.5%(6例),2组复发率比较,差异无统计学意义(χ2=1.322,P=0.516)。2组1、2、3、5年LRPFS比较,差异无统计学意义(χ2=0.034,P=0.854;图1)。进一步以修改靶区组中GTV体积缩小比率分层分析1、2、3、5年LRPFS,修改靶区组中GTV体积缩小≥50%、修改靶区组GTV体积缩小<50%与未修改靶区组比较,差异均无统计学意义(P>0.05)。见表5。
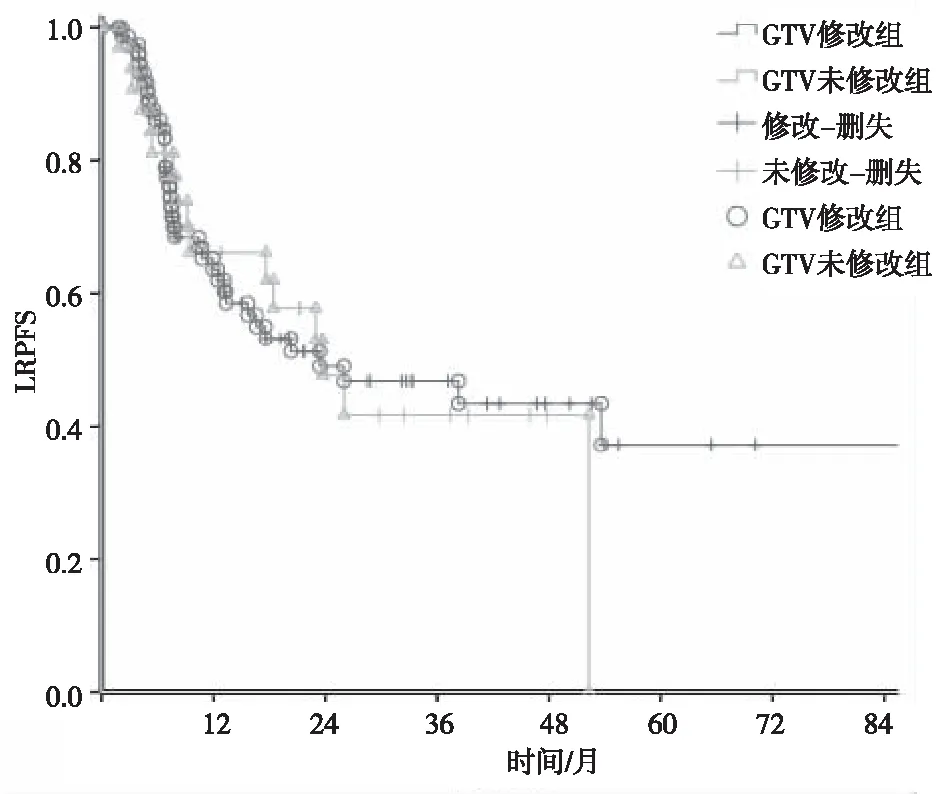
图1 修改靶区组与未修改靶区组LRPFS比较Fig.1 Comparison of LRPFS between modified target and unmodified target groups
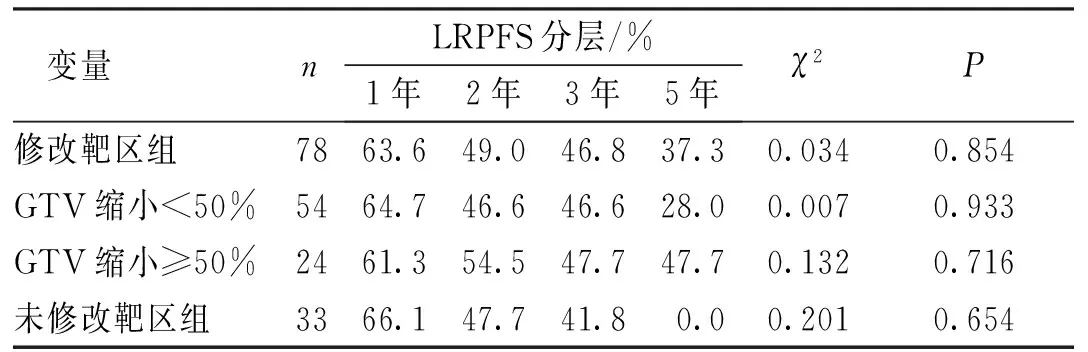
表5 中期评估修改靶区后LRPFS分层分析Tab.5 Stratified analysis of LRPFS after the midterm evaluation-based modification of the target area
3 讨论
放射治疗的宗旨是提高肿瘤控制率并降低正常组织放射性损伤,放射治疗全流程的QA/QC是达到这一目的的关键。从二维放疗时代已经受到关注,早期宫颈癌放射治疗的长期生存报道结果出现近1倍的差距的原因,分析是QA/QC不完善、不一致所致[9]。虽然近年SBRT、SRS应用于早期NSCLC[10]、脑转移[11]、寡转移[12]等,但是根据放射生物学原理,完成多分次照射的根治性放疗流程仍然是局部晚期NSCLC、鼻咽癌、前列腺癌等大部分恶性肿瘤的主要放疗方式[13-15]。因此,分次照射的根治性放疗流程存在各个需要重点关注的环节,除外放射物理技术机械参数、放射线物理参数等,诸如放疗及技术选择[16]、靶区勾画[17]、计划设计和评估[18]、疗效评价[19]等环节均是临床QA/QC,但是很少有将放疗流程实施的中期评估作为临床放疗质控环节的报道。在放疗流程中随着肿瘤剂量不断增加,产生治疗效应的肿瘤会出现体积缩小、浸润减少和位置移动等变化,而且与药物联合应用可以受到双重影响而与单纯放疗作用的变化不同。放化综合治疗疗效优于单纯放疗已是众所周知,同期放化疗模式下放疗流程中NSCLC的肿瘤体积缩小的变化规律研究显示随剂量增加肿瘤不断缩小,40 Gy剂量可使肿瘤平均体积缩小约50%[20],本研究以局部晚期NSCLC同期放化疗为例的研究显示,疗程结束后RR患者在放疗流程的中期评估发现,36~40 Gy时修改靶区组肉眼可见GTV明显缩小的比率为12.04%~84.95%,平均体积缩小36.26%,PTV平均体积缩小24%,GTV体积缩小≥50%为30.8%(24/78)。说明放疗流程实施过程中随着剂量的提高,有效患者的肿瘤不断缩小,如果继续0 Gy计划执行将使照射体积内正常组织的体积不断增大。而在相同处方剂量下肿瘤体积大小与放射损伤呈正相关[21],放射性损伤也与正常组织受照射体积、低剂量体积呈正相关[22],GTV体积缩小15%后重新设计放疗计划的正常肺低剂量体积可能显著降低[8],提示在放疗流程中适当的时机进行中期评估并调整放疗计划,有可能减少部分放射损伤的发生。本研究显示,中期评估时GTV明显缩小患者调整放疗计划比0 Gy计划的正常组织低剂量体积MLD、V5、MHD显著降低,V20显著降低趋势明显(P=0.054),进一步分层分析显示,GTV体积降低<15%、15%~49%患者的正常组织低剂量体积降低不显著,而剂量体积降低主要发生在GTV体积缩小≥50%的30.8%的病例中。虽然在临床观察中修改靶区组和未修改靶区组的RP、RE发生率无统计学意义(P>0.05),分层分析GTV体积缩小<50%或≥50%与0 Gy计划差异亦无统计学意义(P>0.05),但GTV体积降低≥50%患者仅发生1~2级RP,而无≥3级的RP发生,虽然例数较少,仍然提示减少局部晚期NSCLC同期放化疗发生8%左右重度RP的可能[23-24]。
靶区修改的另一方面疑问是对局部疗效是否产生影响。本研究显示,修改靶区组的原发灶、引流区淋巴结、原发灶和引流区淋巴结的复发率分别为61.1%、16.7%、22.2%,无明显增加[25],与未修改靶区组无显著差异,表明中期评估时根据GTV缩小的边界修改靶区后局部复发率未明显增加。为避免局部晚期NSCLC主要失败因素之一的远处转移影响,进一步采用LRPFS分析修改靶区的可行性,结果显示修改靶区组比未修改靶区组、修改靶区组GTV缩小<50%和≥50%相比较或分别与未修改靶区组比较,LRPFS均无显著差异,进一步提示放射治疗流程实施36或40 Gy时按照GTV退缩而缩小GTV边界并重新调整放疗计划的中期评估环节对局部控制率无显著影响,安全可行。
综上所述,将多分次放射治疗流程实施过程中进行的中期评估作为放射治疗临床QA/QC的一个质控环节很有必要,可能在不影响疗效的同时降低正常肺、心脏受照射的剂量体积,减少部分病例发生重度放射性损伤,尤其对于放疗效应明显、生存期较长的患者可能更有利。
