家蝇抗真菌肽-1A对人肝癌细胞HepG2的影响*
2021-03-13吴坤张迎春邓思波黄敏慧吴建伟陈峥宏王涛
吴坤, 张迎春, 邓思波, 黄敏慧, 吴建伟, 陈峥宏**, 王涛**
(1.贵州医科大学 基础医学院, 贵州 贵阳 550025; 2.贵州省普通高等学校病原生物学特色重点实验室, 贵州 贵阳 550025)
原发性肝癌(primary hepatic carcinoma,PHC)是常见的恶性肿瘤之一,全世界PHC死亡病例占所有恶性肿瘤死亡病例的8.2%,其死亡率在恶性肿瘤中排第4位[1];其中来源于肝细胞的肝细胞癌最为常见,占85%~90%[2]。目前,PHC常用的临床治疗方法主要有外科手术、放疗及化疗等,但手术切除后存在PHC复发率和转移率高,放疗、化疗又存在特异性及敏感性较差的问题[3-5]。因此,寻找安全有效的抗肿瘤治疗技术和药物已成为亟需解决的问题。抗菌肽(antimicrobial peptides,AMPs)是生物体应对外界病原体而产生的一种小分子阳离子活性肽,在先天性免疫中发挥着重要作用[6-7]。目前研究发现,AMPs不仅对细菌、真菌、寄生虫及病毒等病原生物具有很强的抑杀活性,还对肿瘤细胞有着选择性杀伤作用,因此受到国内外研究者的广泛关注[8-10]。家蝇抗真菌肽-1A(Muscadomesticaantifungal peptide-1A,MAF-1A)是来源于家蝇幼虫的新型AMPs,由26个氨基酸残基组成的α螺旋线性多肽[11-13]。课题组前期研究发现,MAF-1A 不仅能抑杀白念珠菌、甲型流感病毒等多种病原微生物,且对人肝癌细胞HepG2等肿瘤细胞的体外增殖也具抑制活性[12,14]。本研究在此基础上,进一步探讨MAF-1A对人肝癌细胞HepG2的抑制作用,现将结果汇报如下。
1 材料与方法
1.1 材料
1.1.1细胞株 肝癌细胞HepG2由贵州医科大学生物工程实验室惠赠,人正常肝细胞LO2由贵州医科大学病理生理教研室惠赠。
1.1.2主要试剂和仪器 杜氏改良伊格尔培养基(dulbecco's modified eagle medium, DMEM)及磷酸盐缓冲液(phosphate buffered saline,PBS;美国GIBCO),二甲基亚砜(dimethyl sulfoxide,DMSO)试剂(北京索莱宝),胎牛血清(杭州四季青),噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)试剂(北京索莱宝)及乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒(南京建成);XDS-1B倒置显微镜(重庆光学),EPOCH2酶标仪(美国Biotek),MCO-5M CO2培养箱(日本三洋),KL05R低速冷冻离心机(湖南凯达)及L500台式低速离心机(湖南湘仪)。
1.2 方法
1.2.1MAF-1A储备液的制备 按文献[11]方法采用原核载体串联表达,镍柱亲和层析纯化、脱盐浓缩,MAF-1A储备液浓度为5 000 mg/L,分装后置于-80℃冰箱冷藏备用。
1.2.2细胞培养 HepG2、LO2细胞培养于含10%胎牛血清的DMEM完全培养基,培养基添加终浓度100 000 U/L青霉素和0.1 g/L的链霉素,将细胞置于含有5%CO2的37 ℃细胞培养箱中培养;细胞贴壁生长近80%后,弃培养液,PBS洗涤后加入适量的胰酶消化,加含有胎牛血清培养液中止消化,1 000 r/min离心3 min,取适量比例的悬浮细胞传代培养。
1.2.3倒置显微镜观察HepG2细胞形态学特征 取HepG2细胞按1×105个/孔接种于6孔板,总体积为2 mL/孔,置37 ℃的5%CO2细胞培养箱培养12 h,加MAF-1A使其终浓度为0、100及200 mg/L,继续培养24 h,于倒置显微镜下观察细胞形态;每个浓度设置3个复孔,同时设置正常生长对照。
1.2.4MTT法检测HepG2、LO2细胞的生存率 取对数生长期的HepG2、LO2细胞分别按5×103个/孔接种于96孔培养板,100 μL/孔,置37 ℃的5%CO2培养箱培养12 h,加MAF-1A使其终浓度为0、25、50、100 、200、400及800 mg/L,继续培养24 h;MTT加入培养物作用4 h,加DMSO 150 μL,置摇床20 min;酶标仪设定波长为490 nm,记录各组细胞相应吸光度(optical density,OD)值,并通过公式计算细胞生存率[细胞生存率(%)=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%],同时实验设正常肝细胞LO2组及生长对照组,每组设3个复孔。
1.2.5LDH释放试验检测HepG2细胞的破坏性 取对数生长期的HepG2细胞按5×103个/孔接种于96孔微孔板中,100 μL/孔,置于含5%CO2的37 ℃细胞培养箱培养12 h后,MAF-1A加入微孔板使其终浓度为0、25、50、100 、200及400 mg/L,培养24 h;同时设立空白对照组(不含细胞上清液)、阳性对照组(添加1%TritonX-100),每组设置3个复孔;按试剂盒使用说明添加试剂后,使用酶标仪检测吸光值并计算LDH释放率[LDH释放率=(测定OD值-空白对照OD值)/(阳性对照OD值-空白对照OD值)×100%]。
1.2.6划痕愈合试验检测HepG2细胞的迁移能力 取对数生长期的HepG2细胞按1×105个/孔接种于6孔板,待细胞贴壁长满时,用20 μL移液枪头尖端刮擦;PBS液洗涤细胞3次,每孔加入10 mmol/L羟基脲,将细胞置于终浓度为0、100及200 mg/L的MAF-1A新鲜培养基中孵育,分别在刮擦细胞0、12及24 h时于倒置显微镜下观察划痕距离,随机选取3个视野拍照,使用Image J软件分析划痕面积,计算迁移率[迁移率(%)=(0 h划痕面积-12或24 h划痕面积)/0 h划痕面积×100%];设置未经MAF-1A处理的HepG2细胞为对照组。
1.2.7红细胞体外溶解试验检测MAF-1A的溶血活性 将新鲜抽取的人肘正中静脉血注入含有抗凝剂(阿氏液)的离心管中,经3 500 r/min离心5 min,弃上清液,PBS洗涤3次,PBS调整红细胞浓度为1%的体积分数;用PBS把MAF-1A配置目标浓度为100、200、400、800、1 200 、1 800及2 400 mg/L,取50 μL,再加等体积的红细胞悬液,以1%Triton X-100为阳性对照,PBS设为阴性对照,37 ℃暗室孵育1 h,以3 500 r/min离心5 min;将上清液依次加入新的96孔板,波长562 nm测定OD值,并计算溶血率[溶血率(%)=(检测孔OD值-阴性孔OD值)/(阳性孔OD值-阴性孔OD值)×100%]。
1.3 统计学分析
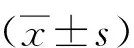
0 mg/L MAF-1A组 100 mg/L MAF-1A组 200 mg/L MAF-1A组图1 各组HepG2细胞的镜下形态学(100×)Fig.1 Morphological changes of MAF-1A in different concentrations on HepG2 cells(100×)
2 结果
2.1 显微镜下HepG2的形态
MAF-1A作用HepG2细胞24 h后,镜下可见HepG2细胞出现表面皱褶,形状变为扁平,细胞膜不完整、细胞破裂,细胞死亡脱落等明显的细胞病变效应(cytopathic effect,CPE);MAF-1A浓度越高,CPE越显著。见图1。
2.2 MAF-1A对HepG2、LO2细胞的抑制作用
结果显示,各浓度组MAF-1A均对HepG2细胞有抑制作用,随着浓度增高,抑制作用增强,MAF-1A实验组与正常HepG2细胞0 mg/L MAF-1A组比较,差异有统计学意义(P<0.05或P<0.01);人正常肝细胞LO2的存活率明显高于HepG2细胞,当MAF-1A浓度达800 mg/L 时,生存率为(84.67±2.51)%。见图2。

注:与0 mg/L MAF-1A组比较,(1)P<0.05,(2) P <0.01。图2 不用浓度MAF-1A对LO2和HepG2细胞生存率的影响Fig.2 Effect of MAF-1A in different concentrations on the survival rate of LO2 cells and HepG2 cells
2.3 MAF-1A对HepG2细胞LDH释放率的检测
结果显示,MAF-1A作用HepG2细胞24 h后,细胞释放LDH的量增多,且LDH的释放率随着MAF-1A浓度的升高而增大(P<0.01)。见图3。

注:(1)与0 mg/L MAF-1A组比较,P<0.01。图3 不同浓度MAF-1A对HepG2细胞LDH释放的影响Fig.3 Effect of MAF-1A in different concentrations on LDH release from HepG2 cells
2.4 MAF-1A对HepG2细胞迁移能力的影响
细胞划痕愈合实验结果显示,100和200 mg/L MAF-1A均能抑制HepG2细胞的迁移运动,高浓度MAF-1A的抑制作用更为明显(P<0.05)。见图4和表1。

表1 不同浓度MAF-1A对HepG2细胞迁移运动的抑制率Tab.1 Inhibition rate of MAF-1A in different concentrations on HepG2 cell migration
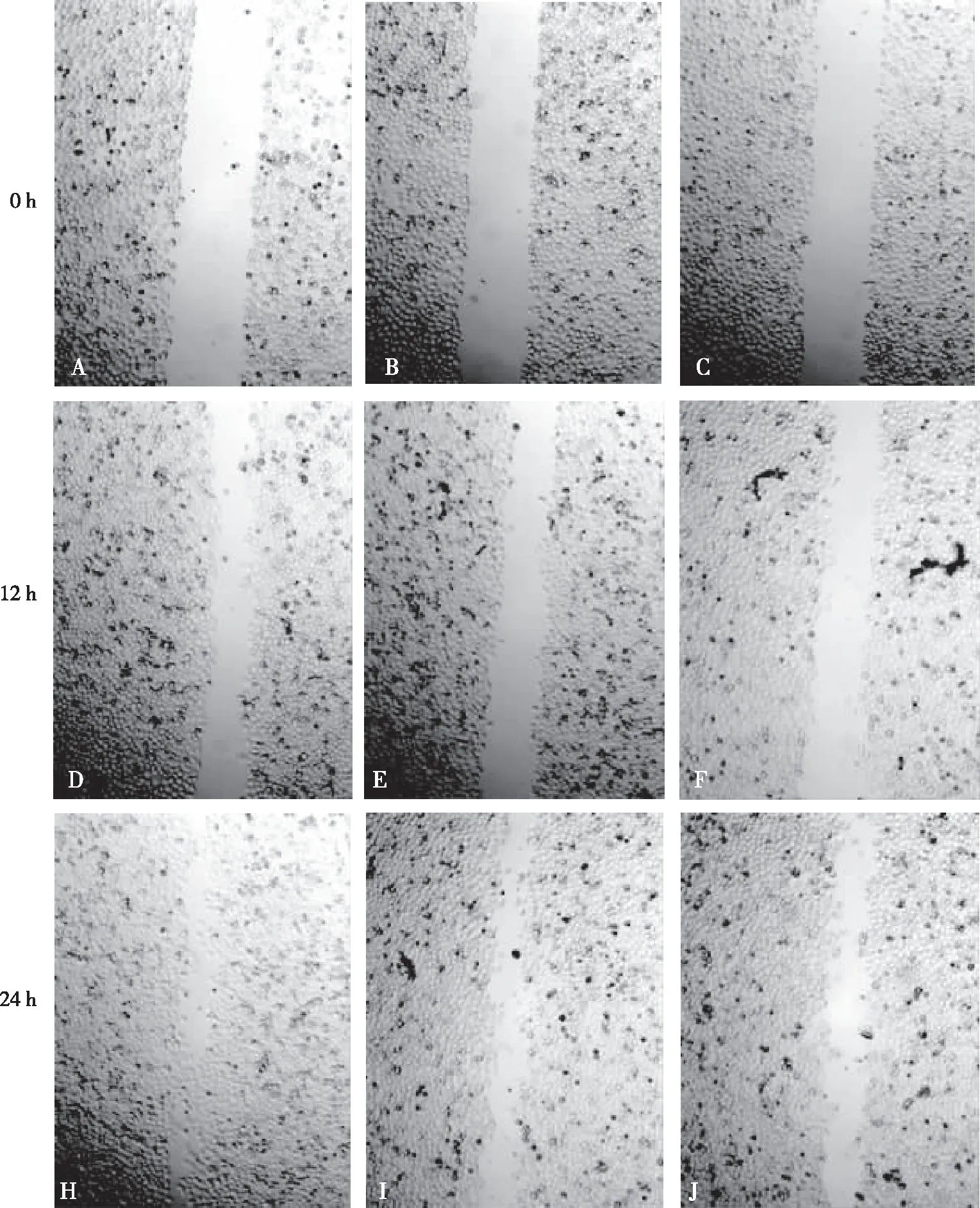
注:A、D及H为0 mg/L MAF-1A组,B、E及I为100 mg/L MAF-1A组,C、F及J为200 mg/L MAF-1A组。图4 不同浓度MAF-1A对HepG2细胞迁移运动的影响(100×)Fig.4 Effect of MAF-1A in different concentrations on HepG2 cell migration(100×)
2.5 MAF-1A体外溶血活性
体外溶血实验结果显示,MAF-1A浓度低于1 200 mg/L时,溶血率均为0%;MAF-1A浓度为1 800 mg/L时,溶血率为0.21%;MAF-1A浓度达2 400 mg/L时,溶血率<1%。
3 讨论
肝癌是一种死亡率极高的恶性肿瘤,我国近年来肝癌新发病例达36.5万例,致死率在恶性肿瘤中排第2位[15]。目前,药物化疗是肝癌治疗中的重要组成部分,但临床常用的抗肿瘤药物治疗效果不理想,不良反应和副作用较明显,且肿瘤细胞对部分药物已出现耐药现象[16-18]。近期研究发现,AMPs对肿瘤细胞有杀伤作用,且有毒副作用较弱、不易引起肿瘤细胞产生耐药等特点,具有成为新型抗肿瘤药物的潜力,目前已成为国内外抗肿瘤治疗研究的热点[19-21]。
文献报道,抗菌肽TT-1在体内外对甲状腺癌细胞具有显著的杀伤作用[22];多肽9R-P201可抑制人肝癌细胞HepG2的增殖和迁移[23];β-防御素能抑制结肠癌细胞的转移,其抑制程度与作用浓度成正相关[24];来源于家蝇胚胎细胞的AMPs能有效杀伤人髓样白血病细胞K562细胞,且对人脐静脉血管内皮细胞无明显毒性作用[25]。本研究形态学观察发现,MAF-1A作用于HepG2细胞后,细胞出现形态改变、死亡脱落等明显的细胞病变现象;MTT法检测发现,MAF-1A可抑制人肝癌细胞HepG2细胞的增殖(P<0.05或P<0.01),而且抑制作用呈剂量依赖性,且MAF-1A对正常肝细胞LO2的生存率无明显影响;LDH从细胞中的释放被视为细胞死亡的指标之一[26],通过细胞LDH释放检测发现,MAF-1A作用HepG2细胞后,能够促进LDH释放到细胞外,且呈浓度依赖性(P<0.01),提示 MAF-1A可导致HepG2细胞的死亡。体外溶血实验结果显示,MAF-1A的浓度达2 400 mg/L时,仅表现出微弱的溶血性。以上研究结果表明,MAF-1A对HepG2细胞具有抑制和杀伤作用,对人正常LO2细胞及红细胞的毒性作用较小,提示 MAF-1A 对肿瘤细胞的作用有一定的选择性。
迁移和侵袭是恶性肿瘤发展的关键,也是临床治疗的难题,一旦肿瘤发生了转移,其治疗更加困难,所以控制肿瘤的迁移和侵袭是抗肿瘤药物研究的一个重要方向[27]。研究报道,家蝇幼虫抗菌肽粗提取物能抑制HepG2的增殖,且以浓度依赖方式抑制HepG2细胞的迁移从而发挥抗肿瘤活性[28]。本研究中细胞划痕愈合实验结果显示,MAF-1A能够抑制HepG2细胞的迁移运动,并且随着MAF-1A浓度的增加,HepG2细胞的愈合面积降低(P<0.05),表明MAF-1A能够剂量依赖地抑制HepG2细胞的迁移。
综上所述,本研究发现MAF-1A不但可以抑制HepG2细胞的增殖,还可抑制HepG2细胞的迁移运动,但对人体正常肝细胞和红细胞的毒性作用不明显,具有一定的开发利用价值。然而MAF-1A抗HepG2细胞作用机制尚不清楚,有待于进一步研究。
