一株拟青霉属黑木耳病原真菌的生物学特性研究*
2021-03-12钟丽娟池景良赵新海张庆华关艳丽
钟丽娟,池景良,陈 飞,赵新海,张庆华,韩 冰,关艳丽
(辽宁省微生物科学研究院,辽宁 朝阳 122000)
2018年在辽宁省朝阳市喀左县开展食用菌产业科技服务工作时,发现黑木耳菌棒在菌丝生长期,易发生疑似黄曲霉(Aspergillus flavus Lk.)侵染引起的竞争性杂菌病害,菌棒发病率达20%。该病发病较快,接种后10 d~15 d菌棒即出现染菌症状,染病初期出现白色菌丝,相较正常的黑木耳菌丝生长稀疏;染病后期菌棒变浅黄色,塑料膜下可见大量黄色粉状孢子,其外观状态与黄曲霉侵染引起的病害症状相似,严重危害黑木耳生产。为进一步明确病害发生原因,对染病菌进行了显微镜检,发现该病原菌分生孢子梗为瓶梗型,即基部球形或椭圆形膨大,向上变细呈明显的颈部。菌丝有横隔,顶端不形成膨大的顶囊,其分生孢子梗经过多次分枝,产生几轮对称或不对称的小梗,形如扫帚状,其形态特征与黄曲霉具有典型椭圆形或近球形的顶囊有明显区别,而与《真菌鉴定手册》中描述的拟青霉属真菌形态相近[1]。
目前关于食用菌生产中因曲霉属(Aspergillus)、木霉属(Trichoderma)、青霉属(Penicillium)、拟青霉属(Paecilomyces)等杂菌引起的病害研究都集中在综合防治等方面,如徐志伟[2]、宋睿男[3]等报道了食用菌生产中常见病害的鉴定及其防治方法,从原料选择、培养期环境温湿度控制、各环节人员操作注意事项等方面提出了综合防治策略,而对生产中造成危害的病原菌所开展的研究并不多。杨武等[4]分离出黑木耳绿霉病的病原菌为长枝木霉(Trichoderma longibrachiatum),并测定98%咯菌腈10倍稀释液对该菌的抑菌率可达97.8%;赵瑞华等[5]对工厂化海鲜菇菌包污染霉菌进行了分离鉴定,研究表明克霉灵和多菌灵可以有效防治木霉和青霉等杂菌。可见,综合防治措施是建立在对每一种病原菌细致研究的基础上系统整合而成,特别是对于新发生、不常见的病害,其病原菌生长特性的全面研究对于针对性地提出有效防治措施非常必要。因此,通过分离纯化黑木耳菌丝生长期危害较严重的竞争性杂菌,开展形态学和分子生物学鉴定,明确病原种类,并开展生物学特性研究,旨在为该类病害的综合防治提供理论依据。
1 材料与方法
1.1 培养基
综合PDA培养基:马铃薯(去皮)200 g、葡萄糖 20 g、KH2PO43 g、琼脂 18 g、MgSO4·7H2O 1.5 g,蒸馏水1 000 mL,pH自然,121℃灭菌30 min,倒平板后冷却备用。
1.2 菌株来源
2018年3月取喀左县黑木耳栽培基地染菌棒,采用组织法分离[6]。菌种分离纯化方法按参考文献[4],将染病菌棒于无菌条件下剪开,用接种针挑取不同部位染病培养料,接种至综合PDA培养基中央,重复6次。后于28℃培养72 h,观察菌落形态特征。挑取目的菌落进行镜检,其分生孢子梗为瓶梗型,浓密不规则分支,扫帚状,分生孢子串生。挑取目的菌落边缘菌丝,接种至综合PDA培养基中央,经2次~3次纯化后,将菌种转接至斜面综合PDA培养基上,28℃培养72 h后置于4℃冰箱保存,标记为SM-01。
1.3 菌株鉴定
1.3.1 菌株形态学鉴定
挑取约0.5 cm×0.5 cm的冰箱保藏菌株组织块,接种于综合PDA培养基中央,共10个重复。其中5皿平板用于观察菌落形态;另外5皿平板用灭菌的镊子各斜插入4片灭菌盖玻片,距离接种点约2 cm,用于观察菌丝及孢子等显微形态。将各平板置于28℃培养,培养72 h后观察菌落生长情况,及时进行分生孢子梗、分生孢子及菌丝的显微观察。
参照《真菌鉴定手册》[1]《中国真菌志第三十五卷青霉属及其相关有性型属》[7]、Brown等[8]的方法进行菌株形态学鉴定。
1.3.2 菌株 ITS 序列分析
菌丝体DNA提取参考刘艳梅等[9]、张晓利等[10]的方法并略加改进,考虑到试验菌株生长至72 h已产孢,为获得相对纯度高的DNA样品,选择收集培养48 h的菌丝,无菌水洗涤2次后,用无菌滤纸吸干菌丝表面水分,装入EP管于-20℃保存备用。DNA提取使用上海生工生物工程股份有限公司Ezup柱式真菌基因组DNA抽提试剂盒。PCR引物选择通用引物 ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)和 ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)。反应体系及反应条件参照王小欣[11]方法进行。扩增产物由上海生工生物工程股份有限公司(上海)进行纯化与测序。测序结果在NCBI上进行Blast比对,并将菌株SM-01 ITS序列与已报道的拟青霉属菌株进行比较,采用MEGA 7.0构建系统发育树。
1.4 菌株SM-01生物学特性研究
1.4.1 菌块准备
将4℃冰箱保藏的菌株转接至综合PDA平板,培养72 h至菌落直径60 mm左右,用直径为6 mm的打孔器沿菌落边缘打取菌块备用。
1.4.2 温度试验
将菌块接种至综合PDA平板中央,共接种18皿,每3皿为一组,分别放置于15℃、20℃、25℃、30℃、35℃、40℃恒温培养箱中培养3 d,使用游标卡尺,采用十字交叉法测定菌落直径。
1.4.3 pH 试验
将综合 PDA 培养基用 1 mol·L-1HCl和 1 mol·L-1NaOH分别调pH至6、7、8、9,制成不同pH的培养基。每种pH培养基制备3皿平板,并标记清楚,将菌块接种至各平板中央,置于28℃恒温培养箱中,倒置培养4 d,使用游标卡尺,采用十字交叉法测定菌落直径。
1.4.4 统计
计算菌丝生长速率,试验数据用SPSS 25.0进行差异显著性检验。菌丝生长速率(V,mm·d-1)的计算公式为:

式中:S为菌丝生长长度(mm);D为菌丝生长天数(d)。
2 结果与分析
2.1 菌株SM-01鉴定结果
染病菌棒形态特征见图1。

图1 染病菌棒形态特征Fig.1 Characteristics of fungi sticks infestation by pathogens
由图1可知,正常黑木耳菌棒应为白色菌丝,而该病原菌导致的黑木耳染病菌棒为浅黄色或浅黄褐色,表现为花棒的形态,塑料膜下可见大量黄色粉状孢子,其外观状态与黄曲霉侵染引起的症状相似,菌株SM-01在综合PDA培养基上的菌落形态见图2,显微形态见图3。

图2 菌株SM-01在综合PDA培养基上的菌落形态Fig.2 Colony morphology of strain SM-01 grown on PDA medium
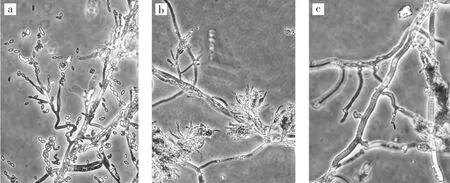
图3 菌株SM-01显微形态Fig.3 Microscopic morphology of strain SM-01
如图2、图3所示,采用组织分离法从染病菌棒中分离出病原菌SM-01,在综合PDA培养基上,28℃培养120 h,菌落直径90 mm左右,菌落绒毛状、平展,边缘整齐,菌落初期白色,产孢后呈土黄色,菌落背面白色。光学显微镜下,菌丝无色透明,有分隔,直径 2.1 μm~3.5 μm。分生孢子梗为瓶梗型,基部球形或椭圆形膨大,向上变细呈明显的颈部,大小约 (6.3~15.2)μm× (1.5~2.3)μm,浓密分枝,无明显规律。分生孢子椭圆形,串生,长链,大小约 (2.3~3.4)μm× (3.5~5.2)μm。
该菌株显微形态学特征与拟青霉属真菌和穗霉属真菌描述相似[1]。拟青霉属真菌的瓶梗着生于不规则分支的分生孢子梗上,或形成轮生体;瓶梗基部膨大,向上突然变细成一长颈,分生孢子链状,分生孢子椭圆形;穗霉属真菌分生孢子梗分支多,顶部轮生辐射状松散排列的分生孢子梗,分生孢子串生,球形,长圆形或梭形。拟青霉属真菌菌落多为黄色至黄褐色,穗霉属真菌菌落多为白色和浅色的菌落,试验菌株菌落颜色为黄褐色,其形态特征更符合拟青霉属真菌特征。按Brown&Smith[8]的分类检索方法,将穗霉属、青霉属和棒束孢属(Isaria)中的很多种列入拟青霉属中,指出拟青霉与其近缘属青霉和胶帚霉(Gliocladium)的主要区别是,其瓶梗基部膨大,向上变细的颈部多弯曲,常偏离主轴。瓶梗着生情况复杂,有的呈轮状,有的不规则地丛生于短的小枝上,有的单个分散于气生菌丝上。分生孢子链状,一些种在潮湿条件下可形成倾斜排列的链,甚至可粘结成疏散的球头状。菌落白色或灰白、淡褐色,偶尔具淡绿色,但绝不呈真正的绿色。因此,根据形态学描述,初步鉴定试验菌株为拟青霉属(Paecilomyces)真菌。
为进一步明确菌株SM-01的分类地位,对其进行ITS序列分析,通过PCR扩增获得581 bp的ITS序列,登录NCBI系统进行Blast比对,并将菌株SM-01的ITS的序列与已报道的拟青霉属菌株进行比较,采用MEGA 7.0构建的系统发育树见图4。

图4 菌株SM-01基于ITS序列的系统发育树Fig.4 Phylogenetic tree of strain SM-01 based on ITS sequences
由图4分析结果显示,菌株SM-01与 Paecilomyces formosus F3、Paecilomyces formosus DW11、Paecilomyces formosus M1861等菌株的ITS序列同源性为100%,通过1 000次自举分析(Bootstrap)进行系统进化分析,该菌与Paecilomyces formosus F3亲缘关系最为密切,Bootstrap值为70%,构建的进化树较为可靠。
2.2 菌株SM-01生物学特性测定
2.2.1 温度对菌株SM-01菌丝生长的影响
温度对菌株SM-01菌丝生长的影响结果见图5。
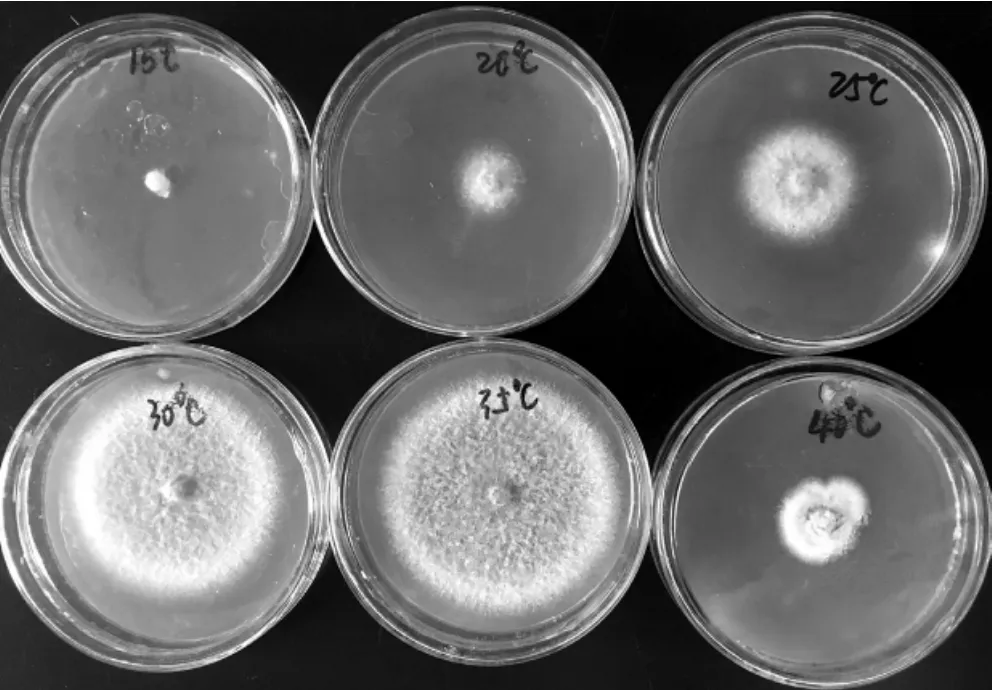
图5 温度对菌株SM-01菌丝生长的影响Fig.5 Effect of temperature on mycelium growth of strain SM-01
通过测定,在温度15℃、20℃、25℃、30℃、35℃、40℃条件下,菌丝生长速率分别为0.46 mm·d-1、3.44 mm·d-1、5.70 mm·d-1、10.98 mm·d-1、 11.99 mm·d-1、3.30 mm·d-1,差异显著 (P<0.05)。由图5可知,菌株SM-01对温度较为敏感,菌丝在30℃~35℃生长快速,该条件下菌丝生长速率约为25℃时的2倍,与其他各处理差异显著;温度低于15℃时,菌丝几乎不生长;温度低于20℃时,菌丝生长缓慢,生长状态正常;温度高于40℃,菌丝生长缓慢,菌落颜色为白色,生长状态与其他处理不同。
2.2.2 pH对菌株SM-01菌丝生长的影响
pH对菌株SM-01菌丝生长的影响见图6。

图6 pH对菌株SM-01菌丝生长的影响Fig.6 Effect of pH on mycelium growth of strain SM-01
由图2、图6可知,结合生产中配方pH的实际情况,在pH为6、7、8、9条件下,菌丝生长速率分别为 10.33 mm·d-1、9.30 mm·d-1、8.79 mm·d-1、8.36 mm·d-1,差异显著 (P<0.05)。菌株 SM-01 菌丝在供试pH条件下均生长良好,且相较而言中性偏酸性条件下菌丝生长略优于弱碱性条件。
3 讨论与结论
通过形态学鉴定和ITS序列分析,明确了1株黑木耳染菌病原菌SM-01隶属于半知菌亚门(Deuteromycotina)丝孢纲 (Hyphomycetes)丛梗孢目 (Monilales)丛梗孢科 (Monilaceae)拟青霉属(Paecilomyces)真菌 (Paecilomyces formosus),对其生物学特性进行了初步研究。结果表明,该菌的菌丝生长最适温度为30℃~35℃,在pH 6~9的培养基中菌丝生长良好,酸性条件更适宜其生长。在2019年和2020年未发现该菌危害,结合2018年菌种及原料检测结果,推测病害发生是随机导致。防治该病害的策略主要可通过控制培养温度,在黑木耳生产过程中常存在养菌温度超过30℃的高温养菌现象,不仅会造成黑木耳菌丝受损,还会加重霉菌发生[12],结果表明当温度低于25℃时,菌株SM-01生长缓慢,因此在生产中应注意培养期的温度管理,以避免霉菌优先生长[13]。
通过检索万方数据库、CNKI全文数据库和springlink外文数据库,发现关于该菌的报道较少,研究时间集中在2012年至今,研究方向为其代谢产物和对人体的致病性等方面。Bulla等[14]研究表明该菌可以降解多种染料,具有环境修复潜力,Saqib等[15]测试了从黄瓜根系中分离出的Paecilomyces formosus LHL10的酶抑制潜力,结果表明其乙酸乙酯提取物对脲酶和α-葡萄糖苷酶具有明显的抑制潜力。Heshmatnia等[16]报道了该菌可导致成年人慢性肉芽肿。曲霉属、木霉属、青霉属等有害菌一直严重危害食用菌生产,引起营养竞争性病害,是导致培养期菌棒染菌的主要原因[17]。医学研究表明,曲霉属能够引起肺曲霉病[18];木霉属真菌长梗木霉(Trichoderma longibrachiatum)可感染人体引起侵袭性腹膜炎[19];拟青霉属真菌宛氏拟青霉(Paecilomyces variotii)可导致人体肺部感染;淡紫拟青霉[Paecilomyces lilacinus(Thorn.)Samson]会引起人体眼角膜溃疡[20-21]。通过研究明确了一种导致黑木耳培养期病害的病原菌分类所属,进而对其生物学特性和危害进行研究,为其后续的防治及人员安全防护提供理论依据。但目前在食用菌生产中往往容易忽视人体安全防护问题,因此建议从业人员在进行生产操作时,应加强必要的劳动保护,如佩戴口罩、手套等。
