赤子爱胜蚓(Eisenia fetida)EROD活性测定的HPLC法的建立
2021-03-11李玲玲宋玉芳
李玲玲, 宋玉芳, 史 奕
(1. 合肥师范学院 生命科学学院, 安徽 合肥 230009;2. 中国科学院沈阳应用生态研究所 污染生态与环境工程重点实验室, 辽宁 沈阳 110016)
细胞色素P450(CYP450)混合代谢酶广泛存在于动物、植物和微生物体内,直接参与内源及外源物质的解毒过程,这一性质使其成为环境污染毒性指示的生物标志物.研究表明,CYP450可对低浓度污染物的毒性效应起指示作用.CYP450酶系中的单一亚酶活性或基因对污染物胁迫具有特异敏感性响应,利用这些CYP450亚型同工酶及相关基因对污染物的敏感性和选择性特征,可为低浓度污染物毒性效应提供敏感生物标志物,且可进一步揭示污染物致毒作用机理[1-2].
作为CYP1族中较重要的亚酶,CYP1A1在外源物代谢过程占主导作用,能够指示外源污染物的毒性作用[3-5],其活性一般采用7-乙氧基-3-异吩(噁)唑酮-脱乙基酶(乙氧基试卤灵脱乙基酶,EROD)活性表示.Martínez等[1]研究发现,径口暴露4~8 mg·kg-1高效氯氟氰菊酯能够诱导小鼠肝脏内EROD活性增加,并具有一定的剂量效应关系.在水生生态系统中,鱼类EROD活性能够指示周围环境污染状况,例如,当欧洲鳗鲡(Anguillaanguilla)暴露在10 mg·kg-1苯并芘(B[a]P)下,其肝脏EROD活性增加了261倍[6].
蚯蚓是土壤生态系统中重要的分解者,能够通过皮肤和肠道处理畜禽粪便和土壤污染物,已经被推荐为研究化学品对土壤生态系统无脊椎动物影响的模式生物[7-8].然而,目前仅有少量研究使用土壤无脊椎动物蚯蚓EROD活性作为生物标志物指示土壤污染物的毒理学效应,且主要使用荧光分光光度法进行测定.然而,不同研究人员使用荧光分光光度法测定蚯蚓EROD活性出现了不同的结果,例如,Brown等[9]在探索利用蚯蚓EROD活性作为土壤芘污染指示指标的可行性时没有检测到粉正蚓(Lumbricusrubellus)体内EROD活性.Achazi等[10]检测到赤子爱胜蚓(Eiseniafetida)暴露于多环芳烃(PAHs)下五氧试卤灵脱烷基酶(PentROD)和苄氧基试卤灵脱烷基酶(BenzROD)活性的变化,却没有检测到EROD活性;而Lukkari等[11]检测并发现Cu和Zn对内生正蚓(Aporrectodea tuberculata)体内的EROD活性具有显著诱导效应.这种结果差异现象可能因为蚯蚓体内的内含物及血红色素会干扰荧光分光光度法测量EROD活性的准确性,因此需要探寻更为敏感准确的测定方法.
与荧光分光光度法相比较,高效液相色谱(HPLC)法是一种高效、低成本、敏感且有选择性的方法[12-13].使用HPLC测定哺乳动物肝脏微粒体EROD活性的研究已经被多次报道,且HPLC方法比荧光分光光度法敏感[13].然而,鲜有研究使用HPLC法测定土壤无脊椎动物蚯蚓体内的EROD活性,这可能由于蚯蚓不具有明显的肝脏器官且体内CYP1A1酶含量低,检测较困难.因此在本研究中,经过一系列参数优化,建立了测定赤子爱胜蚓体内EROD活性的HPLC法,旨在提供可选择的、敏感的、准确的和易处理的蚯蚓EROD活性测定方法,为诊断土壤污染物的毒性提供一种新的生物标志物.
拟除虫菊酯类农药由于具有高效、对哺乳动物和鸟类低毒且易降解等优点,已经逐渐成为有机磷、有机氯和氨基甲酸酯类杀虫剂的替代品,被广泛应用于农业生产和公共场所防虫工作中[14].由于具有高疏水性,低水溶性及较长的水解半衰期等特点,拟除虫菊酯极易吸附在土壤颗粒及水体底泥中,通过食物链蓄积和传递,从而给土壤生物和水生生物带来风险[15-17].氰戊菊酯,一种II型拟除虫菊酯类杀虫剂,广泛应用于农业、兽医业和水产养殖业中.随着氰戊菊酯的大量使用,其毒性效应也日趋严重.研究发现,短期暴露于顺式氰戊菊酯下,澳大利亚红斑彩虹鱼(Melanotaeniafluviatilis)的繁殖力下降,蓝腮鱼(Lepomismacrochirus)的产卵和孵化能力被抑制[18-19].暴露在4 μg·L-1氰戊菊酯下,虾的肝胰腺、肌肉和腮部位的脂质过氧化和谷胱甘肽转移酶活性被显著诱导[20].Saxena等[21]发现氰戊菊酯暴露在人工土壤中,赤子爱胜蚓(Eiseniafetida)和粪粒腔环蚓(Metaphireposthuma)的14 d-LC50值分别为40.77和18.66 mg·kg-1.生物体内细胞色素P450(CYP450)参与了拟除虫菊酯类农药的氧化代谢,本课题组前期研究发现,氰戊菊酯对赤子爱胜蚓的生长繁殖具有一定影响,因此本研究在建立测定EROD活性方法的基础上,选择氰戊菊酯作为污染物,验证EROD活性对拟除虫菊酯类农药胁迫的敏感性.
1 材料与方法
1.1 材 料
1.1.1 供试化学品
葡萄糖-6-磷酸、葡萄糖-6-磷酸脱氢酶、还原型辅酶Ⅱ(NADPH)、乙氧基试卤灵(7-ethoxyresorufin)、试卤灵(resorufin)、牛血清蛋白(BSA),考马斯亮蓝G-250(CBG)、N-2-羟乙基哌嗪乙烷磺酸-N′ -2-乙烷-磺酸(HEPES)、三羟甲基氨基甲烷(Tris)、乙二胺四乙酸(EDTA)、二硫苏糖醇(DTT)、甲醇和乙腈购买于美国Sigma-Adrich公司,除甲醇和乙腈为色谱纯,其他试剂均为分析纯.氰戊菊酯(质量分数90.3%)购买于上海永远化工有限公司,蔗糖、盐酸、氢氧化钠等其他分析纯试剂购买于沈阳莱博科贸有限公司.
常用溶液配制如下:
1) Tris溶液(50 mmol·L-1): 超纯水溶解6 057 mg Tris,并使用1.0 mol·L-1HCl调整pH值至7.5,定容至1 L.
2) 匀浆液: 蔗糖(250 mmol·L-1),Tris 溶液(50 mmol·L-1),pH值7.5,DTT(1 mmol·L-1)和EDTA(1 mmol·L-1).
3) 保存液: 蔗糖(250 mmol·L-1),Tris溶液(50 mmol·L-1),pH值7.5,DTT(1 mmol·L-1),EDTA(1 mmol·L-1)和甘油(体积分数20%).
4) 试卤灵储备液(200 μmol·L-1): 甲醇溶解2.352 mg试卤灵至50 mL,并于-20 ℃下保存.
5) HEPES溶液(100 mmol·L-1): 超纯水溶解2.38 g HEPES,并使用0.5 mol·L-1NaOH调节pH值至7.8,定容至100 mL.
6) 乙氧基试卤灵(100 μmol·L-1): 用100 μL 二甲基亚砜(DMSO)溶解0.241 mg,然后用100 mmol·L-1HEPES定容至10 mL放于-20 ℃储存.
7) 还原型辅酶Ⅱ(5 mmol·L-1): 超纯水溶解28.56 mg NADPH至5 mL.
1.1.2 供试土壤
土壤取自中科院沈阳农业生态站保护行0~20 cm土层,该土壤具有以下理化性质:pH值为6.2,碱解氮(K-N)质量分数为0.091%,总磷(TP)质量分数为0.04%,总钾(TK)质量分数为0.18%,有机质(OM)质量分数为1.65%,阳离子交换量(CEC)为123 mmol·kg-1,最大持水量(WHC)为32%;土壤的粒径质量分数分布如下:砂粒(粒径>50 μm)占22%,粉粒(粒径1~50 μm)占64%,黏粒(粒径<1 μm)占14%.土壤采集后去除植物等残渣,室温条件下风干,过20目(孔径为0.9 mm)筛后备用.
1.1.3 供试蚯蚓
供试蚯蚓选择土壤模式生物赤子爱胜蚓(Eiseniafetida),购买于沈阳华清源蚯蚓养殖公司,挑选300~400 mg具有健康环带的成蚓在洁净土壤中驯化至少2周.
1.1.4 仪器设备
BS210S型电子分析天平(Sartorius公司生产,精度为万分之一),MSE6.6S型电子分析天平(Sartorius公司生产,精度为百万分之一),HPG-280BX型光照培养箱(哈东联公司生产),手动玻璃匀浆器(凯瑞实验器材生产),IKA T18破碎仪(德国IKA公司生产),CP-80MX型低温超速离心机(Hitachi公司生产),紫外双光束分光光度计UV-2550(Shimadzu公司生产),高效液相色谱仪HPLC-3000(Thermo Fisher Ultimate公司生产).
1.2 方 法
1.2.1 微粒体提取试验
取出蚯蚓放于湿润滤纸上,在20 ℃条件下清肠24 h,之后在4 ℃下放于冰冷的体积分数为20%的甘油中固定10 min,分别使用1、3 、5 条蚯蚓做探索.试验过程依次使用内脏和整体作为材料,根据前一个试验结果调整下一个条件.
以内脏为供试材料,将蚯蚓放于冰水混合物上解剖取出内脏,使用0.15 mol·L-1KCl清洗内脏至流出液无色,放于2 mL保存液中于冰水条件下进行手动匀浆,在15 000相对离心力下4 ℃离心30 min,收集上清液于-80 ℃存放.在差速离心过程中,经历一次离心的上清液再次在150 000相对离心力下离心1.5 h,沉淀部分用1 mL保存液重新溶解,并于-80 ℃保存.
以蚯蚓整体作为供试材料,将清肠24 h后的蚯蚓切成若干段,使用0.15 mol·L-1KCl 清洗至流出液无色,放于5 mL匀浆液中,在IKA T18破碎仪中以12 000 r·min-1的速度进行破碎,以上操作均在冰水混合物环境下进行.匀浆液于15 000相对离心力下离心30 min,收集上清液存放于-80 ℃.在差速离心过程中,经历一次离心的上清液再次在150 000相对离心力下离心1.5 h,得到的沉淀部分使用1 mL保存液重新溶解,并于-80 ℃保存.
蛋白含量的测定采用考马斯亮蓝法,HPLC法测定EROD活性是基于乙氧基试卤灵被CYP1A1催化生成的产物试卤灵的定量分析.
1.2.2 孵育和测定条件试验
乙氧基试卤灵在CYP1A1和NADPH存在下,反应生成具有荧光强度的试卤灵,通过测定每毫克微粒体蛋白在单位时间内生成的产物量来计算酶活性大小,根据国家法定计量单位换算为催化底物的量,表示为EROD活性,每毫克微粒体蛋白活性单位为fkat.孵育反应条件探索试验主要从反应缓冲液、微粒体加入量和底物量等方面探索,反应条件及色谱条件参考Belaz和Hanioka 的方法,并进行一定的调整[12-13].
1.2.3 稳定性验证试验
方法建立后,将300 μL失活微粒体(在55 ℃下加热20 min)代替活性微粒体进行同孵育反应相同的处理,配置成含有5、10、40 nmol·L-1产物试卤灵的标准溶液,进行方法稳定性检测.标准溶液存放于-20 ℃,以备日间日内差异分析,每个浓度处理有5个重复,分别在存放1、2、3 d后进行HPLC测定以评估日间差异,每个浓度的5个重复样品3 d所测数据用于评估组内差异.
1.2.4 EROD活性氰戊菊酯暴露试验
在建立EROD活性HPLC测定方法后,选用本课题组之前做过生殖毒性研究的氰戊菊酯为暴露污染物进行人工染毒,验证赤子爱胜蚓体内CYP1A1酶的响应.根据国际标准化组织(ISO)11268文件[22],蚯蚓放于洁净土壤中至少2周以适应土壤环境,氰戊菊酯溶于丙酮之后洒入土壤(质量分数为0.5、2.0、5.0、10.0、20.0 mg·kg-1),放于通风橱过夜,平衡48 h后,添加水分使含水量达到60% WHC.在每个质量分数处理中随机分配10条蚯蚓,放于(20±1) ℃(光照时间与黑暗时间各12 h)培养箱中培养.每个处理有3个重复,控制组只添加溶剂丙酮.培养7 d后,蚯蚓用于提取微粒体测定EROD活性.
1.3 数据统计
使用SPSS 21.0进行数据分析,数据均以平均值±标准差表示,Kolmogorov-Smirnov检验和Levene检验用于正态分布和方差齐性检验.使用Dunnett多重检验比较各暴露时间下氰戊菊酯处理组与对照组之间的显著性差异.如果数据不能满足匀质性,使用对数转换,如果转换数据后依然不满足方差齐性,则使用Kruskal-Wallis H非参数检验进行数据分析.文中色谱图为HPLC输出图形,氰戊菊酯暴露下EROD响应图则使用SigmaPlot 14.0进行制作.
2 结果与分析
2.1 微粒体提取
通过对蚯蚓内脏和整体进行一次离心和差速离心获取酶液测定EROD活性的多次探索试验,根据获取的酶液进行体外孵育反应后经HPLC测定是否出现峰型对称的产物峰,以及产物峰是否能与杂质峰实现良好分离,最终确定使用3条蚯蚓进行整体破碎和差速离心提取含有CYP1A1亚酶的微粒体酶液.取出蚯蚓放于湿润滤纸上在20 ℃条件下清肠24 h,之后在4 ℃下放于冰冷的20%甘油中固定10 min,切成若干段,使用0.15 mol·L-1KCl 清洗至流出液无色,放于5 mL匀浆液中,在破碎仪以12 000 r·min-1转速破碎.破碎后匀浆液在15 000相对离心力下离心30 min,上清液再于150 000相对离心力下离心1.5 h.得到的沉淀部分使用1 mL保存液重新溶解,并于-80 ℃保存.
CYP1A1作为CYP450家族亚酶之一,主要使用EROD活性来评估其活性,是对外源污染物高度敏感的活体生物标志物,已经被广泛用于评估水体环境中污染物的生态毒性[6,23].然而,CYP1A1活性很少被用于检测土壤生态系统污染物的生态毒性过程[11,24].在前人的研究中,测定EROD活性主要采用荧光分光光度计法,但是获得的数据不够稳定,与荧光分光光度计法相比,HPLC法因为具有敏感准确高效等特点而备受欢迎[9-12].然而,关于土壤蚯蚓EROD活性的报告相对较少,且大部分未能成功测得蚯蚓体内EROD活性[9-10].蚯蚓EROD活性测定失败的原因可能有以下几点:首先,蚯蚓体内的内含物及血红色素会干扰EROD活性的测定;其次,蚯蚓体内EROD活性较低,反应时没有充分发挥活性;再次,蚯蚓内脏含量较少,且内脏提取过程容易造成损失,因而导致酶含量极低,不易检测其活性.因此,本试验通过破碎蚯蚓整体和差速离心以去除杂质,并使用HPLC分离反应液中产物与杂质,来最大限度地降低蚯蚓血红蛋白等杂质对产物的干扰.采用差速离心法获取蚯蚓微粒体,能够较好地减少蚯蚓体内血色素、血铁素和其他物质的干扰.采用整体蚯蚓能够测得CYP1A1活性来说明蚯蚓体壁可能含有大量的CYP1A1亚酶.保存液中加入20%甘油是为了防止细胞色素P450酶系在储存时失活.
2.2 孵育和测定条件
通过对反应体系中各成分的使用量及反应程序的多次探索试验,最终确定以下的反应过程:在离心管中依次加入800 μL孵育缓冲液(包含pH值为7.8的100 mmol·L-1的HEPES,5 mmol·L-1的葡萄糖-6-磷酸,1 mg·mL-1的BSA,5 mmol·L-1的MgCl2,16.67 nkat·mL-1的葡糖糖-6-磷酸脱氢酶),50 μL乙氧基试卤灵溶液(100 μmol·L-1)和300 μL蚯蚓微粒体溶液,混合均匀,于37 ℃水浴中预热5 min,之后加入50 μL的NADPH(5 mmol·L-1)溶液启动反应,放于37 ℃水浴中反应20 min,加入800 μL冰冷甲醇终止反应.将反应后的混合物放于冰上静置30 min后于4 ℃在10 000相对离心力下离心15 min,上清液过0.45 mm膜转移至进样瓶中测定产物含量.采用C18反相柱(thermo hypersil gold,150 mm×4.6 mm,5 μm)分离,柱温设置在35 ℃,按照V(磷酸缓冲液)∶V(甲醇)∶V(乙腈)=52∶45∶3的比例使用磷酸缓冲液(浓度为20 mmol·L-1)、甲醇和乙腈作为流动相,流速为0.8 mL·min-1,激发波长为530 nm,发射波长为582 nm.
乙氧基试卤灵和试卤灵标准品色谱图如图1所示,标准物质试卤灵出峰时间在3.5 min左右,峰型对称,底物乙氧基试卤灵出峰时间在6 min左右,两峰之间可以实现良好分离.蚯蚓微粒体孵育反应HPLC检测色谱图如图2所示,在最终确定微粒体提取和孵育测定条件后检测的蚯蚓EROD活性样品色谱图可以实现杂质峰、底物峰和产物峰的完全分离,峰型较好.配置含有0、0.5、1.0、2.5、5.0、10.0、20.0、40.0 nmol·L-1产物试卤灵的标准溶液,HPLC测定峰面积强度,制作试卤灵的标准曲线(见图3),数据为平均值,n=3,拟合标准曲线方程为y=668.08x-46.96,线性范围为0~40 nmol·L-1,相关系数R2=0.999 8.

图1 乙氧基试卤灵和试卤灵标准品色谱Fig.1 Chromatogram of 7-ethoxyresorufin and resorufin standards

图2 蚯蚓微粒体孵育反应HPLC检测色谱Fig.2 Chromatogram of earthworm microsomes incubation sample

图3 试卤灵的标准曲线Fig.3 The standard curve of resorufin
在反应体系中加入BSA以稳定或提高蚯蚓EROD活性.孵育反应过程中,BSA是作为一种稳定剂加入反应液中,加入BSA后可能起到“保护”或“载体”作用,不少酶类添加BSA后能使其活性大幅度提高,对于不需要加BSA的酶,加入BSA之后也不会受到影响.自然条件下NADPH极易降解,因此在孵育反应体系中加入葡萄糖-6-磷酸和葡萄糖-6-磷酸脱氢酶是构成NADPH的再生系统,从而达到NADPH充足的环境.为了使反应终止迅速,用于终止反应的甲醇必须提前置于冰箱-20 ℃冷冻30 min以上.乙氧基试卤灵不溶于水和盐溶液,因此底物100 μmol·L-1乙氧基试卤灵的配制首先使用DMSO溶解,然后用HEPES溶液稀释,使用不高于0.1%(体积分数)的DMSO,使其不影响CYP1A1酶活性.本研究通过对提取方法、孵育反应和HPLC分离等过程进行一定的改良,成功采用HPLC测得蚯蚓微粒体内EROD活性,为土壤污染的生态毒理诊断提供了新的生物标志物的测定方法.
2.3 方法稳定性
表1为蚯蚓微粒体EROD活性HPLC法的稳定性测定,表示在不同时间下测定的孵育后样品中产物试卤灵浓度具有可接受的变化.当浓度较低,为5、10 nmol·L-1时,变异系数(CV)较小,第1 d CV范围在4.06%~4.55%之间,第2 d和第3 d的CV范围分别在0.80%~3.40%和1.43%~4.04%,标准差(SD)分别为0.22~0.41,0.09~0.18和0.08~0.42.当浓度较高,为40 nmol·L-1时,CV相对较高,在4.58%~9.53%之间.所有样品的日间CV在6.05%~11.10%之间,SD在0.48~4.15之间.对于3组标准品,组间和组内回收率在93%~118%之间,变异系数均小于15%,即孵育后样品保存3 d内进行检测,产物稳定,方法可行.
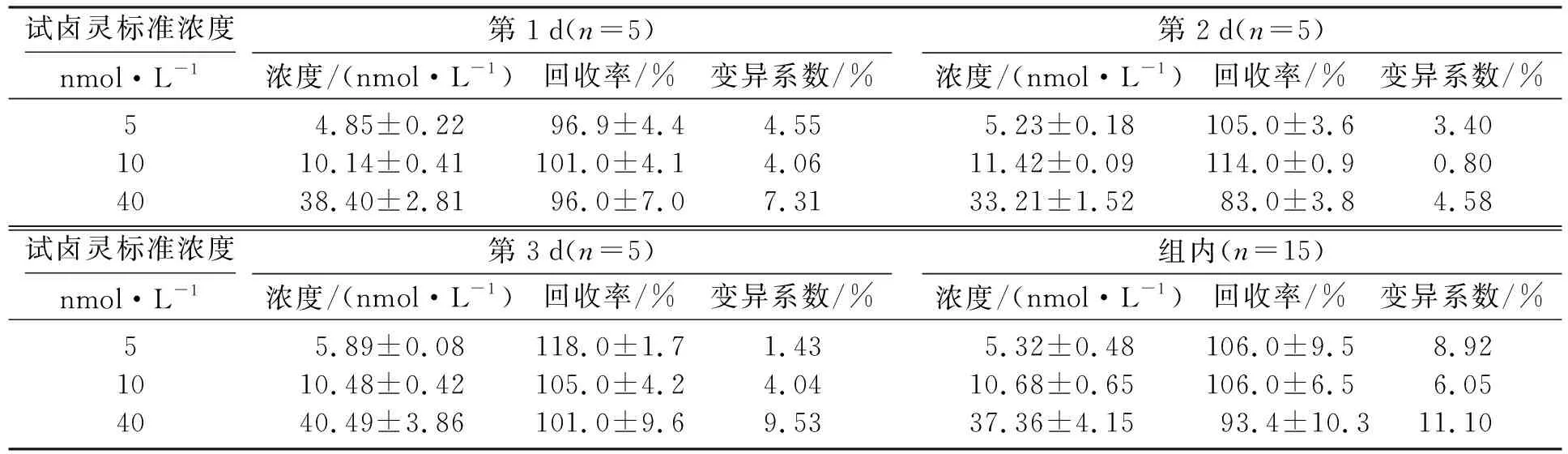
表1 蚯蚓微粒体EROD活性HPLC法的稳定性Table 1 The stability of EROD activity measured by HPLC in earthworm microsomes

图4 氰戊菊酯暴露7 d后赤子爱胜蚓EROD活性的变化Fig.4 Changes of EROD activity in earthworm Eisenia fetidaafter exposure tofenvalerate in soil for 7 days注: **表示P<0.01,***表示P<0.001.
2.4 EROD活性对氰戊菊酯暴露的响应
氰戊菊酯暴露7 d后赤子爱胜蚓EROD活性的变化如图4所示,当赤子爱胜蚓暴露于氰戊菊酯污染的土壤中7 d后,氰戊菊酯诱导了蚯蚓EROD活性的增加.在0~5 mg·kg-1氰戊菊酯处理组,蚯蚓EROD活性随着氰戊菊酯质量分数增加而增加,随后随着氰戊菊酯质量分数的增加,蚯蚓EROD活性有所减小.从图中可以发现,2~20 mg·kg-1氰戊菊酯显著(P<0.05)增加了蚯蚓EROD活性,其处理下蚯蚓体内EROD活性分别是对照组的2.74、3.23、2.38和2.89倍.
CYP1A1作为CYP450家族的主要成员之一,能够催化多种有机污染物的氧化反应,如多环芳烃(PAHs)、多氯联苯(PCBs)及硝基芳香族化合物等,反之,污染物又可以诱导有机体内CYP1A1的浓度和活性,进而改变化学品的转化率,因此,可以通过测定CYP1A1的浓度或活性被诱导的情况来检测环境污染物暴露剂量与有机体受伤害的程度[25-26].而关于蚯蚓CYP1A1(EROD)活性对污染物响应的报道较少,在本研究中,使用HPLC法测定暴露在氰戊菊酯污染土壤中的赤子爱胜蚓体内EROD活性,结果表明,在亚致死剂量氰戊菊酯暴露诱导下,与对照组比较,氰戊菊酯显著诱导了赤子爱胜蚓EROD活性的增加.HPLC方法建立后,同时发现联苯菊酯和氟氯氰菊酯暴露下赤子爱胜蚓EROD活性被显著诱导[27-28],说明HPLC测定的蚯蚓CYP1A1活性可以作为敏感的生物标志物指示土壤拟除虫菊酯暴露的风险状况,为土壤拟除虫菊酯生态风险评估提供新的试验终点.
3 结 论
以蚯蚓整体作为提取材料,采用差速离心法获取微粒体,采用C18反相柱分离,在激发波长530 nm,发射波长582 nm条件下能够检测蚯蚓微粒体EROD活性,为蚯蚓CYP1A1生物标志物的检测提供了更为精确和稳定的HPLC方法.
土壤氰戊菊酯暴露能够诱导蚯蚓体内EROD活性的增加,且具有明显的剂量效应关系,表明赤子爱胜蚓CYP1A1活性具有指示氰戊菊酯生态毒性效应的潜力,为土壤生态毒理学提供了潜在的生物标志物.
