胸腔镜下肺叶切除术对非小细胞肺癌血清肿瘤标志物及免疫应激指标的影响
2021-03-10乐薇
乐薇
(九江市第三人民医院肿瘤科,江西 九江 332000)
非小细胞肺癌(non-small cell lung cancer,NSCLC)是严重危害人类生命安全的恶性肿瘤,病理类型包括腺鳞癌、鳞状细胞癌、腺癌等,具有较高的发病率及死亡率[1]。目前,临床治疗NSCLC 主要采用手术方式,可有效切除肺癌原发病灶及转移淋巴结,改善患者病痛,但传统开胸手术创伤性大,术后患者常伴有强烈的应激反应,进而降低免疫功能,影响术后康复效果[2]。随着微创技术的发展,胸腔镜逐渐在外科手术领域应用,其中胸腔镜下肺叶切除术在肺癌手术中具有较好的治疗效果,但目前血清肿瘤标志物及免疫应激的影响相关报道较少。鉴于此,本研究探讨在NSCLC患者中应用胸腔镜下肺叶切除术对血清肿瘤标志物及免疫应激指标的影响,现报道如下。
1 资料与方法
1.1 临床资料 回顾性分析本院2018年6月至2019年6月接收的60例NSCLC患者的临床资料,依据不同手术方法分为腔镜组(n=32)与开胸组(n=28)。腔镜组男18例,女14例;年龄40~74 岁,平均年龄(56.84±9.45)岁;其中腺鳞癌2 例,鳞状细胞癌13例,腺癌17例。开胸组男16例,女12例;年龄41~75 岁,平均年龄(57.12±9.63)岁;其中腺鳞癌1 例,鳞状细胞癌11 例,腺癌16 例。两组临床资料比较差异无统计学意义,具有可比性。
1.2 纳入及排除标准 纳入标准:①符合NSCLC诊断标准[3];②经组织病理学、免疫学、细胞学、影像学检查确诊;③临床分期Ⅰ~Ⅱ期;④临床资料完整;⑤术前未进行放化疗。排除标准:①存在其他恶性肿瘤者;②肝、肾功能不全者;③胸腹部手术史者;④免疫系统疾病者。
1.3 方法 开胸组实施传统开胸手术,确定病灶位置,于患侧第5、第6肋间做约18~20 cm的切口,分离周围组织,结扎血管,切除患侧病灶肺叶,依次清扫支气管旁、隆突下、下肺韧带、食管旁的淋巴结,术后引流管留置,抗炎治疗。腔镜组实施胸腔镜下肺叶切除术,主操作孔选择腋前线第4 或第5肋间,辅助操作孔选择腋后线第7、第8 肋间,腔镜孔选择腋前线和腋中线之间第7 或第8 肋间;将海绵钳、胸腔镜等置入,辅助胸腔镜监视器,游离组织,病变组织的切除选择直线切割器,并清扫肺门及纵隔淋巴结,术后胸腔闭式引流管留置,抗炎治疗。
1.4 观察指标 分别于术前1 d 及术后1 d,采集患者空腹静脉血5 mL,3 500 r/min离心10 min,取血清,采用电化学发光免疫分析法测细胞角质蛋白19片段抗原21-1(cyto-keratin 19 fragment antigen 21-1,CYFRA21-1)水平,采用放射免疫法测癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原50(carbohydrate antigen 50,CA50)水平;采用放射免疫法测前列腺素E2(prostaglandin E2,PGE2)水平,采用电化学发光免疫分析法测皮质醇(cortisol,Cor)水平。
1.5 统计学方法 采用SPSS 23.0统计软件进行数据分析,计量资料以“±s”表示,比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组血清肿瘤标志物水平比较 术前及术后,两组血清肿瘤标志物水平比较差异无统计学意义;术后,两组CYFRA21-1、CEA、CA50 水平均较术前降低,差异有统计学意义(P<0.05),见表1。
2.2 两组免疫应激指标比较 术前,两组免疫应激指标比较差异无统计学意义;术后,两组PGE2、Cor 水平均较术前升高,但腔镜组低于开胸组,差异有统计学意义(P<0.05),见表2。
表1 两组血清肿瘤标志物水平比较(±s)
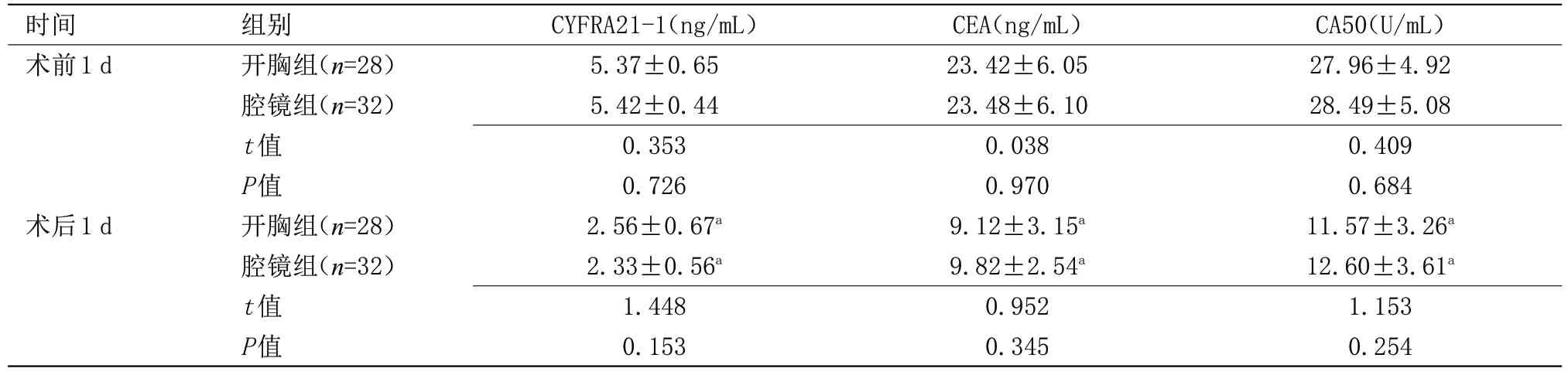
表1 两组血清肿瘤标志物水平比较(±s)
注:与同组术前比较,aP<0.05
时间术前1 d术后1 d组别开胸组(n=28)腔镜组(n=32)t值P值开胸组(n=28)腔镜组(n=32)t值P值CYFRA21-1(ng/mL)5.37±0.65 5.42±0.44 0.353 0.726 2.56±0.67a 2.33±0.56a 1.448 0.153 CEA(ng/mL)23.42±6.05 23.48±6.10 0.038 0.970 9.12±3.15a 9.82±2.54a 0.952 0.345 CA50(U/mL)27.96±4.92 28.49±5.08 0.409 0.684 11.57±3.26a 12.60±3.61a 1.153 0.254
表2 两组免疫应激指标比较(±s)
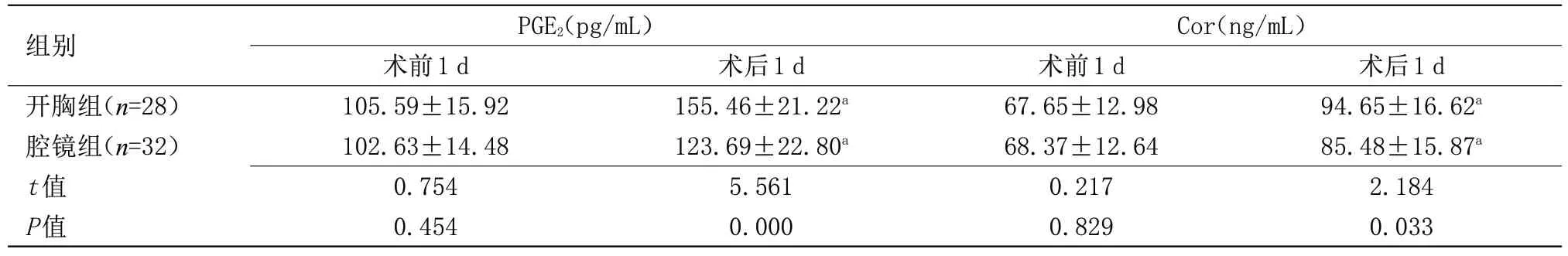
表2 两组免疫应激指标比较(±s)
注:与同组术前比较,aP<0.05
组别开胸组(n=28)腔镜组(n=32)t值P值PGE2(pg/mL)术前1 d 105.59±15.92 102.63±14.48 0.754 0.454术后1 d 155.46±21.22a 123.69±22.80a 5.561 0.000 Cor(ng/mL)术前1 d 67.65±12.98 68.37±12.64 0.217 0.829术后1 d 94.65±16.62a 85.48±15.87a 2.184 0.033
3 讨论
近年来,NSCLC 发病率不断增长,其病因与吸烟、环境、电离辐射、既往肺部慢性感染等因素有关,患者早期伴有胸部肿痛、低热、咳嗽等症状,晚期出现食欲不振、疲乏、咳血,影响患者生活质量[4]。临床研究发现,肺癌具有侵袭性、转移性、隐匿性等特点,易侵犯胸膜而出现种植转移;同时在静脉回流过程中,肿瘤细胞会扩散至全身,播散、转移速度较快,严重危害生命安全[5]。
目前,临床可采用化疗、放疗、手术等方式治疗肺癌,其中手术治疗是首选和最主要的方法,可根治肺癌。传统采用开胸手术治疗,可较好地切除肺叶,清除纵隔淋巴结,近期疗效较好,但该术式创伤性大,患者应激反应较为明显,且术后伴有严重肋间神经与切口疼痛,不利于术后康复,进而影响整体治疗效果[6]。随着医疗技术与医疗器械研究的深入,临床肺癌治疗中胸腔镜手术逐渐应用,其创伤性小,疼痛低,应激反应程度轻,利于肺癌患者术后康复。本研究结果显示,术后,两组CYFRA21-1、CEA、CA50 水平变化比较差异无统计学意义,腔镜组PGE2、Cor水平低于开胸组(P<0.05),表明在NSCLC患者中应用胸腔镜下肺叶切除术,可改善血清肿瘤标志物,减轻机体免疫应激反应。分析原因在于,胸腔镜下肺叶切除术是基于电视显像,利于医师清晰、直观的探查胸腔内部情况,进而减少手术创伤性;同时,该手术应用胸腔镜,可全方位旋转镜头,并放大视野,具有清晰的手术视野,减少视野盲区,以充分显露手术外侧切口,有助于系统、完整的清扫淋巴结,在维持较高肺组织完整性的基础上,达到良好的根治效果[7-8]。但该术式也存在一定局限性,对手术技术要求高,术中操作空间受限,若肿瘤较大或侵犯周围器官等,易导致中转开腹,因此,临床应用需严格筛选病例。胸腔镜下肺叶切除术与传统开胸手术比较,均具有较好的清扫效果,可有效降低肿瘤标志物水平,但前者对患者的应激反应影响较轻微,利于患者术后快速康复,整体治疗效果较佳,为临床治疗NSCLC提供新的思路。
综上所述,在NSCLC 患者中应用胸腔镜下肺叶切除术,可改善血清肿瘤标志物,有效调节免疫应激。
