水飞蓟胶囊联合甘草酸二铵肠溶胶囊及恩替卡韦对代偿期乙肝肝硬化患者肝功能及血清T细胞亚群水平的影响
2021-03-10徐鹏张丽航王一飞王善娟
徐鹏,张丽航,王一飞,王善娟
(嘉定区中心医院消化内科,上海 201800)
肝硬化主要由乙型肝炎病毒(hepatitis B virus,HBV)感染引起,我国70%左右肝硬化患者乙肝表面抗原呈阳性,临床主要给予抗病毒、抗纤维化、改善肝功能治疗[1-2]。抗病毒治疗在降低乙肝肝硬化患者HBV载量方面具有重要作用,可有效抑制肝硬化进展,恩替卡韦为临床抗乙肝病毒的一线药物,具有良好抗病毒作用[3]。代偿期乙肝肝硬化患者症状较轻,但肝纤维化却呈进行性进展,加重肝硬化病情,因此,抗病毒治疗同时给予抗纤维化治疗具有重要意义。甘草酸二铵肠溶胶囊具有强效抗炎、抑制肝纤维化作用,可在一定程度上改善患者肝功能、抑制肝硬化进展[4]。近年来,中西医结合疗法在代偿期乙肝肝硬化治疗中得到广泛应用,中药制剂水飞蓟胶囊具有活血祛瘀、益精养肝之功效,在抑制肝纤维化、改善患者肝功能方面均具有一定作用[5]。基于此,本研究选取本院收治的代偿期乙肝肝硬化患者90 例,分组研究水飞蓟胶囊联合甘草酸二铵肠溶胶囊及恩替卡韦的应用效果,现报道如下。
1 资料与方法
1.1 临床资料 选取2016年1月至2018年1月本院收治的代偿期乙肝肝硬化患者90 例,按照随机数字表法分为研究组和对照组,各45例。
1.2 纳入及排除标准
1.2.1 纳入标准 ①符合《慢性乙型肝炎防治指南(2015年更新版)》[6]中代偿期乙肝肝硬化相关诊断标准;②Child分级A~B 级;③治疗前未接受过抗病毒或免疫调节治疗;④对本研究药物无禁忌;⑤认知功能良好,无沟通障碍;⑥知晓本研究并签署知情同意书。
1.2.1 排除标准 ①其他疾病引起的肝硬化;②失代偿期者;③血液系统疾病者;④合并其他感染性疾病者;⑤消化功能障碍者;⑥免疫性疾病者;⑦治疗依从性差者;⑧中途退出,不能配合完成研究者。
1.3 方法
1.3.1 对照组 采用甘草酸二铵肠溶胶囊(正大天晴药业集团股份有限公司,国药准字H20040628)及恩替卡韦(北京协和药厂,国药准字H20153254)治疗,甘草酸二铵肠溶胶囊,每次150 mg,每天3次;恩替卡韦,每次0.5 mg,每天1次。
1.3.2 研究组 在对照组基础上加用水飞蓟胶囊(德国马博士大药厂,批准文号H20060041)治疗,每次1.5 mg,每天2次。两组均持续治疗6 个月,治疗期间不使用其他抗纤维化药物及免疫调节剂,且两组保肝、降酶治疗方面无差异。
1.3.3 血清指标检测 采集患者晨起空腹静脉血,3 000 r/min转速离心(离心半径8 cm)处理10 min,留取血清,置于-80 ℃冷藏室待检。①采用MAGLUMI 1000化学发光仪(深圳市新产业生物医学工程有限公司),以化学发光法测定血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBIL)水平;②采用放射免疫法检测血清透明质酸(hyaluronic acid,HA)、层粘连蛋白(laminin,LN)、Ⅲ型前胶原(precollagen,PCⅢ)、Ⅳ型胶原(collagen,C-Ⅳ)水平;③采用双抗夹心酶联免疫吸附试验检测血清肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白细胞介素-6(interleukin 6,IL-6)、IL-8 水平;④采用 Flow-Sight 型流式细胞仪(广州云星科学仪器有限公司)检测血清T细胞亚群(CD3+、CD4+、CD4+/CD8+)水平。
1.4 观察指标 ①比较两组临床资料,包括肝硬化Child分级、乙肝病程、肝硬化病程、年龄、性别。②比较两组治疗后乙肝病毒基因(HBV-DNA)转阴率,采用聚合酶链式反应(PCR)法联合荧光探针体外扩增技术检测HBV-DNA 载量,HBV-DNA最低检测值为103copies/mL,相关试剂盒购自深圳凯杰公司。③比较两组治疗前后中医证候积分,包括倦怠乏力、纳差、腹胀、肝区不适、口干苦等,采用4级评分法,分值0~3分,得分越高,各项症状越严重。④比较两组治疗前后肝功能指标,包括血清ALT、AST、TBIL。⑤比较两组治疗前后肝纤维化指标,包括血清HA、LN、PCⅢ、C-Ⅳ。⑥比较两组治疗前后血清炎性因子,包括血清TNF-α、IL-6、IL-8。⑦比较两组治疗前后血清T细胞亚群,包括血清CD3+、CD4+、CD4+/CD8+。
1.5 统计学方法 采用SPSS 22.0统计软件进行数据分析,计量资料以“±s”表示,比较采用t检验,计数资料用[n(%)]表示,比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组临床资料比较 两组肝硬化Child分级、病程、年龄、性别等临床资料比较差异无统计学意义,见表1。

表1 两组临床资料比较Table 1 Comparison of clinical data between two groups
2.2 两组HBV-DNA 转阴率比较 治疗结束后,研究组HBVDNA转阴41例,转阴率为91.11%(41/45);对照组HBV-DNA转阴 34 例,转阴率为 75.56%(34/45);研究组HBV-DNA 转阴率高于对照组(χ2=3.920,P=0.048)。
2.3 两组中医证候积分比较 治疗前,两组倦怠乏力、纳差、腹胀、肝区不适、口干苦等各项积分比较差异无统计学意义;治疗后,两组各项积分均较治疗前降低,且研究组低于对照组(P<0.05),见表2。
2.4 两组肝功能指标比较 治疗前,两组血清ALT、AST、TBIL 水平比较差异无统计学意义;治疗后,两组血清ALT、AST、TBIL 水平均较治疗前降低,且研究组低于对照组(P<0.05),见表3。
2.5 两组肝纤维化指标比较 治疗前,两组血清HA、LN、PCⅢ、C-Ⅳ水平比较差异无统计学意义;治疗后,两组血清HA、LN、PCⅢ、C-Ⅳ水平均较治疗前降低,且研究组低于对照组(P<0.05),见表4。
2.6 两组血清炎性因子比较 治疗前,两组血清TNF-α、IL-6、IL-8 水平比较差异无统计学意义;治疗后,两组血清TNF-α、IL-6、IL-8 水平均较治疗前降低,且研究组低于对照组(P<0.05),见表5。
表2 两组中医证候积分比较(±s,分)Table 2 Comparison of TCM Syndrome score between the two groups(x±s,scores)

表2 两组中医证候积分比较(±s,分)Table 2 Comparison of TCM Syndrome score between the two groups(x±s,scores)
注:与同组治疗前比较,aP<0.05
时间治疗前治疗后组别研究组对照组t值P值研究组对照组t值P值例数45 45 45 45倦怠乏力1.76±0.54 1.73±0.50 0.274 0.785 0.64±0.26a 0.98±0.37a 5.044 0.000纳差1.83±0.67 1.79±0.64 0.290 0.773 0.72±0.31a 1.05±0.36a 4.660 0.000腹胀1.61±0.58 1.58±0.55 0.252 0.802 0.56±0.21a 0.83±0.27a 5.295 0.000肝区不适1.86±0.52 1.84±0.49 0.188 0.852 0.80±0.35a 1.08±0.33a 3.905 0.000口干苦1.59±0.43 1.55±0.46 0.426 0.671 0.53±0.24a 0.79±0.30a 4.540 0.000
表3 两组肝功能指标比较(±s)Table 3 Comparison of liver function indexes between two groups(±s)

表3 两组肝功能指标比较(±s)Table 3 Comparison of liver function indexes between two groups(±s)
注:与同组治疗前比较,aP<0.05
时间治疗前例数45 45治疗后组别研究组对照组t值P值研究组对照组t值P值45 45 ALT(U/L)92.56±30.85 91.49±30.54 0.165 0.869 28.08±14.06a 39.67±15.65a 3.696 0.000 AST(U/L)103.67±27.85 101.52±26.69 0.374 0.709 31.40±15.68a 42.09±16.21a 3.180 0.002 TBIL(μmol/L)65.42±15.19 64.03±14.67 0.442 0.660 35.20±12.35a 43.08±13.26a 2.917 0.005
表4 两组肝纤维化指标比较(±s,ng/mL)Table 4 Comparison of liver fibrosis indexes between two groups(±s,ng/mL)

表4 两组肝纤维化指标比较(±s,ng/mL)Table 4 Comparison of liver fibrosis indexes between two groups(±s,ng/mL)
注:与同组治疗前比较,aP<0.05
时间治疗前治疗后组别研究组对照组t值P值研究组对照组t值P值例数45 45 45 45 HA 210.36±62.81 207.41±60.57 0.227 0.821 103.26±32.75a 145.37±41.63a 5.333 0.000 LN 249.62±78.65 245.39±75.29 0.261 0.795 122.63±45.86a 176.49±50.37a 5.304 0.000 PCⅢ197.65±59.82 193.67±57.96 0.321 0.749 85.13±32.34a 129.42±43.71a 5.464 0.000 C-Ⅳ154.39±57.38 150.43±56.10 0.331 0.714 81.65±29.78a 119.52±35.40a 5.492 0.000
表5 两组血清炎性因子比较(±s,pg/mL)Table 5 Comparison of serum inflammatory factors in the two groups(±s,pg/mL)
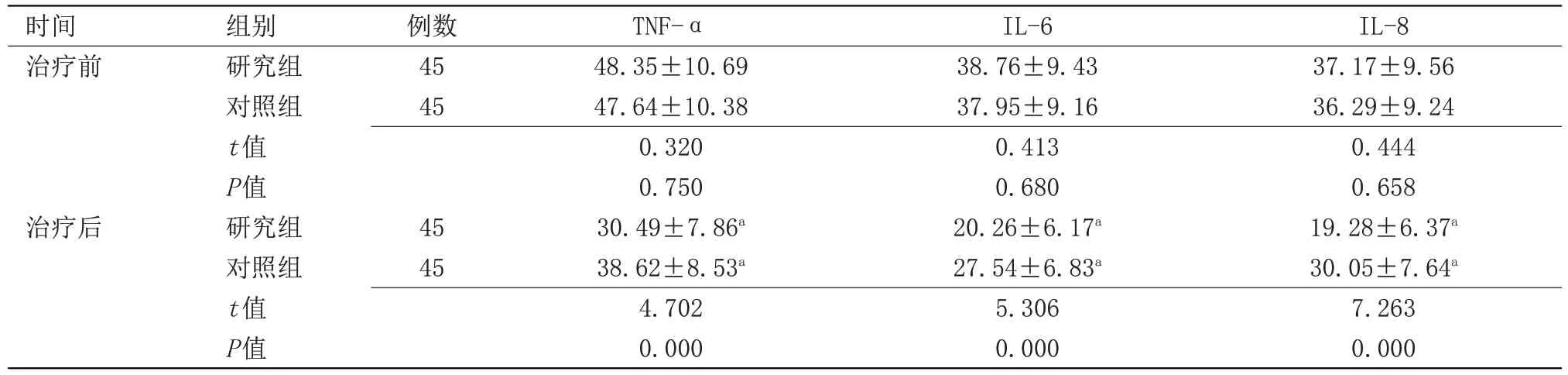
表5 两组血清炎性因子比较(±s,pg/mL)Table 5 Comparison of serum inflammatory factors in the two groups(±s,pg/mL)
注:与同组治疗前比较,aP<0.05
时间治疗前治疗后组别研究组对照组t值P值研究组对照组t值P值例数45 45 45 45 TNF-α 48.35±10.69 47.64±10.38 0.320 0.750 30.49±7.86a 38.62±8.53a 4.702 0.000 IL-6 38.76±9.43 37.95±9.16 0.413 0.680 20.26±6.17a 27.54±6.83a 5.306 0.000 IL-8 37.17±9.56 36.29±9.24 0.444 0.658 19.28±6.37a 30.05±7.64a 7.263 0.000
2.7 两组血清T 细胞亚群比较 治疗前,两组血清CD3+、CD4+、CD4+/CD8+水平比较差异无统计学意义;治疗后,两组血清CD3+、CD4+、CD4+/CD8+水平均较治疗前提高,且研究组高于对照组(P<0.05),见表6。
3 讨论
乙肝肝硬化患者均存在不同程度HBV 复制,HBV 复制介导的炎症反应是肝纤维化进展的关键因素,因此,抑制病毒复制为治疗本病关键[7]。目前,临床在乙肝肝硬化抗病毒治疗方面已达成共识,国内外最新乙肝肝硬化防治指南均推荐恩替卡韦作为代偿期乙肝肝硬化治疗的首选药物[8]。众所周知,肝硬化实质为肝纤维化,肝纤维化的中心环节为肝星状细胞的激活,肝星状细胞被激活后促进细胞外基质合成,最终导致肝纤维化[9-10]。此外,乙肝病毒与抗病毒抗体结合形成免疫复合物,引起肝脏组织内炎症反应及纤维化持续性进展,促进肝硬化病情发展,因此,抗炎、抗纤维化治疗一直是临床抑制肝硬化进展的重点[11]。甘草酸二铵肠溶胶囊主要成份为甘草酸二铵及卵磷脂,具有良好肝靶向性,可有效提高肝脏内药物的浓度,充分发挥抗炎、抗纤维化、保护肝细胞、抑制肝细胞凋亡等作用,在早期抗病毒治疗中具有良好作用,且无皮质激素的不良反应,安全性较高[12-13]。临床已有研究证实,甘草酸二铵肠溶胶囊及恩替卡韦联合应用在改善代偿期乙肝肝硬化患者肝功能方面具有良好效果[14-15]。
表6 两组血清T细胞亚群比较(±s)Table 6 Comparison of serum T cell subsets between the two groups(±s)

表6 两组血清T细胞亚群比较(±s)Table 6 Comparison of serum T cell subsets between the two groups(±s)
注:与同组治疗前比较,aP<0.05
时间治疗前治疗后组别研究组对照组t值P值研究组对照组t值P值例数45 45 45 45 CD3+(%)49.86±5.31 50.43±5.46 0.502 0.617 59.82±5.24a 53.71±4.93a 5.697 0.000 CD4+(%)29.17±3.62 29.73±3.85 0.711 0.479 39.75±4.18a 32.82±4.06a 7.978 0.000 CD4+/CD8+1.09±0.15 1.13±0.17 1.184 0.240 1.72±0.24a 1.31±0.19a 8.985 0.000
近年来,中医药在抗病毒、抗纤维化治疗方面显示良好前景。从中医学角度分析,乙肝肝硬化属于“肋痛”“积聚”“黄疸”等范畴,正气亏虚、毒邪入侵为其主要病因,表现为肝气郁结、气血亏虚,需以益气舒肝、活血通络之法治之[16-17]。此外,随着中医学对乙肝肝硬化研究的深入发现,血瘀与肝微循环障碍、纤维组织形成及增生有关,故中医活血化瘀之法在改善肝功能、抑制肝纤维化方面具有一定作用[18-19]。中药制剂水飞蓟胶囊提取自中药水飞蓟,具有清热解毒,保肝利胆、保脑之功效。临床已有多项研究证实加用水飞蓟胶囊可有效提高乙肝肝硬化患者临床治疗效果[20-21]。本研究结果显示,治疗后研究组HBV-DNA 转阴率高于对照组,中医证候各项积分均低于对照组,且研究组血清ALT、AST、TBIL 水平等肝功能及HA、LN、PCⅢ、C-Ⅳ水平等肝纤维化指标均优于对照组(P<0.05)。可见,联合用药能进一步提高HBVDNA 转阴率,改善患者临床症状,抑制肝纤维化,提高肝功能。现代药理学研究发现,水飞蓟胶囊可改善组织胶原酶活性,促进胶原在肝脏内的重吸收,纠正白、球蛋白比值倒置,降低血清肝纤维化指标,逆转肝纤维化,促进肝功能改善,且能有效抑制炎症反应,有助于改善患者临床症状,能从多靶点、多环节抑制肝硬化进展[22-23]。
肝硬化是机体炎症/抗炎效应失衡的表现,相关研究表明,乙肝肝硬化与血清TNF-α、IL-6、IL-8 等炎性因子释放具有密切关系[24]。此外,徐峰等[25]研究显示,乙肝肝硬化患者中医辨证分型与血清TNF-α、IL-6 等炎性因子水平具有一定关系,中医症状越严重其炎性因子水平越高。本研究结果显示,研究组治疗后血清TNF-α、IL-6、IL-8 水平均低于对照组(P<0.05)。进一步证实加用水飞蓟胶囊能有效抑制代偿期乙肝肝硬化患者炎症反应,促进患者症状改善。近年来,临床关于代偿期乙肝肝硬化的研究主要倾向于肝功能、炎性因子及肝纤维化等方面,相关研究指出,乙肝肝硬化患者肝功能受损,加之病毒长期慢性感染及门脉高压症,可直接影响机体内环境,最终导致机体体液及细胞免疫失衡,机体免疫功能降低可促进HBV病毒复制及肝纤维化进展[26]。T细胞亚群为机体细胞免疫主要效应细胞,主要包括CD3+、CD4+、CD4+及CD8+,其中CD3+水平可反映细胞免疫的整体功能状态,CD4+对细胞免疫应答具有促进作用,CD8+则对其具有抑制作用,CD4+/CD8+比值可直接反映机体免疫状态[27]。本研究结果显示,治疗后,研究组CD3+、CD4+、CD4+/CD8+水平均高于对照组(P<0.05)。表明加用水飞蓟胶囊可进一步增强代偿期乙肝肝硬化患者机体免疫功能,这也是本研究中研究组肝纤维化得到进一步抑制的重要机制之一。
综上所述,水飞蓟胶囊可通过多机制抑制肝纤维化、改善肝功能、调节机体免疫功能,且能协同抗病毒作用,联合甘草酸二铵肠溶胶囊及恩替卡韦治疗代偿期乙肝肝硬化,能显著提高患者免疫功能,进一步抑制肝纤维化进程,缓解炎症反应,从而改善肝功能,提高HBV-DNA转阴率,减轻患者临床症状,值得临床推广。但本研究仍存在一定不足,如样本量较少、未进行长期随访,仍需临床进一步研究探讨。
