小鼠肝再生时线粒体蛋白Mic60/OPA1与能量供应的关系
2021-03-10石永泉刘炜王柯
石永泉,刘炜,王柯
(1.大连医科大学基础医学院,辽宁 大连 116044;2.大连医科大学附属第一医院中医科,辽宁 大连 116011;3.大连医科大学附属第二医院临床营养科,辽宁 大连 116023)
肝切除术术后肝衰(post hepatectomy liver failure,PHLF)发生率约为28%,死亡率约为27%,远高于非PHLF患者的死亡率[1]。良好的肝再生是PHLF恢复的重要因素,稳定的能量供应对肝再生至关重要,线粒体嵴膜(cristae membrane,CM)锚定的呼吸链复合体是能量(ATP)生成的主要装置。CM形态可决定ATP合成效率[2]。Mic60和OPA1是主要的CM形态调控蛋白[3],其表达水平的变化与多种病理生理状态相关[4-6]。目前,关于肝再生中Mic60和OPA1与ATP供应的关系的研究较少。本研究旨在观察残余肝组织Mic60 和OPA1水平与ATP含量的关系,为改善PHLF预后提供新思路,现报道如下。
1 材料与方法
1.1 材料 C57/6J SPF雄性10周龄WT小鼠购自大连医科大学SPF中心。体视显微镜(wf10/20,宁波永新);七氟烷(上海恒瑞);Mic60(ab110329,Abcam);OPA1(ab157457,Abcam);HRP 标记山羊抗兔 IgG(#31460,thermoFisher);COX IV(WL01794)、PCNA(WL02208)、兔抗小鼠IgG-HRP(WLA024)、羊抗兔IgG-HRP(WLA023)、线粒体蛋白提取试剂盒(WLA034a)、BCA 试剂盒(WLA004)购自万类生物;DAB 显色液(DA1010,Solarbio);增强型ATP检测试剂盒(S0027,碧云天)。
1.2 方法
1.2.1 PH模型 PH模型制作在体视显微镜下完成。课题组前期发现70%PH小鼠7 d生存率可达100%,85%PH组的生存率也很高,因此,本实验选择85%PH作为起始切除比例。将小鼠随机分为对照组(Sham)、85%PH 和 90%PH 组,每组 18 只,每组10只用于生存分析。术前过夜不禁食水。七氟烷持续性吸入式麻醉。手术方法:腹部正中纵行切口,长约2~2.5 cm,暴露整个上腹部。显微剪离断镰状韧带、肝胃韧带、左外叶与右侧膈肌韧带,游离肝左外叶和肝中叶,5-0 慕丝线结扎中叶、左外叶和右下叶后切除。离断肝周韧带游离整个尾叶。若制作85%PH 模型,则结扎并切除尾叶;若制作90%PH 模型,则结扎右上叶并切除。切除后观察肝切面无渗血且残余肝无变暗后,4-0 带针线逐层关腹,消毒切口。Sham 组小鼠开腹放置25min 后直接关腹。术毕小鼠背部皮下注射0.9%氯化钠溶液0.5 mL 后置于复温盒。每组10 只用于统计7 d 生存率,其他小鼠术后24 h取残余肝组织用于后续指标分析。前期发现术后24 h 85%PH小鼠肝组织再生开始明显增强,因此,本研究选择术后24 h作为时间研究点。
1.2.2 免疫组织化学染色 PCNA一抗浓度1∶300。每只小鼠的切片在光镜400 倍视野下随机挑选2 个视野,计数每个视野中的阳性细胞数(n1)和总细胞数(n)的比值均数,即为PCNA阳性百分率。
1.2.3 Western blot 线粒体蛋白的提取严格按照说明书操作:称取肝组织50~100 mg,加入1 mL 试剂A,转入1 mL 玻璃匀浆器中抽拉20 次,4 ℃,1 000 g 离心10 min。上清移至新EP管中,4 ℃,10 000 g离心20 min。将沉淀重悬于试剂B中,4 ℃,10 000 g 离心 10 min,重复 3 次,所得沉淀于试剂 C中裂解即得线粒体蛋白。全程冰上操作。BCA 法测定蛋白浓度。
一抗稀释比例:Mic60和COX IV为1∶500,OPA1为1∶2 500。二抗稀释比例均为1∶5 000。ECL法曝光显影,凝胶图象处理系统(Gel-Pro-Analyzer软件)分析条带光密度值。
1.2.4 ATP 含量测定 按试剂盒说明书操作:每组取3 只小鼠肝组织,冰上分别加入150 μL 裂解液,玻璃匀浆器匀浆 20 次,4 ℃,12 000 g 离心 5 min,留上清。利用 ATP 标准品绘制标准曲线,96 孔板加入100 μL ATP 检测工作液,放置5 min,每孔加入40 μL 样品,每个样品设置3 个复孔,化学发光仪测定RLU值。
1.3 统计学方法 采用GraphPad Prism 7.0软件进行数据分析,计量资料以“±s”表示,生存率比较采用one-way ANOVA,其余指标比较采用非配对t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 7 d生存率 Sham组小鼠术后7 d全部存活。85%PH组术后第2、3天死亡3只,生存率为70%。90%PH小鼠术后24 h内全部死亡。死亡小鼠解剖均未发现明显出血现象,见图1。

图1 PH小鼠术后7 d生存率
2.2 85 %PH组肝再生水平明显升高 HE染色显示两组肝组织均无坏死,85%PH 组脂肪化明显(见图2A),符合再生肝特点。85%PH组PCNA阳性率为0.043,高于Sham组的0.029(见图2A和2B),差异具有统计学意义(P<0.05)。
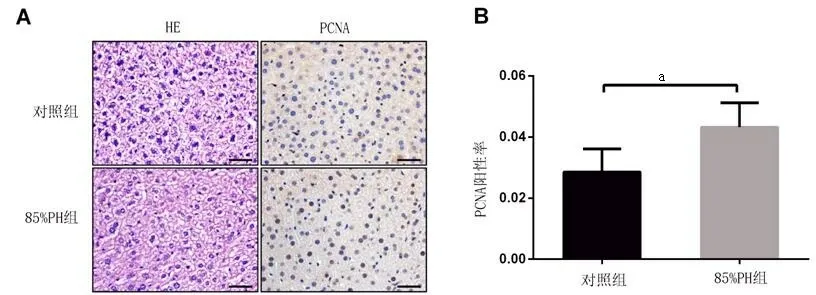
图2 PH小鼠术后24 h肝组织HE染色和PCNA表达情况(400×)
2.3 85%PH肝组织ATP含量明显升高 85%PH肝组织ATP含量为9.74 nM/mg,高于Sham 组的5.48 nM/mg,差异有统计学意义(n=4,P<0.05),见图3。
2.4 85 %PH 肝组织Mic60 表达水平明显降低 85%PH 组Mic60 水平为0.58,低于Sham 组的1.03,差异有统计学意义(n=6,P<0.05),见图4B;85%PH 组 OPA1 水平为 1.02,低于Sham 组的1.51,差异无统计学意义(n=6,P=0.0502),见图4C。
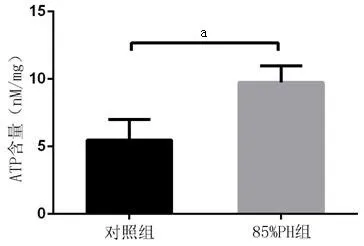
图3 术后24 h肝组织ATP含量

图4 术后24 h肝组织Mic60和OPA1表达水平
3 讨论
本研究结果显示,85%PH生存率为70%,显著高于既往研究[7],术后24 h 85%PH 残余肝再生水平显著升高。85%PH 肝组织ATP含量与肝再生程度呈正相关,高能量供应的机制值得探讨,若能找到干预靶点应用于90%PH 组,或可提高其生存率。
线粒体为细胞增殖和功能维持提供主要所需能量,且与PH术后肝功能恢复相关[8]。线粒体CM在不同生理状态下呈现不同形态。细胞呼吸时CM 变长,凋亡时CM 变宽[9]。CM 形态在不同病理状态下的作用机制及其调控属于较新研究领域,其变化可以改变线粒体超微结构中的酶活性,影响细胞能量代谢[2]。CM形态受多种蛋白调控,Mic60和OPA1是重要成员。降低和过度表达Mic60 能够导致嵴连接点数量变化[10-11]。缺乏OPA1 的线粒体缺少嵴结构[12]。本研究结果显示,85%PH 肝再生能力强、ATP 含量高,而 Mic60 和 OPA1 的表达明显下降。
有研究显示,Mic60 并非其保护性因素,肥厚性心肌病患者心脏的Mic60 表达水平升高近4 倍,在心肌中特定过表达Mic60 的小鼠心肌肥厚程度更高,ROS 生成量更多而氧化磷酸化活性降低[13]。因此,不排除85%PH 组Mic60 降低是促进能量供应的因素,这或可作为PHLF 的干预靶点。之后可在细胞水平改变其表达量,观察细胞能量代谢的变化,结合电镜观察CM形态变化,进一步探索其中的机制。
