肾衰泄浊汤及其拆方对UUO大鼠VEGF/VEGFR信号通路的影响
2021-03-10万鸣宏罗富里江坚青魏志鑫晏子友
万鸣宏 罗富里 江坚青 魏志鑫 晏子友▲
1.江西中医药大学,江西南昌 330000;2.江西中医药大学附属医院肾内科,江西南昌 330004
肾间质纤维化(RIF)是大部分慢性肾脏病发展到尿毒症时均会出现的病理表现。其形成与周细胞-肌成纤维细胞转分化(PMT)有关,肾脏损伤使血小板衍生生长因子、血管内皮生长因子(VEGF)信号通路被激活,周细胞持续向肌成纤维细胞转化,形成肾间质纤维化[1]。其中,血管内皮生长因子受体2(VEGFR2)主要见于肾小球毛细血管内皮细胞中,而血管内皮生长因子受体A(VEGFA)则可刺激内皮细胞有丝分裂和细胞迁移[2]。PMT过程使细胞外基质(ECM)持续累积,最终结果导致正常肾脏结构被破坏[3]。α-平滑肌激动蛋白(α-SMA)的表达与ECM的增多呈正相关,且为周细胞的标志性分子[4]。慢性肾脏病的中医病因可归结于虚、湿、瘀、毒[5],肾衰泄浊汤是以通腑泄浊化瘀为法而制成的中药复方,可能通过抑制VEGF信号通路的激活,进而改善肾功能。因此,本研究通过观察肾衰泄浊汤及其拆方对UUO大鼠模型中α-SMA及VEGF/VEGFR信号通路分子蛋白表达的影响,探究肾衰泄浊汤及其拆方对RIF可能的治疗途径,为中药治疗肾纤维化奠定基础。
1 材料与方法
1.1 动物分组与造模
取144只SD雌性大鼠[SPF级,合格证号:SCSK(浙)20170001,购于浙江省医学科学院实验动物中心],体重180~200g,适应喂养1周后随机分为 6组:(1)假手术组、(2)模型组、(3)肾衰泄浊汤组、(4)补虚方组、(5)袪邪方组、(6)贝那普利组,每组24只,常规分笼饲养。UUO动物模型参考文献[6]制作:实验大鼠于手术前12h 禁食、不禁水,术前称重,然后腹腔注射5.0%水合氯醛(10 ml/kg体重),待大鼠麻醉后,俯卧固定于手术台,行左侧输尿管结扎术,假手术组只作分离。
1.2 药物及试剂
肾衰泄浊汤组[生大黄10 g(后下)、巴戟天10 g、生黄芪30 g、丹参15 g、蒲公英15 g、槐花10 g、生牡蛎 30 g]、补虚方组(生黄芪 30 g、巴戟天 10 g)、袪邪方组 [生大黄 10 g(后下)、丹参 15 g、槐花 10 g、蒲公英15 g、生牡蛎30 g]。所有三种中药(均来自江西中医药大学中药饮片厂)常规水煎,浓缩成如下剂量:每毫升含0.8 g生药量,每袋150 ml,真空密封包装,存于4℃冰箱。
福州迈新生物技术开发有限公司提供HE 染色试剂盒、Masson染色试剂盒、DAB 显色试剂盒;北京中杉金桥生物技术有限公司提供磷酸缓冲液(PBS)。盐酸贝那普利(洛丁新,北京诺华制药有限公司,规格:10 mg/片,H2003014)。
1.3 治疗方法
术后第3天,中药治疗组大鼠按10倍于临床用药剂量(即成人剂量10倍)折算为等效剂量给药,即(3)(4)(5)组分别按 0.8 g/ml 肾衰泄浊汤、补虚方、袪邪方浓缩剂给药,剂量均为8.0 g/(kg·d)灌胃;(6)组大鼠贝那普利 1.5 mg/(kg·d)灌胃,假手术组、模型组予等量生理盐水灌胃。术后第7、14、21天给药,2 h后腹主动脉取血并处死,将血液滴入含0.4 ml,4% EDTA-Na2抗凝管中,离心250 g×10 min并分离血清,于-20℃冰箱保存。
1.4 检测方法
1.4.1 肾组织学检查 肾组织标本经4%福尔马林液、石蜡处理后制成约4 μm 厚切片,行HE及Masson染色。取一块经2.5%戊二醛、1%锇酸固定,Epon812、醋酸铀-枸椽酸铅处理后的0.5 mm3肾髓质组织,电镜(H-600 型)观察肾组织每个时间段变化。
1.4.2 HE及Masson染色 肾脏组织行HE染色后,根据肾脏损伤指数观察指标(肾小管扩张、肾小管萎缩、肾小管上皮空泡变性等)。每张切片随机选取10个互不重叠的皮质处肾小管视野(×400倍),每只大鼠选5张组织切片,按参考文献[7]Banff分级计分(0~3分),取平均值。肾脏组织行Masson 染色,每只大鼠选取5张组织切片,每张切片随机选10个互不重叠的皮质处肾小管间质视野(×400倍),根据文献[1]视野中胶原染色阳性面积占整个视野面积的百分比评分(0~4分),计分完成后取平均值。
1.4.3 肾组织蛋白表达 Western blot 法测定术侧肾脏组织匀浆α-SMA、VEGFA、VEGFR2蛋白的表达。
1.5 统计学处理
所有数据采用SPSS 23.0统计学软件包进行分析,计量资料采用()表示,计数资料比较采用方差分析,P<0.05为有统计学意义。
2 结果
2.1 各组大鼠肾组织病理变化
光镜下,假手术组无明显病理变化。术后第7天,观察各组组织主要为炎症和坏死病变;术后第21天,模型组组织较其他组纤维化、炎症程度更严重,且正常肾脏结构丧失,可见部分钙化甚至坏死。中药治疗的三组及贝纳普利组表现优于模型组,可观察到肾组织结构清晰,肾小球病变不明显,可见不同程度炎症细胞浸润;其中肾衰泄浊汤组病变相对其他治疗组较好。电镜下,UUO大鼠造模后术侧肾小管间质出现成纤维细胞,且细胞核固缩、线粒体嵴消失、肾小管基底膜增厚,胶原纤维排列规则;第14天见少量胶原纤维,肾小管间质胶原纤维明显增多;第21天肾小管间质开始出现大量胶原纤维,且肾小管上皮细胞出现明显细胞核固缩。经治疗后上述表现有所改善,肾衰泄浊汤组改善较其他组明显。
2.2 各组大鼠术侧肾脏HE评分和Masson评分
假手术组大鼠第7、14、21天HE评分、Masson评分无明显变化。模型组大鼠第7、14、21天HE评分和Masson评分较假手术组升高明显(P<0.05),各治疗组第14、21天 HE评分和Masson评分明显低于模型组(P<0.05),肾衰泄浊汤组第21天 HE评分和Masson评分明显低于其他三个治疗组,祛邪组第14、21天HE评分和Masson评分明显低于补虚方组(P<0.05)。见表1。
表1 各组大鼠HE评分和Masson评分(±s,分)
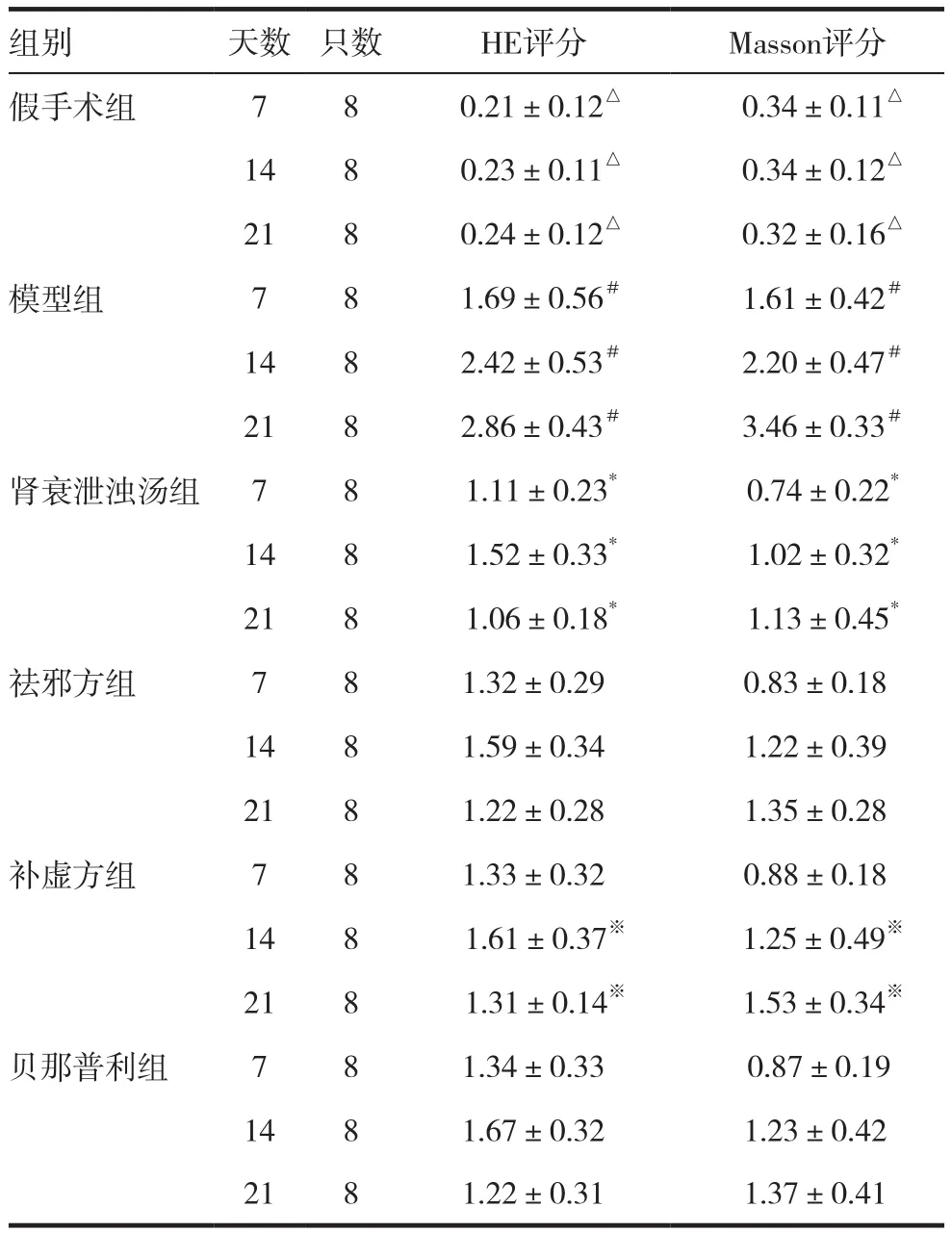
表1 各组大鼠HE评分和Masson评分(±s,分)
注:与同时段模型组及各治疗组比较,△P<0.05;与同时段各治疗组比较,#P<0.05;与同时段不同治疗组比较,*P<0.05;与同时段祛邪方组比较,※P<0.05
组别 天数 只数 HE评分 Masson评分假手术组 7 8 0.21±0.12△ 0.34±0.11△14 8 0.23±0.11△ 0.34±0.12△21 8 0.24±0.12△ 0.32±0.16△模型组 7 8 1.69±0.56# 1.61±0.42#14 8 2.42±0.53# 2.20±0.47#21 8 2.86±0.43# 3.46±0.33#肾衰泄浊汤组 7 8 1.11±0.23* 0.74±0.22*14 8 1.52±0.33* 1.02±0.32*21 8 1.06±0.18* 1.13±0.45*祛邪方组 7 8 1.32±0.29 0.83±0.18 14 8 1.59±0.34 1.22±0.39 21 8 1.22±0.28 1.35±0.28补虚方组 7 8 1.33±0.32 0.88±0.18 14 8 1.61±0.37※ 1.25±0.49※21 8 1.31±0.14※ 1.53±0.34※贝那普利组 7 8 1.34±0.33 0.87±0.19 14 8 1.67±0.32 1.23±0.42 21 8 1.22±0.31 1.37±0.41
2.3 各组大鼠肾组织α-SMA、VEGFA、VEGFR2蛋白表达量比较
假手术组大鼠可见少量α-SMA、VEGFA、VEGFR2蛋白表达。建立UUO模型后各组大鼠α-SMA、VEGFA、VEGFR2蛋白表达量明显高于假手术组(P<0.05),并随着时间增长逐渐上升。在第14天时各治疗组蛋白表达较模型组稍有升高 (P<0.05);在第21天时,各治疗组大鼠 α-SMA、VEGFA、VEGFR2蛋白表达量较模型组均有不同程度下降,补虚方、祛邪方组VEGFA蛋白表达稍有提升(P<0.05);第21天时,补虚方组α-SMA蛋白表达较祛邪方组稍有下降(P<0.05),肾衰泄浊汤组与其他治疗组比较,α-SMA、VEGFA、VEGFR2蛋白的表达量下降更明显(P<0.05),表明肾衰泄浊汤的治疗效果优于其他组。见图1、表2。

图1 各组大鼠α-SMA、VEGFA、VEGFR2蛋白表达的比较
表2 各组大鼠UUO模型中Western blot检测各个蛋白指标相对表达量(±s)
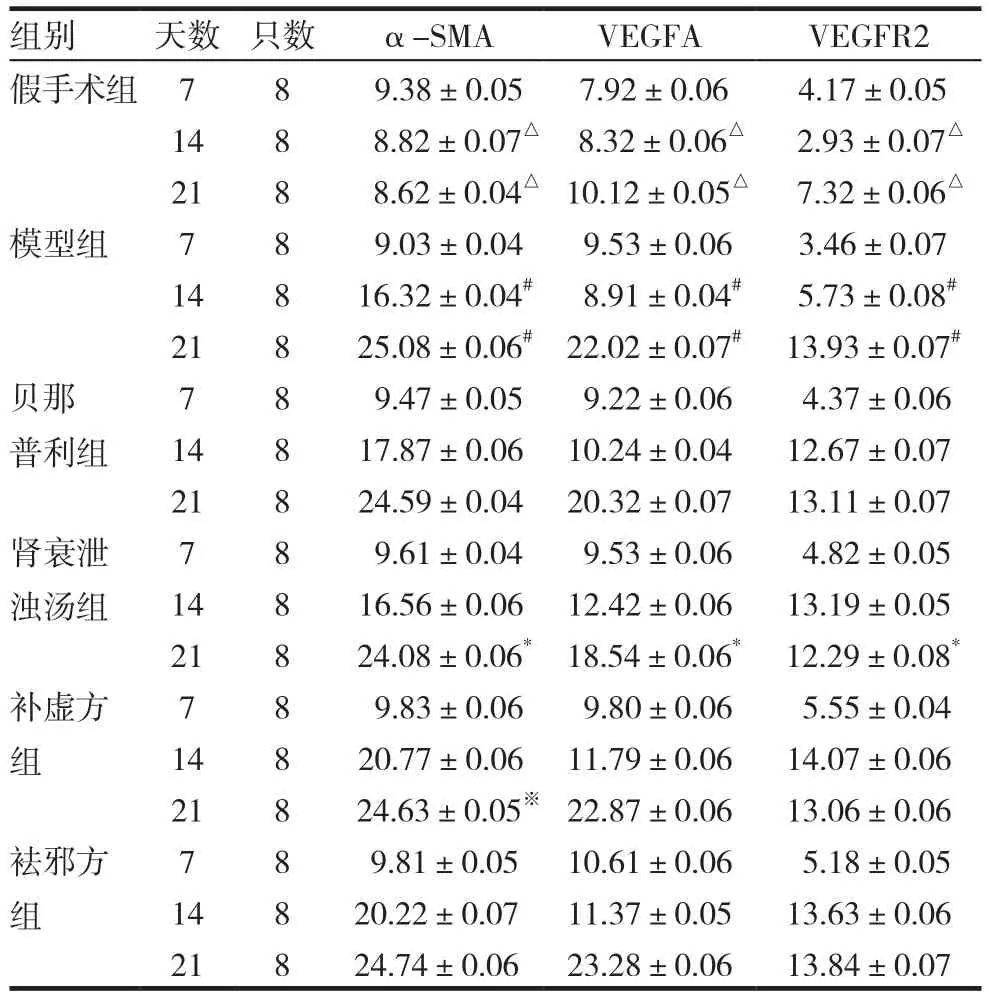
表2 各组大鼠UUO模型中Western blot检测各个蛋白指标相对表达量(±s)
注: 与同时段模型组及各治疗组比较,△P<0.05;与同时段各治疗组比较,#P<0.05;与同时段不同治疗组比较,*P<0.05;与同时段祛邪方组比较,※P<0.05
组别 天数 只数 α-SMA VEGFA VEGFR2假手术组 7 8 9.38±0.05 7.92±0.06 4.17±0.05 14 8 8.82±0.07△ 8.32±0.06△ 2.93±0.07△21 8 8.62±0.04△ 10.12±0.05△ 7.32±0.06△模型组 7 8 9.03±0.04 9.53±0.06 3.46±0.07 14 8 16.32±0.04# 8.91±0.04# 5.73±0.08#21 8 25.08±0.06# 22.02±0.07# 13.93±0.07#贝那普利组7 8 9.47±0.05 9.22±0.06 4.37±0.06 14 8 17.87±0.06 10.24±0.04 12.67±0.07 21 8 24.59±0.04 20.32±0.07 13.11±0.07肾衰泄浊汤组7 8 9.61±0.04 9.53±0.06 4.82±0.05 14 8 16.56±0.06 12.42±0.06 13.19±0.05 21 8 24.08±0.06* 18.54±0.06* 12.29±0.08*补虚方组7 8 9.83±0.06 9.80±0.06 5.55±0.04 14 8 20.77±0.06 11.79±0.06 14.07±0.06 21 8 24.63±0.05※ 22.87±0.06 13.06±0.06袪邪方组7 8 9.81±0.05 10.61±0.06 5.18±0.05 14 8 20.22±0.07 11.37±0.05 13.63±0.06 21 8 24.74±0.06 23.28±0.06 13.84±0.07
3 讨论
随着慢性肾脏病发病率的提升,RIF患者的数量也在逐渐提升[8]。故如何延缓RIF进程已成为当代研究热点。纤维化与数个生长因子及信号通路有关,如何抑制生长因子及信号通路的表达,是延缓纤维化进程的关键[9-10]。纤维化时,周细胞与内皮细胞分离,内皮细胞结构破坏、微血管裂解,导致组织缺氧以及ECM的沉积[11]。VEGF参与RIF的形成过程,其主要作用是调节血管的生成、通透性,并诱导内皮细胞增殖,内皮功能受损、组织缺氧等因素均可能导致VEGF水平升高[12]。VEGF信号通路可为PMT产生的ECM及胶原纤维提供营养物质,进而加重肾纤维化[13],同时表明,阻断VEGF信号通路可减弱肾脏纤维化,限制周细胞的增殖和与毛细血管的分离,且VEGFR2 的阻断对于防止周细胞分化为肌成纤维细胞有着更明显的作用[14]。故通过研究肾衰泄浊汤及其拆方对VEGF/VEGFR通路的影响有着重要意义。
本研究经过多年临床及实验,认为RIF病机为本虚(脾肾)、标实(瘀、湿、毒)互相作用,最终导致RIF形成[15-16]。疾病早期,标实为主,故以通腑泄浊化瘀为法,即用大黄、牡蛎泄浊毒,丹参、槐花清瘀热,蒲公英解毒利尿;疾病晚期,正气耗伤,所谓“正气存内,邪不可干,邪之所凑,其气必虚”,虚为本,故扶正以补虚,以助通络,即用生黄芪利尿消肿、补气升阳,巴戟天补肾阳、祛湿浊。中药具有多成分、多靶点的治疗优势,通过多种中药配伍,标本兼顾,能更好地发挥疗效,延缓RIF病情发展[17-19]。
实验发现,第21天各治疗组α-SMA、VEGFA、VEGFR2蛋白表达较模型组明显降低,肾衰泄浊汤组蛋白表达下降则优于其他治疗组(P<0.05)。说明肾衰泄浊汤组可以有效降低相关蛋白表达,达到延缓纤维化进程的作用。另外,第21天肾衰泄浊汤对VEGF信号通路的干预效果要优于贝纳普利组,说明肾衰泄浊汤较贝纳普利组有着多靶点治疗上的优势。补虚方组在第21天降低α-SMA蛋白表达的效果优于祛邪方组,说明补虚方对阻止ECM的形成较祛邪方更明显;RIF后期主要以本虚为主,治疗上应以补虚为重。本实验发现,通过调整祛邪方和补虚方的比例,也许可以影响VEGF/VEGFR信号通路相关的蛋白表达,但具体影响机制仍不清楚。各治疗组第21天虽能降低相关蛋白表达,但纤维指数及蛋白表达量、相对表达量仍高于假手术组,说明RIF进程的不可逆性,但肾衰泄浊汤的确能延缓RIF进程。
综上所述,肾衰泄浊汤确实能够抑制α-SMA、VEGFA、VEGFR2蛋白表达,且效果相对优于其他治疗组。其治疗机制可能是通过标本兼治、补虚通腑泄浊法来抑制ECM的积累及VEGF信号通路的激活,进而降低α-SMA、VEGFA、VEGFR2蛋白的表达,改善肾功能,延缓RIF发展。
