伏牛山区山羊遗传多样性和遗传资源评估
2021-03-10韩浩园高慧军吴依依王先宁尹慧茹王惠绘王拥庆
韩浩园,高慧军,吴依依,杨 帅,王先宁,尹慧茹,王惠绘,李 君,王拥庆,权 凯*
(1.河南牧业经济学院动物科技学院,郑州 450046;2.南阳市兽药监察所,河南 南阳 473068;3.甘肃农业大学动物医药学院,兰州 730070;4.沈丘县农牧科技研发中心,河南 周口 466300)
遗传多样性和起源、进化是动物遗传领域研究热点,线粒体DNA(mtDNA)研究涉及哺乳动物大群体遗传、属内及种间亲缘关系、系统发生、物种起源与分化方面,可解决育种、改良、选种和保种问题[1-2]。山羊是驯化较早的牲畜之一,其驯化中心在肥沃新月地带[3]。捻角野山羊(C.aegagrus)和旋角野山羊(C.falconeri)是家养山羊的两大野生祖先[4]。大量mtDNA研究结果表明,山羊具有多个母系起源并且在不同时间存在群体扩张[5]。山羊mtDNA具有7个高度分化的单倍型分支(A、B1、B2、C、D、F、G),且C支系和D支系可能分别起源于B支系和A支系[6-7],而C支系可能起源于亚洲,D支系可能起源于肥沃新月地带。中国家养山羊线粒体DNA D-loop遗传多样性丰富[8-9],可划分为A、B、C、D四个分支,并且A支系和B支系经历群体扩张,地理遗传结构分化不明显[10-11]。
伏牛山属秦岭山脉东段支脉,秦巴山脉河南片区,位于河南省西南部,是秦巴山脉生态功能区重要组成部分。伏牛山区涵盖河南省洛阳市、平顶山市、三门峡市和南阳市,占河南省总面积24 %。该区域经过自然进化和人类长期选育,形成伏牛白山羊、尧山白山羊和槐山羊3个山羊品种。目前对于伏牛山区山羊群体遗传多态性相关报道极少,本研究以伏牛山区3个地方山羊品种为研究对象,通过分析mtDNA D-loop区全序列研究其遗传多样性,分析3个山羊品种起源进化及遗传分化,确定品种遗传特征,了解各群体间亲缘关系及山羊遗传资源背景状况,为河南省畜禽遗传资源评估和育种提供重要依据,促进地方畜牧业发展。
1 材料与方法
1.1 样本采集
本研究共采集槐山羊(Huai goat,H)、尧山白山羊(Yaoshan white goat,YSB)和伏牛白山羊(Funiu white goat,FNB)共98个个体外周血样本,其中72个槐山羊样本采自河南省周口市沈丘县杰瑞槐山羊场和老城镇羊场,9个尧山白山羊样本采自河南省平顶山市鲁山县平顶山亨荣农牧有限公司,17个伏牛白山羊样本由河南省内乡县畜牧站提供。所有样本采集前由外貌体格特征确认品种血统。外周血样由EDTA抗凝管颈静脉采血5 mL,-20℃保存备用。
1.2 DNA提取与PCR扩增
采用北京艾德莱生物科技有限公司动物基因组DNA提取试剂盒提取山羊外周血基因组DNA,4℃保存备用。由生工生物工程(上海)股份有限公司合成山羊D-loop区特异性引物(上游引物序列为5'AACCACTATTAACCACATCTA 3',下游引物序列为5'CACTTACCATGTAAAAGACCC 3')。PCR扩增体系为25μL,包括DNA模板(20 ng·μL-1)1 μL,正反向引物(10μmol·L-1)各1μL,TaqPCR Master Mix 12.5μL(5μmol·L-1dNTP、1 UTaqPolymerase、1 mmol·L-1KCl、0.03 mmol·L-1Mg-Cl2、0.2 mmol·L-1Tris-HCl),ddH2O 9.5μL。PCR扩增程序为:95℃预变性4 min;94℃变性30 s,58℃退火30 s,72℃延伸60 s,36个循环;72℃延伸9 min,4℃保存。1%琼脂糖凝胶电泳检测PCR产物,将PCR产物片段与目的片段一致样本送往生工生物工程(上海)股份有限公司作双向测序(单向测序长度为1 000 bp)。
1.3 数据分析
利用Lasergene软件包SeqMan软件将双向序列拼接,利用MEGA 6.0软件[12]ClustalW作多重比对分析并截齐序列。利用截齐后1 132 bp序列构建NJ系统进化树,自举检验重复数为1 000。基于MEGA6.0软件Kimura 2-parameter(K2P)模型[13]计算槐山羊、尧山白山羊和和伏牛白山羊品种间遗传距离。导出MEGA 6.0比对后序列,利用DnaSP V5软件分析3个山羊品种D-loop区DNA多态性(核苷酸多样度Pi、单倍型多样度Hd)、品种间遗传分化(固定系数Fst、遗传分化系数Gst、种群间核苷酸平均差异数Kxy和核苷酸歧义度Dxy)和中性检验[14-15],利用DnaSP V5软件作单倍型鉴定,生成单倍型数据,导入NETWORK 10.0.0.0软件(Fluxus Technology Ltd.,Kiel,Germany)构建槐山羊、尧山白山羊和伏牛白山羊3个品种线粒体D-loop单倍型网络图。
2 结果与分析
2.1 PCR扩增结果
伏牛山区3个山羊品种98个样本DNA提取结果显示OD260/OD280为1.80~2.00,证明提取DNA无蛋白质和RNA污染。PCR扩增产物琼脂糖凝胶电泳结果显示单一、清晰、明亮条带(见图1),条带位于1 000~2 000 bp,产物长度约1 100 bp,与目标产物长度相符,可用于后续分析。
2.2 线粒体D-loop区遗传多样性分析
槐山羊、尧山白山羊和伏牛白山羊比对截齐后D-loop序列为1 132 bp,其中单态位点992个,多态(分离)位点S为105个,缺失位点为32个。3个品种98只个样本共定义56个单倍型,槐山羊和尧山白山羊存在3个共享单倍型。总单倍型多样度Hd为0.965,各品种单倍型多样度范围为0.456~0.975;总核苷酸多样度Pi为0.01214,各品种核苷酸多样度范围为0.00832~0.01234。3个品种平均核苷酸差异数k为13.318(见表1)。遗传多态性分析结果表明槐山羊和尧山白山羊D-loop序列遗传多样性丰富,而伏牛白山羊单倍型多样度明显低于另外两个品种。
图1 PCR产物琼脂糖凝胶电泳结果Fig.1 Agarose gel electrophoresis results of PCR products
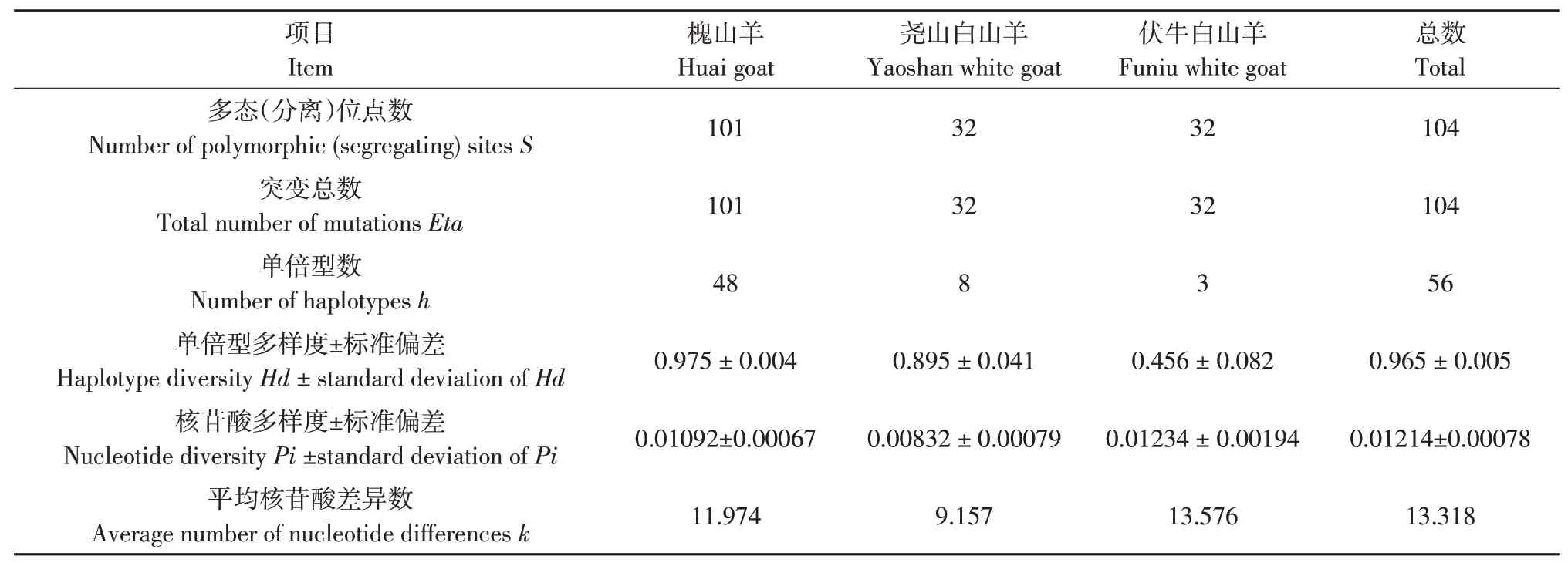
表1 3个山羊品种线粒体D-loop遗传多态性分析Table 1 Genetic polymorphisms of mtDNA D-loop of three goat breeds
2.3 群体结构分析
基于邻接法(neighbor-joining,NJ)构建槐山羊、尧山白山羊和伏牛白山羊的系统进化树(见图2),结果表明系统进化树共聚为5支(CladeⅠ~Ⅴ),CladeⅡ、Ⅴ以伏牛白山羊为主,CladeⅠ、Ⅲ、Ⅳ为槐山羊和尧山白山羊混合支。由系统发育树可见,伏牛白山羊较另外两个品种血统更纯,存在独立分支。遗传距离结果表明槐山羊、尧山白山羊和伏牛白山羊遗传距离均小于0.02(见表2),未达到亚种间遗传距离。
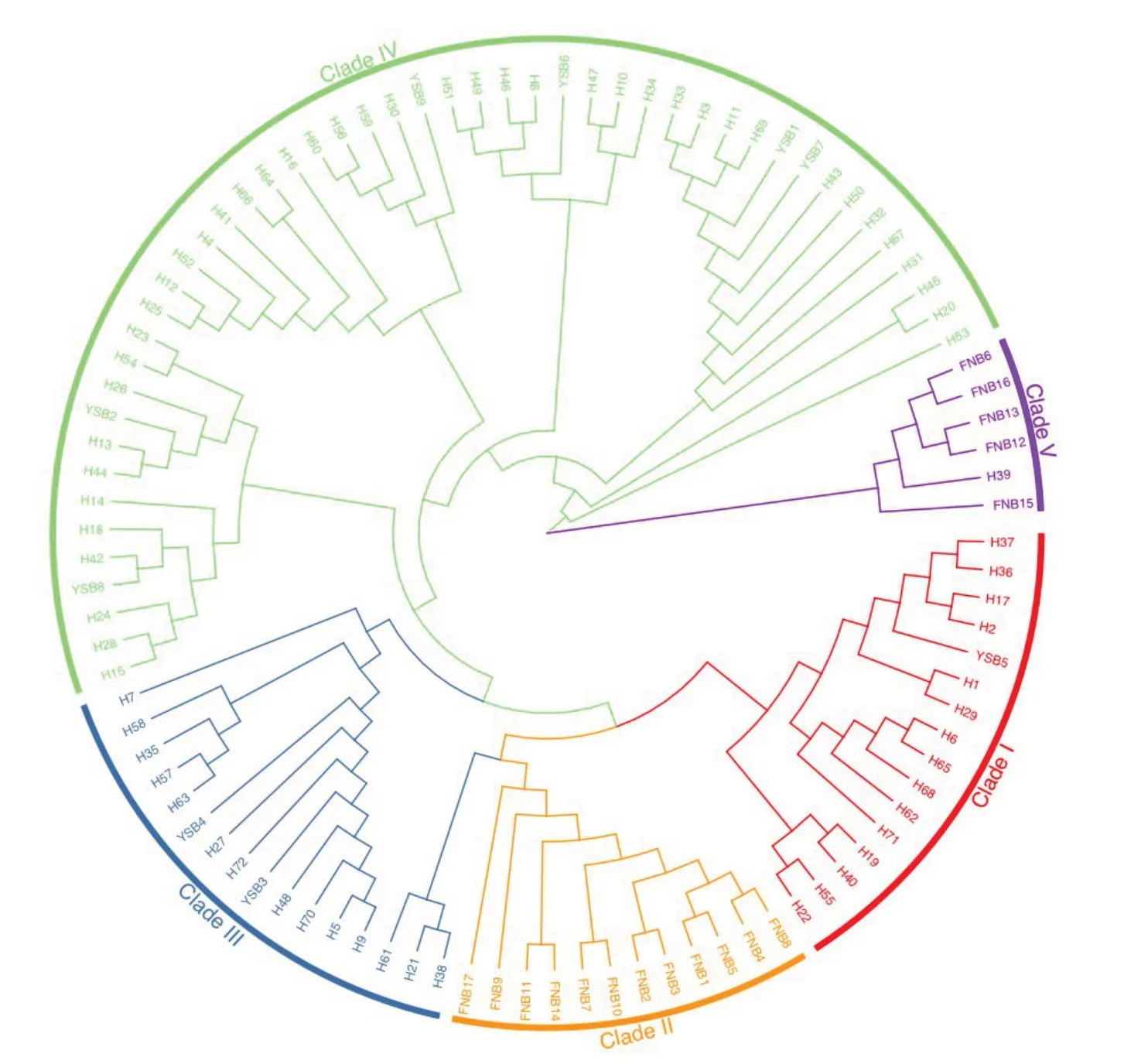
图2 基于3个山羊品种D-loop序列的系统发育树Fig.2 Phylogenetic trees of three goat breeds based on D-loop sequences

表2 槐山羊、尧山白山羊和伏牛白山羊品种间遗传距离Table 2 Genetic distance among Huai goat,Yaoshan white goat and Funiu white goat
2.4 单倍型和母系起源分析
单倍型分析共鉴定56个单倍型(Hap 1~56),其中槐山羊有48个单倍型(Hap 1~48),尧山白山羊有8个单倍型(Hap 3,8,33,49~53),伏牛白山羊有3个单倍型(Hap 54~56)。槐山羊与尧山白山羊存在3个共享单倍型(Hap 3,8和33)。单倍型网络图共有2个单倍群(Haplotype group 1和2)(见图3),单倍群1对应系统发育树CladeⅠ~Ⅳ,为槐山羊、尧山白山羊和伏牛白山羊共有单倍群,且单倍群1中各单倍型分布与系统发育树相符;单倍群2对应分支CladeⅤ,为槐山羊和伏牛白山羊单倍群。网络图结果表明河南省3个山羊品种存在两个母系起源,且可能存在共同的母系起源。
2.5 群体分化和群体扩张分析
品种间遗传分化分析结果表明品种间核苷酸平均差异数Kxy范围为10.75154~17.15931,核苷酸岐异度Dxy变异范围为0.00980~0.01564,槐山羊与伏牛白山羊山羊品种间核苷酸平均差异数和歧异度最高,尧山白山羊和槐间核苷酸平均差异数和歧异度最低。固定系数Fst范围为0.01730~0.32582,遗传分化系数Gst范围为0.01618~0.19562(见表3)。3个山羊品种间分化程度如表3所示。遗传分化结果支持系统发育树中伏牛白山羊独立分支及3个山羊品种间遗传距离的结果。
伏牛白山羊Fu and Li's F检验结果为正值,且显著偏离中性(见表4),表明伏牛白山羊近期经历过瓶颈效应和平衡选择,与伏牛白山羊遗传多态性较低结果相符。槐山羊和尧山白山羊Fu and Li's F检验均为P>0.10,不显著,符合动态平衡,未出现群体大规模扩张或瓶颈现象,群体大小保持相对稳定。
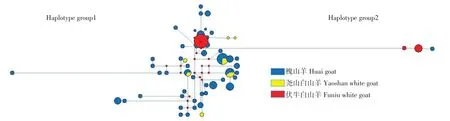
图3 基于线粒体D-loop的3个山羊品种单倍型网络图Fig.3 Haplotype network of three goat breeds based on mtDNA D-loop
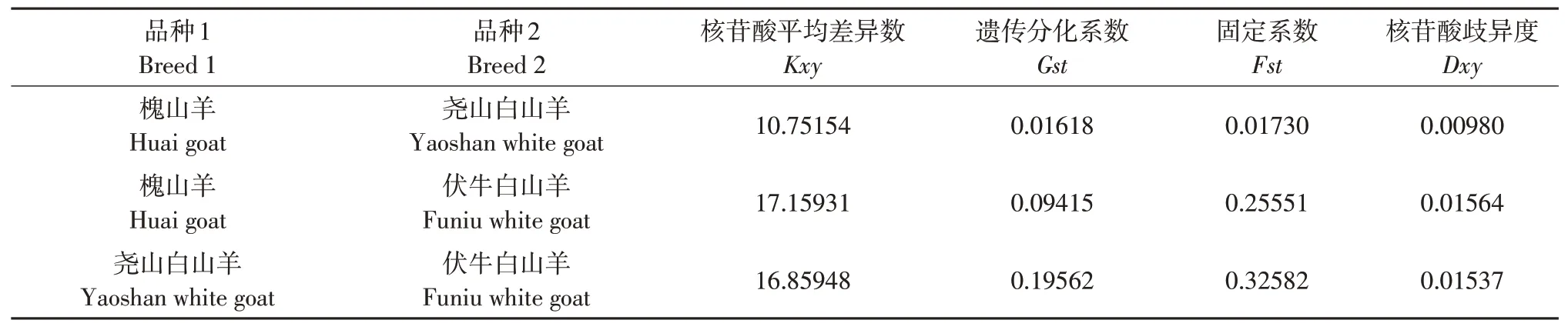
表3 品种间遗传分化系数Table 3 Genetic differentiation among breeds
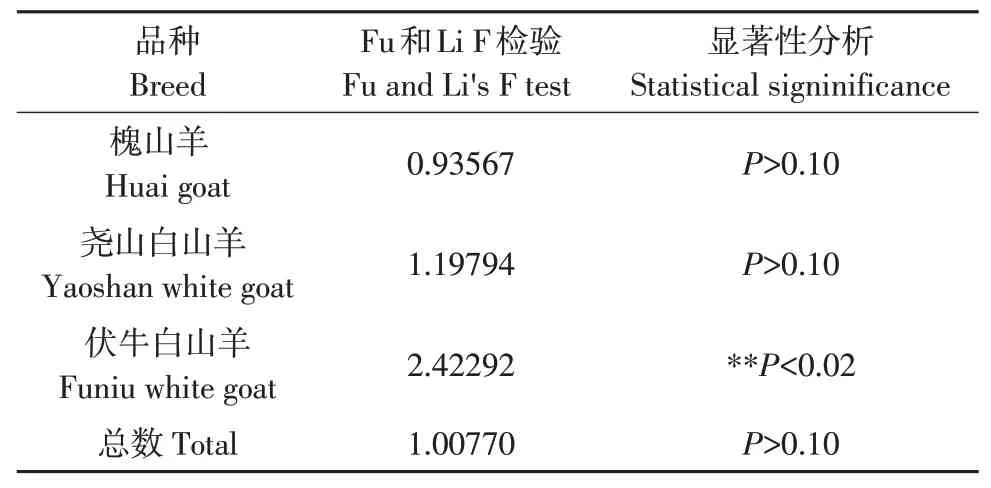
表4 中性检验Table 4 Neutrality test
3 讨 论
3.1 伏牛山区山羊遗传多样性
本研究分析3个伏牛山区山羊品种线粒体遗传多态性、品种间系统发育关系、遗传距离和遗传分化。由于本地种质资源样本稀缺,尧山白山羊和伏牛白山羊样本较少可能影响遗传多态性及单倍型分析结果。研究表明3个山羊品种核苷酸多样度均大于0.005,属于高核苷酸多样性;槐山羊和尧山白山羊单倍型多样度丰富(Hd>0.5),伏牛白山羊单倍型属于中度多态,可能与样本量较少有关。李婉清等研究表明槐山羊和伏牛白山羊线粒体D-loop区核苷酸多样度为0.0165,单倍型多样度为0.92[16],与本研究结果相近。Liu等研究表明中国山羊品种遗传多样性丰富[17-18],与本研究结果一致。巴基斯坦山羊线粒体遗传多样性丰富[19];地中海地区5个山羊品种则显示中度单倍型和核苷酸多样度[20]。
本研究结果表明98个样本共定义56个单倍型,槐山羊、尧山白山羊和伏牛白山羊D-loop区分别鉴定48个、8个和3个单倍型,大部分为品种特异单倍型,仅槐山羊和尧山白山羊共享3个单倍型,山羊D-loop仅有少数共享单倍型结果与Vacca、王杰、赵中权等研究结果一致[20-22],说明中国山羊不同群体具有独特mtDNA D-loop单倍型,不同品种间共享单倍型较少,类群单倍型丰富。槐山羊和尧山白山羊遗传多样性丰富,物种遗传多样性与其进化潜力、环境适应能力紧密相关[23],证明槐山羊和尧山白山羊具有较强进化潜力和环境适应力,从遗传多样性角度揭示槐山羊和尧山白山羊种质资源优良,发展潜力较大。
3.2 伏牛山区山羊群体扩张
在动物进化过程中,群体数量对群体遗传多样性和DNA变异有较大影响,为了解群体遗传进化历史,需检测该群体是否发生扩张。伏牛白山羊中性检验结果为正值,且显著偏离中性(P<0.02),表明伏牛白山羊近期经历过瓶颈效应和平衡选择。槐山羊和尧山白山羊中性检验不显著(P>0.10),未出现群体大规模扩张或瓶颈现象,群体大小保持相对稳定。Liu等分析9个中国山羊品种mtDNA D-loop,槐山羊属于支系A,核苷酸不配对分布曲线分析和Fu的Fs中性检验表明山羊支系A曾经历群体扩张[17],与本研究结果不一致,可能是本研究槐山羊和伏牛白山羊样本存在亚群体结构造成。目前尚无针对伏牛白山羊和尧山白山羊的群体历史动态研究结果。郝荣超等研究发现中国其他家养山羊中性检验结果不显著,表明中国山羊未出现群体扩张[24],与本研究结果一致。
3.3 伏牛山区山羊母系起源
槐山羊、尧山白山羊和伏牛白山羊系统进化树聚为5支(CladeⅠ~Ⅴ),CladeⅠ、Ⅲ~Ⅴ为槐山羊、伏牛白山羊和尧山白山羊混合支。李婉涛等构建槐山羊、伏牛白山羊和牛腿山羊NJ进化树,共聚分为3支,其中伏牛白山羊和槐山羊聚为1大支[16],与本研究结果相符,说明槐山羊、尧山白山羊和伏牛白山羊品种间有一定程度基因交流。伏牛白山羊占据CladeⅡ和Ⅴ两个分支,且CladeⅤ的5个样本与其他样本遗传差异较大,可能与采样时伏牛白山羊为不同群体或伏牛白山羊不同母系起源有关。单倍型网络图共鉴定2个单倍群,与系统发育树结果一致,表明伏牛山区山羊至少存在两个母系起源,同样,Liu等根据92种mtDNA单倍型构建中国山羊NJ系统发育树,说明中国山羊存在支系A和支系B两大母系起源[17]。杨忠诚等根据mtDNA单倍型构建贵州山羊NJ系统发育树,聚类表明贵州山羊存在支系A和支系B两大母系起源[25],本研究结果同时也支持山羊多起源说[19,26]。
4 结 论
河南省伏牛山区山羊遗传多态性较丰富,槐山羊与尧山白山羊为高遗传多态性,伏牛白山羊为中度遗传多态性;3个品种间未达到种间遗传距离,有一定的基因交流;槐山羊、尧山白山羊和伏牛白山羊存在两个母系起源,3个品种间可能存在共同母系起源;伏牛白山羊近期经历瓶颈效应和平衡选择,槐山羊和尧山白山羊群体近期维持动态平衡。
