ARID4B在牛磺酸调节成肌细胞C2C12蛋白质合成中的作用
2021-03-10高学军王璐璐
高学军,王璐璐,祁 昊,王 哲,甄 贞
(东北农业大学生命科学学院,哈尔滨 150030)
畜禽蛋白质产量由骨骼肌总量决定。骨骼肌由轴旁中胚层发育而来,由干细胞定向分化形成单核成肌细胞,进而融合形成多核肌管和成熟肌纤维。骨骼肌细胞生长发育过程不仅包括成肌细胞增殖与分化,也与蛋白质合成水平有关[1]。成肌细胞蛋白质合成是骨骼肌生长发育重要过程之一。
蛋白质生物合成受多种信号通路调控。丝/苏氨酸蛋白激酶mTOR(The mechanistic target of rapamycin)在细胞生长、增殖和凋亡等过程中发挥重要生物学作用,是众多代谢过程中核心调控因子。研究发现,mTOR信号通路可促进骨骼肌生长及再生[2]。mTOR通过mTOR复合物1(mTOR complex 1,mTORC1)和mTOR复合物2(mTOR complex 2,mTORC2)发挥调节细胞生长和蛋白质合成作用[3-4]。mTORC1使其下游两个重要信号分子S6K1(Ribosomal protein S6 kinase 1)与4EBP1(4E-binding protein 1)发生磷酸化,4EBP1磷酸化后翻译起始因子eIF4E(Eukaryotic initiation factor 4E)被释放;eIF4E与eIF4G(Eukaryotic initiation factor 4G)结合,提高mRNA稳定性,促进mRNA翻译起始;而S6K1磷酸化促使核糖体蛋白S6磷酸化,增加与蛋白质合成相关编码蛋白mRNA翻译过程。mTOR通过下游信号分子作用,促进细胞生长和蛋白质合成[5]。mTORC2则通过调节AKT和PKC激酶活化,参与细胞骨架构建及细胞极性调节等过程,影响细胞增殖[5]。
各种营养素(氨基酸、脂肪酸、葡萄糖等)和胰岛素、生长激素等均可通过PI3K(Phosphatidylinositol 3-kinase)/Akt(Protein kinese B)信号通路mTOR途径调节成肌细胞蛋白质合成[6]。在营养因子中,氨基酸既是蛋白质合成必需底物,也是mTORC1活性调节必要信号分子[7]。牛磺酸(Taurine,Tau)是哺乳动物组织中β-氨基磺酸,以游离形式存在或与胆汁酸形成复合物[8]。细胞通过Na+依赖性牛磺酸转运蛋白(Tau transporter,TauT)积累牛磺酸。此外,Tau也可通过Na+非依赖性β-氨基酸转运蛋白(The proton-coupled amino acid transporter,PAT1)进入细胞。Naghavi等研究表明,Tau可调 节PI3K/AKT、AKT/FOXO1、JAK2/STAT3和mTOR/AMPK等信号通路[9]。
AT富集区域家族(Adenine thymine-rich interactive domain family,ARID家族)是一类结合富含AT序列DNA的转录因子,具有多种调控作用[10]。ARID家族可分为7个亚家族,分别为ARID1、ARID2、ARID3、ARID4、ARID5、JARID1、JARID2[9]。ARID家族与调控细胞生长、分化和发育过程中基因表达及染色质重塑有关。ARID4B是ARID家族成员,一种染色质重塑因子[9]。ARID4B参与细胞生长和分化,与肿瘤形成密切相关,ARID4B基因在乳腺癌、肺癌、结肠癌、胰腺癌、卵巢癌和正常睾丸中高度表达,但在其他正常组织中表达有限[11]。ARID4B募集mSIN3A组蛋白脱乙酰酶复合物并诱导乳腺癌细胞转移[12]。尚未见ARID4B介导Tau调节mTOR等途径影响蛋白质合成的报道。
本试验拟观察ARID4B对小鼠骨骼肌成肌细胞系C2C12细胞总蛋白质合成以及mTOR磷酸化的影响,进一步分析Tau是否通过ARID4B-mTOR信号通路调节C2C12细胞蛋白质合成。研究结果为揭示ARID4B作用机理提供理论依据,也为Tau应用于骨骼肌生长发育和畜禽蛋白质产量提升奠定基础。
1 材料与方法
1.1 主要仪器与试剂
仪器:CO2细胞培养箱(Thermo,美国),荧光定量PCR仪(Eppendorf,德国),SW-CJ-IFD无菌操作台(安泰,苏州),YC-1层析实验冷柜(亚星仪科,北京),TY-80A/S脱色摇床(荣华仪器,江苏),倒置相差显微镜(DFC280,Leica,德国)。
试剂:牛磺酸(纯度>99%)(Sigma,美国),优质胎牛血清(P30-1402,PAN Bio-tech,德国),DMEM(12800-058,Gibco,美国),蛋白Marker(PR1800,Gibco,美国),OPTI-MEMⅠ(31985070,Gibco,美国),根据ARID4B基因序列设计合成的siRNAoligos、阴性对照siRNA(吉玛,苏州),mTOR(#2983)、磷酸化mTOR(p-mTOR)(Ser2448,#5536)(Cell Signaling Technology,美国),ARID4B(24499-1-AP,Proteintech,美国),Anti-Puromycin抗体(MABE343,Millipore,美国),β-actin抗体(sc-47778,Santa Cruz Technology,美国),二辛可宁酸(Bicinchoninic acid,BCA),蛋白浓度测定试剂盒(P0012S,碧云天,北京)。
C2C12细胞:试验用小鼠成肌细胞系由东北农业大学生命科学学院严云勤教授实验室馈赠。
1.2 细胞培养
将C2C12细胞置于37℃、5%CO2培养箱培养,待培养瓶中细胞生长至铺满瓶底70%~80%,DHank's液清洗细胞两次;吸尽培养瓶中液体后,加入500μL胰蛋白酶将其消化,37℃消化1 min左右,轻轻摇晃细胞瓶,待观察至细胞大部分脱落,根据试验所需量,加入含2×双抗、10% FBS的DMEM/F12培养液,以适当密度接种于细胞培养瓶或细胞培养板中用于后续研究。
1.3 筛选ARID4B干扰片段
ARID4B干扰片段和阴性对照RNA片段(Negative control,NC)由苏州吉玛生物有限公司设计并合成。以适当密度细胞悬液均匀铺在六孔板中,待细胞贴壁后更换成OPTI-MEMⅠ培养液,细胞饥饿12 h后,分为以下4个试验组:NC组、ARID4B-siRNA-1组、ARID4B-siRNA-2组、ARID4B-siRNA-3组,3条siRNA序列见表1。
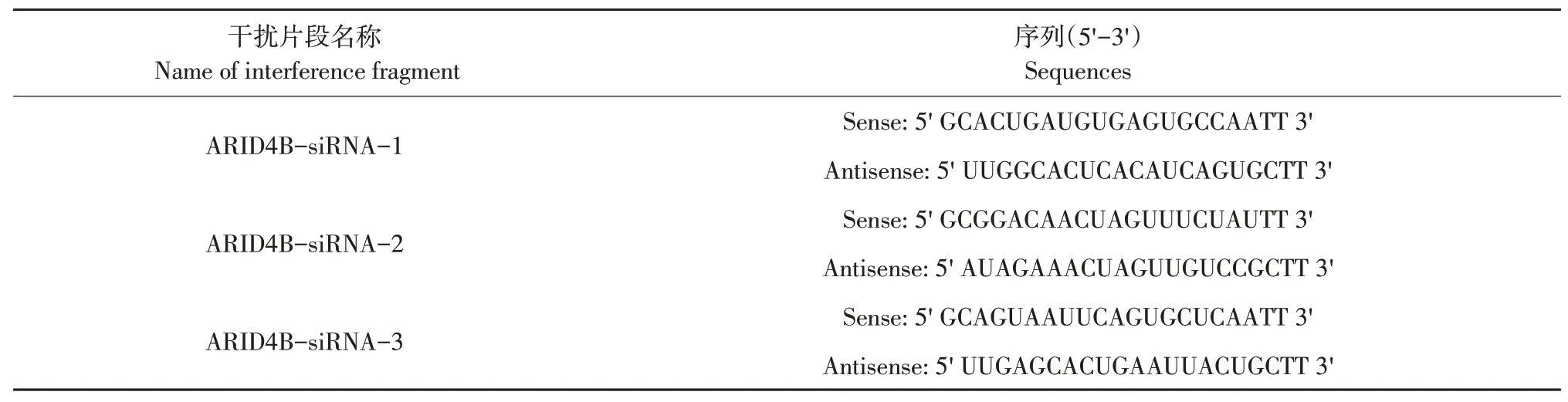
表1 ARID4B-siRNAs序列Table 1 Sequences of ARID4B-siRNAs
1.4 细胞瞬时转染
适当密度细胞悬液均匀铺于六孔板,待细胞贴壁后,试验分4组:转染NC组、Tau处理同时转染NC组、转染ARID4B siRNA组、Tau处理同时转染ARID4B siRNA组。利用siRNA-Mate转染试剂转染ARID4B siRNA,DEPC水溶解ARID4B siRNA粉末,至其终浓度20μmol·L-1;将ARID4B siRNA、NC分别与siRNA-Mate混匀(5μL NC/siRNA+8μL siRNA-Mate),静置复合物15 min,每孔用D-Hank's液清洗两遍,加入700μL的Opti-MEM I,吹打混匀,将复合物加入六孔板中。37℃、5% CO2培养箱培养24 h收样用于后续试验。
1.5 荧光定量PCR
采用qRT-PCR检测mTORmRNA表达。用RNA easyTM动物RNA抽提试剂盒提取细胞中RNA,紫外分光光度法检测RNA浓度。RNA纯度合格后,用于反转录合成cDNA,反转录反应体系见表2,37℃处理30 min,85℃保温5 min。

表2 反转录反应体系Table 2 Content of reverse transcription complex
使用qRT-PCR试剂盒(全式金,北京)将反转录cDNA产物直接用于后续qRT-PCR。冰上制备反应体系,反应程序:94℃,30 s预变性。94℃,5 s;60℃,30 s;40个循环。使用Primer 5软件设计qRT-PCR引物,送华大生物科技有限公司(武汉)合成,qRT-PCR所用引物序列见表3。以β-actin为内参基因,采用ΔΔCt法分析,计算相对定量结果(2-ΔΔCt法)。
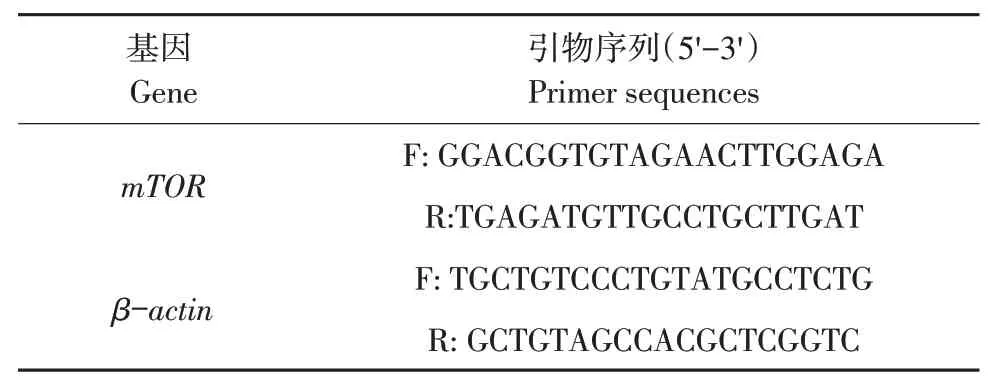
表3 qRT-PCR所用引物序列Table 3 Primer sequences for qRT-PCR
1.6 SUnSET法测定蛋白质合成速率
Enrico等开发一种基于非放射性荧光激活细胞分选的测定方法,称为SUnSET(Surface sensing of translation)法[13]。该方法可检测哺乳动物细胞中蛋白质合成速率。嘌呤霉素(Puromycin)是一种氨基核苷抗生素,与氨基酰tRNA结构接近,可作为蛋白质合成抑制剂。向细胞中添加少量嘌呤霉素,嘌呤霉素可整合至新合成的多肽链中阻止肽链延长,嘌呤霉素结合蛋白质数量可反映蛋白质合成速率。在无菌条件下用水将嘌呤霉素溶解并过滤,配制为10 mg·mL-1原液,-20℃保存。取生长良好C2C12细胞,以适当密度接种于六孔板。当细胞生长至70%左右,更换成OPTI-MEMⅠ培养液,饥饿12 h,加入不同浓度Tau(0、60、120、160和240μmol·L-1),孵育24 h,在收样0.5 h前,添加嘌呤霉素,使其终浓度为10μg·mL-1。处理0.5 h后收样,作Western blot检测。
1.7 BCA法测定细胞总蛋白质含量
采用BCA蛋白浓度测定试剂盒检测C2C12细胞中总蛋白质含量。将试剂A与B充分混匀(50∶1),配置BCA工作液,室温静置24 h。标准曲线制作:完全溶解蛋白标准品,PBS稀释至终浓度0.5 mg·mL-1;蛋白浓度测定:取标准品稀释液按0、1、2、4、8、12、16和20μL加到96孔板标准品孔中,将C2C12细胞接种于六孔板,待细胞长至60%~70%,更换成OPTI-MEMⅠ培养液,饥饿12 h,加入不同浓度Tau,孵育24 h,取10μL样品到96孔板样品孔中,PBS补足至20μL,各孔加入200μL BCA工作液,37℃放置30 min,取出平板于酶标仪上测吸光度,测定波长为562 nm。按照标准曲线计算蛋白质含量。
1.8 蛋白提取与蛋白印迹
将收样细胞去除培养液,PBS冲洗3遍,加入适量2×SDS上样缓冲液,静置10 min,充分裂解,细胞刮收集细胞,转移至1.5 mL EP管,沸水煮10 min,超声3次,每次15 s,收集样品用于后续Western blot试验。
采用Western blot方法检测mTOR、p-mTOR(Ser2448)、ARID4B和β-actin蛋白水平变化,按照SDS-PAGE凝胶快速配制试剂盒说明书(P0012AC,碧云天),制备分离胶和浓缩胶,点样。4℃、恒压80 V电泳;当溴酚蓝指示剂约达到分离胶界面时调电压至120 V,距离胶底1 cm时关闭电源;恒压75 V转膜90 min;转膜结束后,根据目的条带分子质量剪出所需蛋白条带;放入含5%脱脂乳TBST溶液中,于37℃摇床封闭1.5 h;将NC膜置于一抗稀释液,4℃摇床孵育过夜;次日,二抗37℃摇床孵育90 min,曝光,以β-actin为内参。使用Image J软件扫描蛋白灰度值。
1.9 统计分析
所得数据以平均值±标准差表示。用Excel 17.0软件处理和分析数据,数据标记字母相同为差异不显著(P>0.05),字母不同为差异显著(P<0.05)。
2 结果与分析
2.1 不同浓度Tau对C2C12细胞总蛋白质含量和蛋白质合成速率的影响
用不同浓度Tau处理C2C12细胞24 h,采用SUnSET法检测添加不同浓度Tau细胞中蛋白质合成速率。结果表明,在120μmol·L-1Tau处理下,蛋白质合成速率最高,后逐渐下降(见图1A和B)。通过BCA蛋白浓度测定试剂盒检测C2C12细胞中总蛋白质含量(见图1C),随Tau浓度从0增加至120μmol·L-1,总蛋白质含量逐渐增加,并在120μmol·L-1处达到峰值,后下降。可知,Tau剂量依赖性调节C2C12细胞中蛋白质合成速率和总蛋白质含量。
2.2 不同浓度Tau对C2C12细胞蛋白质合成相关信号通路的影响
由图2可知,添加不同浓度Tau处理细胞12 h后,Western blot检测p-mTOR、mTOR、ARID4B蛋白表达水平变化,结果表明,添加低浓度(<120 μmol·L-1)Tau可增加C2C12中磷酸化mTOR和ARID4B蛋白表达水平;添加高浓度(>120μmol·L-1)Tau,磷酸化mTOR和ARID4B蛋白表达水平逐渐降低,120μmol·L-1处呈现峰值。以上试验数据表明Tau剂量依赖性促进C2C12细胞蛋白质合成。
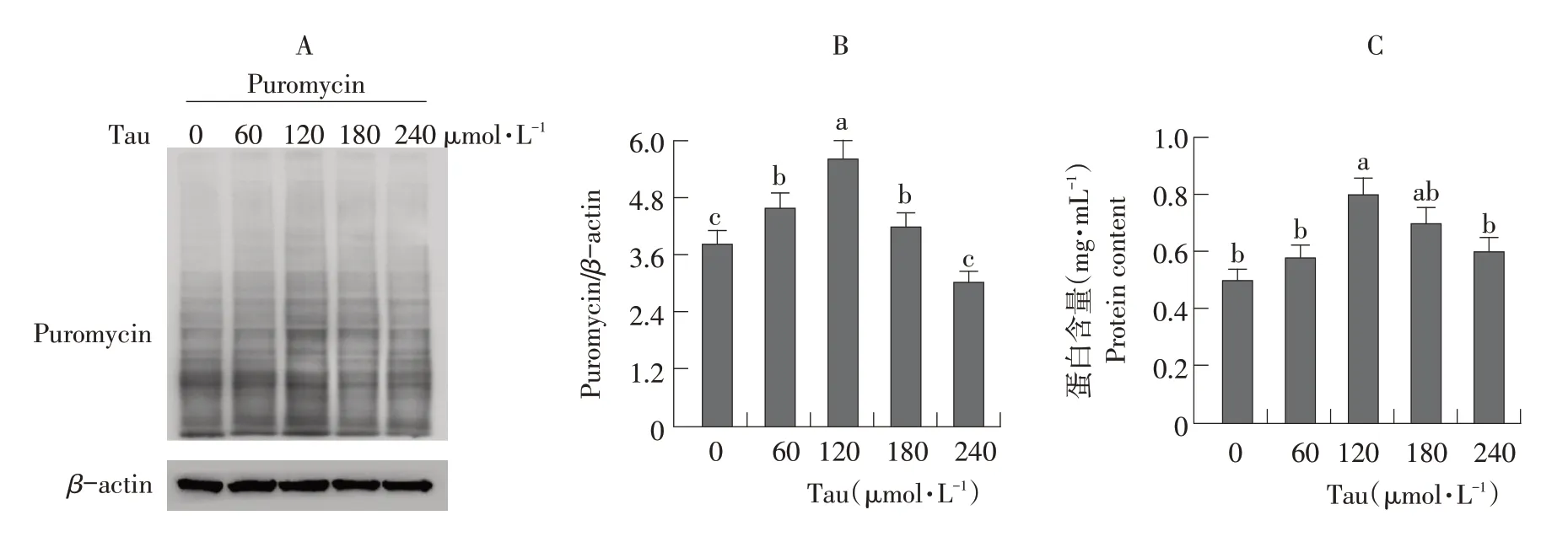
图1 Tau对C2C12细胞总蛋白质含量和蛋白质合成速率的影响Fig.1 Effects of Tau on total protein content and protein synthesis rate in C2C12 cells图1 Tau对C2C12细胞总蛋白质含量和蛋白质合成速率的影响Fig.1 Effects of Tau on total protein content and protein synthesis rate in C2C12 cells图1 Tau对C2C12细胞总蛋白质含量和蛋白质合成速率的影响Fig.1 Effects of Tau on total protein content and protein synthesis rate in C2C12 cells
A-Western blot检测添加不同浓度Tau后C2C12细胞中蛋白质合成速率变化;B-通过灰度扫描量化蛋白质合成速率变化水平;C-使用BCA蛋白浓度测定试剂盒检测添加不同浓度Tau后C2C12细胞中总蛋白质含量。数据用平均值±均方差表示,3次重复试验,不同小写字母表示差异显著(P<0.05)。下同。
A-Protein synthesis rate in C2C12 protein levels were analyzed by Western blot analysis using an antibody against puromycin.B-The Western blot was quantified by gray scale scanning.C-The total protein content in C2C12 cells was detected by the BCA protein concentration determination kit after taurine was added at different concentrations.Data were the means±SD from three independent experiments.Values with different lowercase letter indicated significant difference(P<0.05).The same as below.
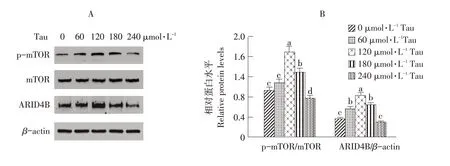
图2 Western blot检测添加不同浓度Tau对mTOR、p-mTOR和ARID4B表达的影响Fig.2 Effects of different concentrations of Tau on the expression of mTOR,p-mTOR and ARID4B by Western blot analysis
2.3 ARID4B干扰片段筛选2.3 ARID4B干扰片段筛选2.3 ARID4B干扰片段筛选
ARID4B基因干扰片段由苏州吉玛公司设计合成,共设计3条siRNA片段,通过转染和Western blot试验,筛选出ARID4B-siRNA-2(正义链:5' GCGGACAACUAGUUUCUAUTT 3',反义链:5' AUAGAAACUAGUUGUCCGCTT 3')为ARID4B干扰效果最佳siRNA片段,结果见图3。选择该干扰片段用于后续试验。
2.4 添加Tau并敲低ARID4B对C2C12细胞总蛋白质含量和蛋白质合成速率的影响
添加Tau并敲低ARID4B,24 h后收集细胞样品,使用SUnSET法检测敲低ARID4B后C2C12细胞蛋白质合成速率,采用BCA蛋白浓度测定试剂盒检测C2C12细胞总蛋白质含量。结果表明,添加最适浓度Tau提高蛋白质合成速率,敲低ARID4B阻断Tau对C2C12细胞蛋白质合成的促进作用(见图4A和B)。添加最适浓度Tau后,总蛋白质含量升高,敲低ARID4B阻断Tau对C2C12细胞总蛋白质含量的促进作用(见图4C)。结果说明ARID4B介导Tau提高C2C12细胞总蛋白质含量和蛋白质合成速率。
2.5 添加Tau并敲低ARID4B对相关信号通路表达变化的影响
添加Tau并敲低ARID4B后,C2C12细胞mTOR磷酸化变化趋势与mTORmRNA水平变化趋势相同,如图5所示。添加最适浓度Tau后,mTOR磷酸化水平显著升高,ARID4B敲低后,不仅降低mTOR磷酸化作用,且消除添加Tau对mTOR磷酸化的刺激作用(见图5A-C)。敲低ARID4B也阻断Tau对mTORmRNA表达水平促进作用(见图5D)。结果表明,ARID4B敲低阻断Tau对mTOR磷酸化和mTORmRNA表达促进作用。
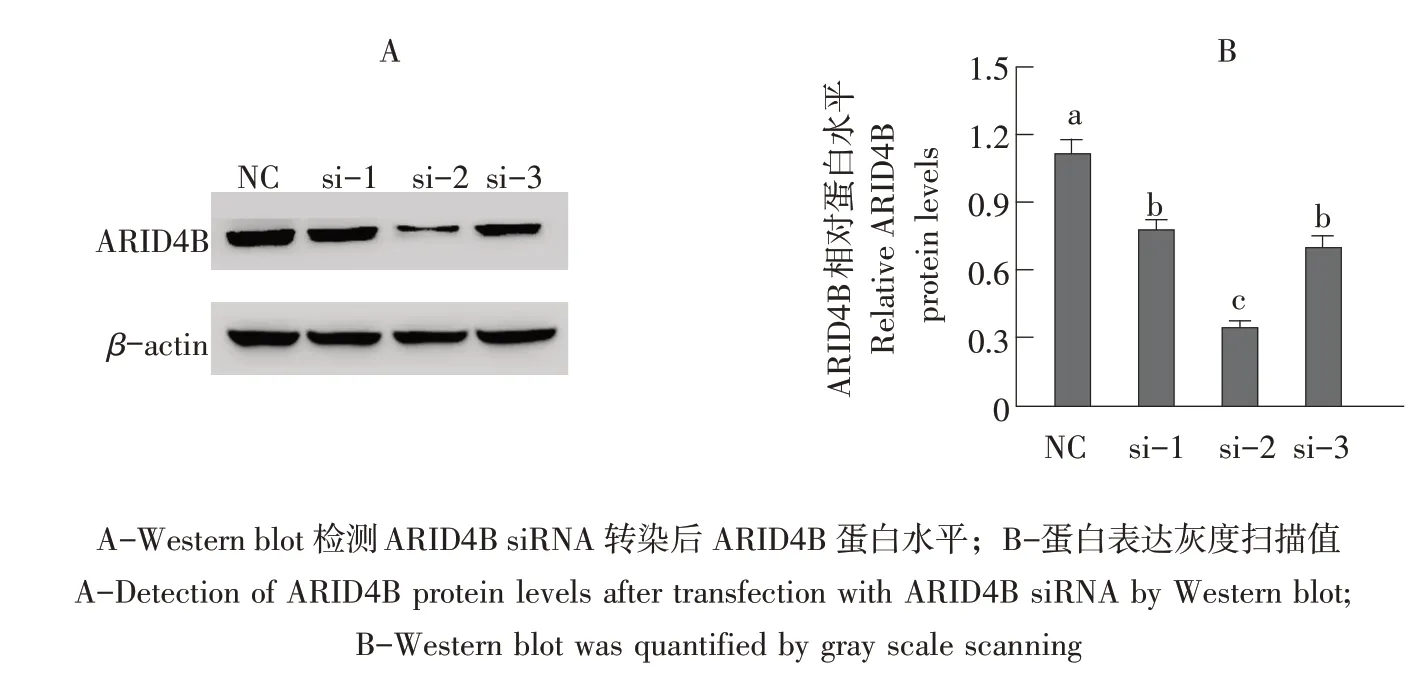
图3 ARID4B干扰片段筛选Fig.3 Screening of ARID4B interference fragments
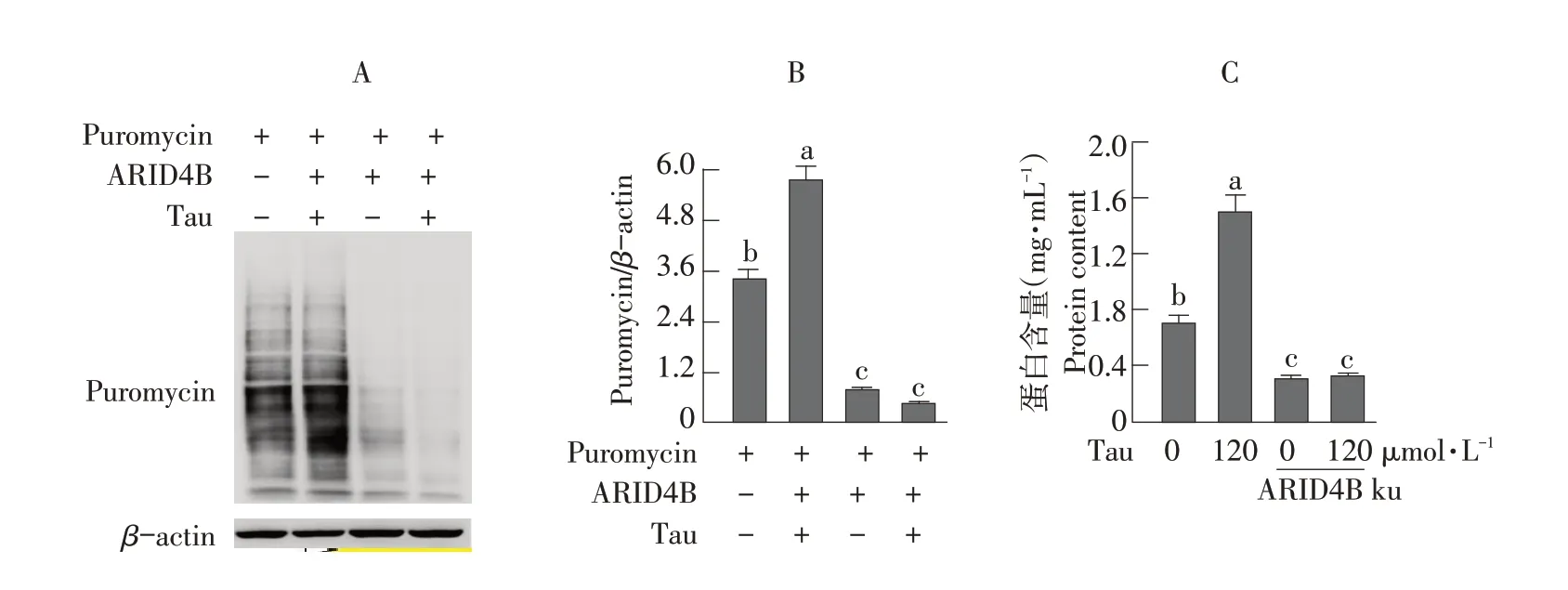
图4 ARID4B敲低对Tau调节C2C12细胞总蛋白质含量和蛋白质合成速率的影响Fig.4 Effects of ARID4B knockdown on the stimulation of Tau on total protein content and protein synthesis rate of C2C12 cells
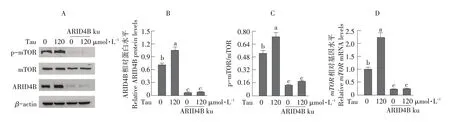
图5 敲低ARID4B基因对C2C12细胞mTOR磷酸化和mTOR mRNA表达的影响Fig.5 Effects of ARID4B knockdown on mTOR phosphorylation and mTOR mRNA expression in C2C12 cells
3 讨 论
3.1 Tau对C2C12细胞蛋白质合成的影响
研究表明,氨基酸通过G蛋白偶联受体(GPCRs)、氨基酸转运体等调控细胞信号转导通路,如PI3K、mTOR等信号转导途径[14]。早期研究表明Leu、Met、Lys、Arg、Ile等均可刺激mTOR磷酸化,其中Leu是主要激活mTOR的氨基酸[15]。Leu可提高mTOR通路中S6K1磷酸化水平,促进大鼠骨骼肌中蛋白合成,改善大鼠生长性能[16]。本研究发现,当Tau浓度低于120μmol·L-1时,Tau剂量依赖性促进C2C12细胞总蛋白质含量和蛋白质合成速率。低浓度Tau促进mTOR磷酸化,在Tau浓度为120μmol·L-1处达到峰值,后逐渐下降,表明Tau剂量依赖性促进C2C12细胞蛋白质合成。Ulrike等报道显示,过量Tau可被氧化为可能具有细胞毒性的羟乙基磺酸和磺基乙醛[17]。p-mTOR蛋白水平受Tau刺激而改变,而mTOR蛋白水平无显著变化,与本研究结果一致[18]。表明Tau剂量依赖性促进C2C12细胞中蛋白质合成,而过量Tau对蛋白质合成有抑制作用。
3.2 ARID4B介导Tau对成肌细胞C2C12蛋白质合成的影响
转录因子ARID4B具有多种调控作用,Wu报道ARID4A和ARID4B在小鼠正常发育和生理过程中具有重要作用[12]。本研究中,向C2C12细胞中添加最适浓度(120μmol·L-1)Tau后,细胞内总蛋白质含量以及蛋白质合成速率显著提高。ARID4B敲低后,细胞内总蛋白质含量以及蛋白质合成速率显著减少。通过Western blot试验进一步分析,ARID4B敲低后,mTOR磷酸化也显著降低。结果显示,ARID4B敲低不仅消除蛋白质合成功能,还消除Tau促进作用。综合以上数据表明,ARID4B介导Tau通过调控mTOR磷酸化促进C2C12细胞蛋白质合成。本试验发现Tau剂量依赖性调节ARID4B表达水平,但具体分子机理尚不清楚,有待进一步研究。
3.3 ARID4B介导Tau对C2C12细胞mTOR mRNA表达的影响
通过qRT-PCR试验发现,mTORmRNA水平在ARID4B敲低后也显著减少,ARID4B敲低也显著抑制Tau对mTORmRNA表达促进作用。Liang等研究报道ARID4B正向调节PI3K表达,且是PI3K亚基PIK3CA和PIK3R2转录激活因子[19];ARID4B等位基因与组蛋白脱乙酰基酶复合物成员mSIW3A和MSDS3结合调节基因表达[19]。因此,推断ARID4B介导Tau可能通过调节mTOR基因转录促进mTOR磷酸化,也可能激活mTOR上游PI3K基因表达从而促进mTOR磷酸化。ARID4B调节C2C12细胞蛋白质合成调控方式有待进一步研究。
4 结 论
本研究揭示Tau剂量依赖性促进C2C12细胞蛋白质合成。ARID4B介导Tau正向调节mTOR磷酸化以及mTORmRNA表达水平,促进C2C12细胞的蛋白质合成,同时揭示ARID4B介导Tau调节成肌细胞蛋白质合成功能和作用机理,为Tau作为饲料添加剂提高畜禽产肉量性状提供理论依据。
