白黎芦醇对舒尼替尼诱导肾损伤的作用及机制研究
2021-03-09金冉阳杨永健
金冉阳,杨永健
舒尼替尼是一种新型的肿瘤靶向治疗药物,自上市以来明显延长转移性肾透明细胞癌等多种恶性肿瘤患者的生存期[1-2]。但舒尼替尼治疗过程中出现的肾损伤不仅会导致癌症治疗失败,还会严重危及患者的健康和生命。目前,除了减少剂量或停止用药外,尚无更好的干预措施[3]。研究显示,舒尼替尼诱导的肾损伤主要与其本身的毒性作用以及其引起的肾脏炎症密切相关[4]。而白黎芦醇是一种主要存在于葡萄和红酒中的天然多酚化合物,具有强大的抗炎作用,常被作为多种炎性疾病辅助疗法的候选药物[5]。体内外多项研究表明,白黎芦醇可以抑制核因子κB(NF-κB)等促炎因子的表达,减轻肾脏炎症,对糖尿病肾病、顺铂引起的肾毒性等多种原因引起的肾损伤产生明显的保护作用[6]。近几十年累积证据表明,具有化学预防作用的饮食植物化学物质也是有效的表观遗传调节剂。研究显示,白黎芦醇对体内多种组蛋白乙酰化和甲基化修饰均具有强大的调控作用[5]。近年来有关组蛋白修饰在炎症中的作用逐渐引起了重视。其中,组蛋白甲基化修饰组蛋白第三亚基四号赖氨酸的三甲基化(H3K4me3)更是炎症因子转录过程中重要的调控因素,它通过激活NF-κB 等多种促炎因子的转录影响体内多种炎症反应[7]。就此推测,白黎芦醇可能通过调控H3K4me3 抑制肾脏炎症缓解舒尼替尼诱导的肾损伤。本研究拟探究白黎芦醇对舒尼替尼诱导的肾损伤的保护作用及其与表观遗传学相关的机制。
1 材料与方法
1.1 材料与试剂
舒尼替尼购于中国MedChemExpress(MCE)公司。白黎芦醇购于中国麦克林公司。NF-κB、肿瘤坏死因子α(TNF-α)和单核细胞趋化蛋白1(MCP-1)兔源性抗体购于美国Santa Cruz 公司。H3K4me3 兔源性抗体购于英国Abcam 公司。组蛋白H3,甘油醛-3-磷酸脱氢酶(GAPDH)兔源性抗体购于武汉三鹰生物技术有限公司。山羊抗兔I R Dye800 CW 二抗购于美国LI-CO R生物科技公司。肌酐、尿素氮生化检测试剂盒购于南京建成生物科技公司。RIPA 裂解液、蛋白质BCA 法定量试剂盒购自上海碧云天生物技术有限公司。苏木素伊红(HE)购于美国Sigma 公司。戊巴比妥钠、磷酸缓冲盐溶液、多聚甲醛等均为国产分析纯。
1.2 模型分组及建立
清洁级8 周WKY 大鼠30 只,雄性,体质量180~250 g,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006。采用随机数字法将WKY 大鼠分为三组:对照组(n=10),舒尼替尼组(n=10),舒尼替尼+白藜芦醇组(n=10)。采用文献[8]方法构建舒尼替尼肾损伤大鼠模型,具体给药方案见表1。
1.3 血压测定
采用大鼠鼠尾无创测压仪测量大鼠尾动脉血压。动物清醒状态下置于35 ℃保温毯预热10 min,放入固定装置,使其处于安静环境中测量血压。每隔3 min 测1 次,连测5 次,取平均值。每3 d 检测一次,记录舒尼替尼处理后大鼠血压变化。

表1 各组大鼠具体给药方案
1.4 肾功能指标检查
按文献[8],予以舒尼替尼喂养28 d 后,鼠尾静脉取血。应用肌酐、尿素氮生化试剂盒,参照说明书加入相应反应体系,全波长酶标仪检测各组吸光度光密度(OD)值,计算血清尿素氮、肌酐水平。
1.5 肾组织学检查
按文献[8],予以舒尼替尼喂养28 d 后,取大鼠肾脏进行制作石蜡切片,HE 染色观察肾脏病理结构改变。将肾组织脱水、透明、包埋,制作成4 μm 的切片,切片烘干行HE 染色,封片后在光学显微镜下观察肾脏组织形态的变化。
1.6 肾组织肾小管病理损伤评分(paller 评分)
每张切片在400 倍光镜下随机选取10 个视野进行观察,每个视野随机选取10 个肾小管,按100个肾小管记分。paller 评分标准:肾小管明显扩张,细胞扁平计1 分;刷状缘损伤计1 分,脱落计2 分;细胞质空泡计1 分;间质水肿计1 分;肾小管腔内有脱落的坏死细胞,未形成管型或碎片计1 分,形成管型或碎片计2 分。
1.7 免疫印迹法检测H3K4me3、NF-κB、TNF-α、MCP-1 蛋白水平
提取肾组织总蛋白,二喹啉甲酸法(BCA 法)测定蛋白质浓度[9]。将变性好的蛋白进行十二烷基磺酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,转膜,封闭1 h,H3K4me3、NF-κB、TNF-α、MCP-1 受体抗体(1 ∶400)4 ℃孵育过夜,TBST 缓冲液(1×TBS 含0.1%的吐温-20)洗涤3 次,羊抗兔IgG(1:5 000)室温孵1 h,TBST 洗 涤,扫 膜 显 色,Quantity One(1-D Analysis Software Version4.4,Bio-Bad inc,美国)软件分析计算H3K4me3、NF-κB、TNF-α、MCP-1 灰度比值。
1.8 统计学方法
采用SPSS 13.0 统计软件进行数据处理。计量资料用均数标准差表示,两组独立样本间的比较用t检验,三组及三组以上样本的比较用单因素方差分析,组间两两比较采用SNK 法。以P<0.05 表示差异具有统计学意义。
2 结果
2.1 各组大鼠尾动脉血压测量结果(图1)
大鼠鼠尾测压结果显示,舒尼替尼处理6 d后,舒尼替尼组大鼠血压较对照组明显升高[(121.53±2.31)mmHg vs.(113.3±2.45)mmHg,1 mmHg=0.133 kPa,P<0.05];9 d后,舒尼替尼+白藜芦醇组血压与舒尼替尼组相比明显降低[(126.3±1.75)mmHg vs.(133.5±2.12)mmHg,P<0.05]。提示白黎芦醇降低舒尼替尼诱导的高血压。

图1 各组大鼠尾动脉血压测量结果(各组n=10)
2.2 各组大鼠血清肌酐和尿素氮水平的变化(图2)
与对照组相比,舒尼替尼组大鼠血清肌酐和尿素氮水平均明显升高[(0.59±0.04)mg/dl vs.(0.47±0.05)mg/dl;(21.10±0.47)mg/dl vs.(17.34±0.59)mg/dl,P均<0.05];而 舒 尼 替尼+白藜芦醇组大鼠血清肌酐和尿素氮水平均较舒尼替尼组大鼠明显降低[(0.50±0.03)mg/dl vs.(0.59±0.04);(18.21±0.51)mg/dl vs.(21.10±0.47)mg/dl,P均<0.05]。提示白黎芦醇缓解舒尼替尼导致的肾功能损伤。
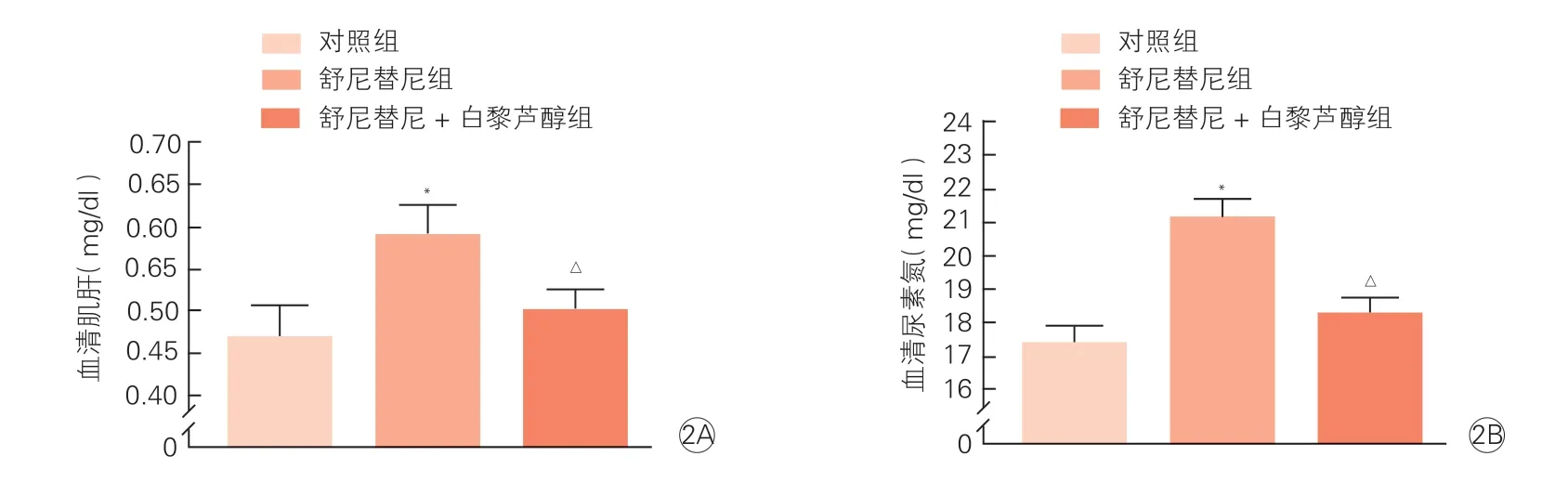
图2 各组大鼠血清肌酐和尿素氮水平的变化(各组n=10)
2.3 各组大鼠肾组织形态学变化(图3、表2)
光镜下观察肾组织病理结构,舒尼替尼组大鼠肾小管结构破坏,局部近曲小管上皮细胞肿胀、固缩死亡和炎性细胞浸润。舒尼替尼+白黎芦醇组大鼠肾结构损伤及炎性浸润均明显减轻。肾小管paller 评分结果与光镜下一致,舒尼替尼组paller 评分较对照组高[(39.12±1.91)分vs.(10.92±0.86)分,P<0.05],舒尼替尼+白藜芦醇组paller 评分较舒尼替尼组低[(23.40±1.38)分 vs.(39.12±1.61)分,P<0.05]。提示白黎芦醇可以减轻舒尼替尼导致的肾损伤以及炎症浸润。
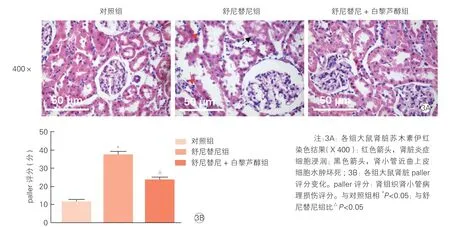
图3 光镜下观察各组大鼠肾组织形态学变化(各组n=10)

表2 各组大鼠paller 评分的变化(n=10)
2.4 各组大鼠肾脏NF-κB,TNF-α,MCP-1 蛋白表达的变化(图4)

图4 免疫印迹实验检测各组大鼠肾脏 NF-κB、TNF-α、MCP-1 表达的变化(n=10)
舒尼替尼组大鼠肾脏NF-κB、TNF-α、MCP-1 蛋白表达水平均较对照组明显升高(1.09±0.19 vs.0.49±0.05;0.92±0.02 vs.0.32±0.01;0.85±0.06 vs.0.47±0.04,P均<0.05);与舒尼替尼组相比,舒尼替尼+白藜芦醇 组 大 鼠 肾 脏NF-κB、TNF-α、MCP-1 蛋 白表达水平均明显降低(0.81±0.11 vs.1.09±0.19;0.4 2±0.0 4 v s.0.9 2±0.0 2;0.6 3±0.0 3 v s.0.85±0.06,P均<0.05)。提示白黎芦醇减轻了舒尼替尼诱导的肾脏炎症。
2.5 各组大鼠肾脏 H3K4me3 表达的变化(图5)
与对照组相比,舒尼替尼组大鼠肾脏H3K4me3水平明显升高(1.04±0.10 vs.0.55±0.04,P<0.05);舒尼替尼+白藜芦醇组大鼠肾脏H3K4me3 水平较舒尼替尼组显著降低(0.70±0.04 vs.1.04±0.10,P<0.05)。提示白黎芦醇预处理,可以抑制舒尼替尼损伤大鼠肾脏H3K4me3,减轻肾脏炎症,缓解肾损伤。

图5 免疫印迹实验检测各组大鼠肾脏 H3K4me3 表达的变化(各组n=10)
3 讨论
为了探究白黎芦醇是否对舒尼替尼诱导的肾损伤具有保护作用,我们参照文献[8]中相关指标,检测了舒尼替尼处理后大鼠血清肌酐和血尿素氮水平以及肾脏病理结构改变。结果显示,大鼠血清肌酐和尿素氮水平明显升高,肾脏肾小管结构破坏严重,局部近曲小管上皮细胞肿胀、固缩死亡,炎性细胞浸润,与文献结果一致。而白黎芦醇干预后,大鼠血清肌酐和尿素氮水平较舒尼替尼组明显下降,肾小管结构破坏,局部近曲小管上皮细胞肿胀、固缩死亡,炎性细胞浸润明显减轻。这表明白黎芦醇对舒尼替尼诱导的肾损伤具有明显的保护作用。NF-κB,TNF-α,MCP-1 是炎症损伤的标志性蛋白[10]。本研究表明,与舒尼替尼组相比,舒尼替尼+白藜芦醇组大鼠肾脏NF-κB,TNF-α,MCP-1 等促炎因子的表达降低,提示白黎芦醇通过减轻肾脏炎症缓解舒尼替尼诱导的肾损伤。肾脏是维持水钠平衡的主要器管[11],肾脏损伤是高血压发生发展的重要原因,肾脏炎症会导致压力尿钠变钝从而促进高血压发展[12]。实验过程发现舒尼替尼干预后大鼠血压明显上升,与文献结果一致;而白黎芦醇干预后,大鼠血压明显下降,这可能与其减轻肾脏炎症缓解肾脏损伤有关。
H3K4me3 是真核生物中活性基因转录起始位点的普遍的组蛋白修饰,在炎症转录中发挥着重要作用[7,13]。既往研究发现,NF-κB,TNF-α,MCP-1 等促炎基因的启动子区域的H3K4me3 积累对其转录至关重要[14-15]。白藜芦醇是一种天然的二苯乙烯结构多酚,具有较强的抗炎和抗氧化活性,被作为多种炎性疾病的辅助疗法的候选药物[16-17]。白藜芦醇干预可明显减轻舒尼替尼诱导的肾脏炎症细胞浸润,抑制肾脏促炎因子NF-κB,TNF-α,MCP-1 蛋白表达。近几十年累积证据表明,具有化学预防作用的饮食植物化学物质也是有效的表观遗传调节剂。而白藜芦醇是一种强有效的表观遗传修饰剂[5],对多种组蛋白甲基化均具有较强的调控作用[18]。研究报道,在去氧皮质酮(DOCA)盐诱导的高血压模型中,白藜芦醇可以抑制DOCA 介导的主动脉组蛋白H3K27 三甲基化(H3K27me3)[5]。本研究显示,舒尼替尼喂养可明显增加大鼠肾脏H3K4me3 水平,而白藜芦醇干预后肾脏H3K4me3水平较舒尼替尼组明显降低。提示白黎芦醇对舒尼替尼诱导的肾损伤具有良好的保护作用;且其保护作用可能与抑制H3K4me3,减轻肾脏炎症有关。
综上所述,本研究发现白黎芦醇对舒尼替尼诱导的肾损伤具有明显的保护作用,且其保护作用可能与抑制肾脏H3K4me3 水平减轻肾脏炎症有关。这提示白黎芦醇可能是一种治疗舒尼替尼导致肾损伤的新方法。
利益冲突:所有作者均声明不存在利益冲突
