助剂Co 对硫化氢与甲烷重整制氢Mo/Al2O3 催化剂稳定性的影响
2021-03-09吴静贤马哲杰任海涛曹旭康程威威
吴静贤,马哲杰,任海涛,匡 钰,曹旭康,程威威,李 平
华东理工大学化学工程联合国家重点实验室,上海 200237
随着氢能经济的迅猛发展,氢气作为“零碳”能源和化工生产中的重要原料,市场上对其需求量剧增。天然气是一种富含氢的低碳化石资源,天然气重整制氢是当前世界主流的氢气生产技术路线。然而在我国天然气资源储备中,约1/4 为含硫天然气,H2S 的体积分数从10-6到90%以上不等,广泛分布在四川盆地(16.25%)、鄂尔多斯(17.14%)、塔里木(15.43%)和海上(21.40%)[1]。H2S 具有强烈的毒性和腐蚀性,其存在对天然气的开采、运输、储存和使用等各环节都会造成严重影响,其排放还会危及人类生命安全,所以,脱除天然气中的H2S 一直是天然气工业生产的首要任务。与此同时,我国每年进口原油中的硫含量也持续上升,经加氢脱硫精制工艺产生的H2S 数量每年达数百万吨,为处置H2S 以符合国家有毒有害污染物排放限制要求所采取的各种措施耗费巨大[2]。因此,如何降低含硫天然气处理成本,又能充分回收利用H2S 所蕴含的宝贵氢和硫资源,意义重大。
工业上主要通过克劳斯工艺(Claus process)将H2S 转化为硫磺和水,但该技术造成了潜在氢能的浪费。利用H2S 直接分解制氢可以同步获得氢气和硫磺[见式(1)],不过由于受到热力学平衡限制,1 000 ℃时纯H2S 的转化率仅为20%,因此该技术至今未有工业化应用的报道。
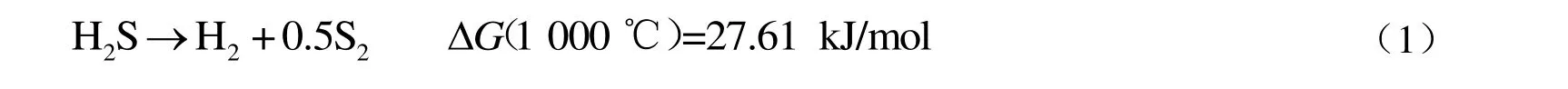

考虑到天然气蒸汽重整制氢反应过程中H2O 能使CH4发生转化,而S 与O 同为第Ⅵ主族元素,具有相似的最外层电子结构和化学性质,推测H2S 替代H2O 会表现出类似的作用,因此CH4和H2S之间是否会发生重整反应引起了研究者的极大兴趣。热力学模拟发现[见式(2)][3],与H2S 直接分解相比,相同温度下H2S 和CH4重整反应的ΔrGθ(标准状态下的反应吉布斯自由能变化)值更低,说明其在热力学上具有优势,另外,单位H2S 转化获得的氢气数量更多,而另一产物CS2在常温下为液体,易于分离,且CS2是重要的化学助剂,工业附加值高。因此,H2S 和CH4重整反应制氢技术具有较大的研究价值与广阔的工业应用前景。
目前,国内外关于H2S 和CH4重整制氢反应过程的研究尚不多[4-9]。Megalofonos 等[4]比较了无催化的热反应和MoS2催化下的H2S 和CH4重整反应,发现催化反应速率远远高于无催化热反应速率,在温度为790 ℃、进料H2S 和CH4物质的量比接近1 时,H2S 转化率最高达31.7%,但反应进行一段时间后,催化剂活性快速下降。Galindo-Hernández 等[7]制备了Fe2O3/γ-Al2O 催化剂应用于该过程,结果显示,在反应温度为950 ℃、进料H2S 和CH4物质的量比为1:12 时,H2S 转化率可达90%,但4 h后催化剂也迅速失活。李玉洋等[3,10-11]开展了包括反应热力学、催化剂制备与硫化条件、反应工艺条件等的分析与研究,发现当进料H2S 和CH4物质的量比为3:1 时,热力学上H2收率最高;以γ-Al2O3为载体制备得到的MoO3/γ-Al2O3催化剂,经硫化后,其在H2S 与CH4重整转化时具有很高的活性;不过当反应原料中CH4含量较高时,催化剂出现了失活现象。鉴于工业上Co 作为助剂的CoMo 催化剂在加氢脱硫反应过程中表现出优异的活性和稳定性,为此,本工作考察了不同Co 添加量对Mo/Al2O3催化剂在H2S/CH4重整反应过程中稳定性的影响,通过表征催化剂在不同阶段的结构变化,研究催化剂的失活原因和助剂Co 的作用,为进一步改善催化剂性能提供指导。
1 实验部分
1.1 催化剂制备
选用商业γ-Al2O3粉末(标记为Al2O3)为载体,采用等体积共浸渍法负载活性组分。Mo 和Co前驱体分别为四水合钼酸铵[(NH4)6Mo7O24·4H2O,AR]和硝酸钴[Co(NO3)2·6H2O,AR]。制备时将配置好的混合溶液缓慢滴加至载体上,期间用玻璃棒不断搅拌直至形成均匀呈半流动状态的糊状物,随后密封并在室温下放置12 h,再放入110 ℃烘箱中干燥12 h,接着移入马弗炉中,以2 ℃/min 速率升温至500 ℃并维持4 h,自然降温后进行筛分,取粒径为40~80 目(0.180~0.425 mm)样品进行反应性能评价。
不同样品中以MoO3计的理论负载量均为20%(质量分数),CoO 的质量分数为x,其值分别为1%,3%,5%和20%,所得催化剂样品记为xCo20%Mo/Al2O3。
1.2 催化剂表征
催化剂粉末样品的晶相结构采用德国Bruker 公司的Advance-D8 多晶X-射线衍射仪(XRD)分析;形貌采用美国FEI 公司的Nova Nano SEM 450 超高分辨场发射扫描电镜(SEM)观测;微观形貌和尺寸采用日本JOEL 公司的JEM2100F 型高分辨透射电子显微镜(HRTEM)观测;比表面积采用美国Micromeritics 公司的ASAP-2020 低温N2物理吸附仪测定,采用Brunauer Emmett Teller(BET)方法计算比表面积;积炭量采用德国Elementar 公司的VARIO ELⅢ型C/H/N/S 元素分析仪分析。
1.3 催化剂活性评价
催化剂样品的活性评价在连续流动固定床反应器中进行,反应器为石英管,管内径为8 mm,反应原料气体由反应管上端进入,下端流出,反应尾气经气相色谱在线检测后,用乙醇胺多级吸收后放空。采用两台色谱仪定量分析反应前后的气体组成,包括H2S,CH4,N2,CS2和H2,其中GC-1 色谱(美国PerkinElmer 公司Claus 680 型)以H2为载气、采用热导检测器(TCD),色谱柱采用PQ柱(分析H2S 和CS2)与5A 分子筛柱(分析CH4和N2)串接方式;GC-2 色谱(美国PerkinElmer公司Claus 580 型)以N2为载气、采用TCD 检测器和5A 分子筛柱,来测定H2含量。
催化剂样品在反应测试前,预先于常压、500 ℃、H2S 流量为10 mL/min 和N2流量为90 mL/min的条件下硫化1 h。随后升温至800 ℃,在体积空速为20 000 h-1、H2S 流量为10 mL/min、CH4流量为50 mL/min、N2流量为40 mL/min 条件下反应,测定反应出口尾气中的H2S,CH4,CS2和H2含量,计算H2S 和CH4的反应速率及H2的生成速率,两者分别定义为单位质量催化剂上单位时间内转化的H2S(或CH4)和产生H2的物质的量,计算公式如下:

式中:rH2S,rCH4和rH2分别为H2S 和CH4的反应速率以及H2的生成速率,mmol/(g·min);Fi0和FH2分别为进口组分气体i与出口气体中H2的体积流量,mL/min;Xi为反应组分i的转化率,%;Wcat为催化剂样品的质量,g。
对反应前后各物料中的H 元素进行了质量平衡计算,结果表明,始终保持在5%偏差之内。
2 结果与讨论
2.1 Co 含量对Mo/Al2O3 催化剂活性和稳定性的影响
图1 为不同Co 添加量下、20%Mo/Al2O3催化剂上H2S 和CH4的反应速率及H2生成速率随时间的变化情况,5 种催化剂在经历20 h 反应后的平均反应速率及H2生成速率汇总于图2 中。

图1 不同Co 添加量的20%Mo/Al2O3 催化剂H2S 和CH4 的反应速率及H2 生成速率随时间的变化Fig.1 The changes of rH2S,rCH4 and rH2 with time on stream over the 20%Mo/Al2O3 catalysts with different Co addition amount
由图1 和图2 可知,不同Co 添加量的20%Mo/Al2O3催化剂,H2S 和CH4的反应速率均随反应时间增加明显下降,说明添加Co 未能有效阻止催化剂性能的衰退;添加少量Co(含量为1%和3%)后,催化剂上H2S 的平均反应速率改变不明显,Co添加量较多(含量为5%和20%)的情况下,H2S的平均反应速率甚至有所下降,说明添加Co 并未有助于H2S 的转化;但添加Co 后催化剂提高了CH4的转化活性,并且随Co 添加量的增多CH4的反应速率持续提升,不过当添加量为20%时,CH4平均反应速率与添加5% Co 的催化剂相比提升幅度减少了;从平均H2生成速率结果来看,在20%MoAl2O3催化剂中添加Co 对H2的生成是有利的。根据反应式(1)~式(3),并结合H2S 与CH4的反应速率及H2的生成速率结果可以推测,添加Co 对H2S 的转化影响不大,但促进了CH4的裂解反应,使得H2生成量增多,也意味着催化剂上的积炭量可能会增加。

图2 不同催化剂反应性能比较Fig.2 The comparison in reaction performance of different catalysts
2.2 不同催化剂的结构表征
图3 是硫化后的20%Mo/Al2O3催化剂与3%Co20%Mo/Al2O3催化剂的SEM 照片。由图3可以看到,两者存在细微差异,添加Co 后颗粒堆积较为密实,但基本不改变原有20%Mo/Al2O3催化剂的外观形貌。

图3 不同催化剂硫化后的SEM 照片Fig.3 SEM photos of different catalysts after sulfurization
图4 为不同Co 添加量的20%Mo/Al2O3催化剂在硫化和反应后的XRD 图谱。由图4(a)可知,5种硫化后的催化剂,除了在2θ为37.603°,39.491°,45.862°和67.032°处的衍射峰与载体γ-Al2O3的标准图谱(JCPDS No.10-0425)一致外,还出现了位于2θ为26.033°,37.025°和53.512°处代表MoO2物相(JCPDS No.32-0671)的衍射峰[12],以及位于2θ为14.378°,32.676°和58.334°处代表层状六方晶系2H-MoS2物相(JCPDS No.37-1492)的衍射峰。但所有含Co 样品均未检测到Co 物种,即使添加量达到20%,20%Mo/Al2O3催化剂的物相未有本质变化,说明添加的Co 成分在催化剂表面呈高度分散状态。不同Co 添加量下,MoO2物种在2θ为26.033°处的衍射峰强度却有较大变化,硫化后的3%Co20%Mo/Al2O3催化剂在此处的衍射峰强度最高,但Co 添加量继续增加后此峰减弱,当Co 添加量达20%时,此处的峰强度已相当微弱,说明Co的添加确实对MoO3的硫化状态产生了影响。推测MoO3在硫化过程中可能经历了式(6)和式(7)的反应[11],因此,MoO2应该是MoO3向MoS2转变的中间物种,而Co 的存在能够改变这两个反应的速率,当Co 添加量较多时,可能加快了反应式(7)中MoO2的转化,使得催化剂样品中MoO2的含量减少,MoS2的含量则相应增加,这一点从图4(a)所示样品的XRD 图谱中,MoO2与MoS2物种的衍射峰强度的相对变化得到验证。图4(b)是不同Co 添加量的催化剂反应后的XRD 图谱。由图4(b)可知,反应后催化剂上未检测到MoO2物种,而MoS2(002)面(2θ为14.378°)的衍射峰强度却明显增强,说明随着反应过程中H2S 原料气体的持续通入,MoO3硫化形成的MoO2物种转化为MoS2,并且MoS2的颗粒尺寸有所长大;反应后催化剂在2θ为29.594°,44.005°和46.458°处出现了Co3Mo 物种特征峰(JCPDS No.29-0488),表明在有H2大量生成的还原性气氛中,形成了Co3Mo合金,同时,在2θ为30.698°,35.422°,46.916°和54.370°处出现了CoMoS3.13物种特征峰(JCPDS No.16-0439),且衍射峰强度随Co 添加量增加而增强,推测该物种是反应状态下Co 在催化剂体相中的主要存在形式。

图4 不同Co 添加量的20%Mo/Al2O3 催化剂硫化后(a)及反应后(b)的XRD 图谱Fig.4 XRD patterns of the 20%Mo/Al2O3 catalysts with different Co addition amount after sulfureted (a) and after reaction test (b)

图5 为Co 添加前后20%Mo/Al2O3催化剂在硫化与反应后的HRTEM 图片。

图5 20%Mo/Al2O3 与3%Co20%Mo/Al2O3 硫化催化剂反应前后的HRTEM 图片Fig.5 HRTEM images of 20%Mo/Al2O3 and 3%Co20%Mo/Al2O3 catalysts at different stages
从图5 中可以清楚分辨出层状结构的MoS2颗粒。比较图5(a)和图5(c)发现,Co 添加后载体表面分布的MoS2颗粒尺寸变化不大;反应后的20%Mo/Al2O3与3%Co20%Mo/Al2O3样品中,MoS2颗粒尺寸与反应前相比均有所变大,一方面与MoO2的转化有关,另一方面则可能是因较长时间高温反应引起了颗粒长大。从图5(e)箭头所指处可清晰地看到,围绕着长条形层状MoS2颗粒(层间距为0.65 nm)的边缘四周存在着层数较少、间距约为0.34 nm 的物质结构,推测为石墨烯层,而从图5(f)圆圈标示处发现了直径为数十纳米的管状结构物质,应为纳米碳管,说明3%Co20%Mo/Al2O3催化剂在反应过程中发生了较为严重的积炭现象,特别是纳米碳管的出现,应该与Co3Mo 合金形成有关,因为此类金属是用于纳米碳管生长的高活性催化剂[13]。而无Co 添加的20%Mo/Al2O3催化剂上并无纳米碳管存在的迹象。
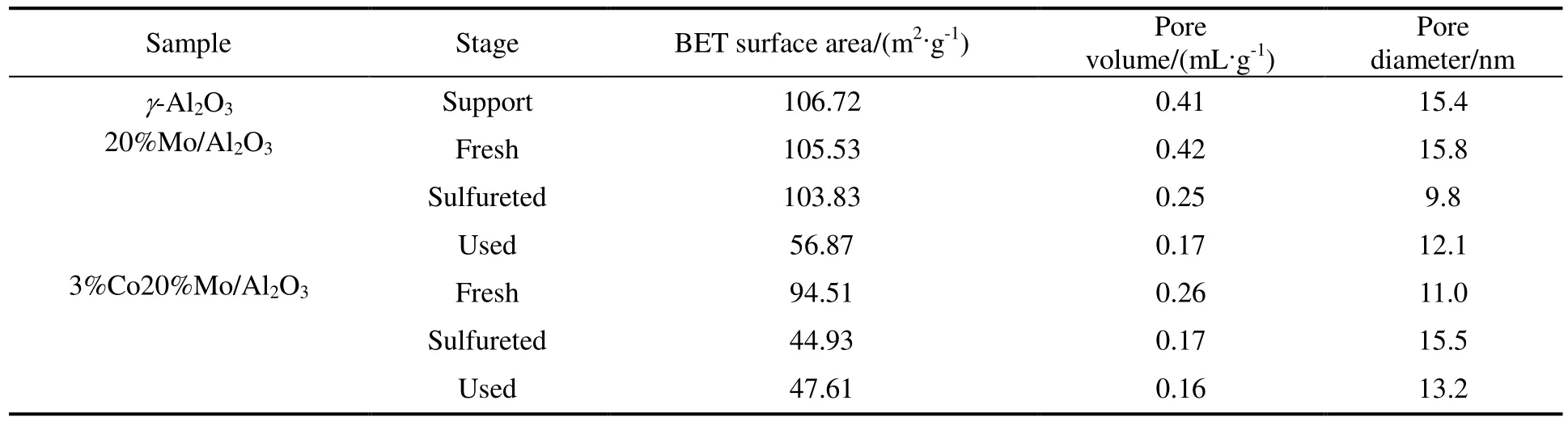
表1 为载体及Co 添加前后催化剂的BET 测定结果。由表1 可以看出,20%Mo 活性组分负载后的γ-Al2O3,无论是比表面积、孔容还是孔径,均与载体的对应值相当,说明负载过程未对载体的织构造成明显影响,但20%Mo/Al2O3 催化剂反应后的比表面积下降较多,孔容也减小了,这可能是由于较长时间高温反应导致了孔结构坍塌引起的。此外,也有MoS2 颗粒长大以及积炭因素的影响,而3%Co20%Mo/Al2O3 催化剂在硫化后即有织构上的较大变化。
不同催化剂在反应20 h 后的积炭量分析结果见图6。由图6 可知,所有催化剂上都有大量积炭。相比于无Co添加的20%Mo/Al2O3催化剂上的积炭量(质量分数为11.84%),Co 添加后催化剂上的积炭量都有明显增加,Co 添加量越多,相同反应时间内的积炭量也越多,说明Co 促进积炭的生成,而Co3Mo 合金的形成加快了CH4的裂解,其对H2S的解离却无活性,使得通过式(3)途径发生的副反应更多,而按照式(2)进行的主反应则受到一定程度的抑制,因而加剧了催化剂上积炭程度。但此结果与CH4干气重整过程中添加Co 能促进催化剂表面碳物种的气化,从而显著降低反应过程中的积炭[14]这一结论完全不同,说明H2S 和CH4重整与CH4干气重整两者的催化反应机理可能存在较大差异。由于Mo/Al2O3催化剂中MoS2颗粒的边缘是H2S 和CH4重整反应的活性位所在[11],因此,积炭对活性MoS2颗粒边缘的逐渐覆盖应是催化剂活性衰退的主要原因,同时也不能排除MoS2颗粒自身在高温反应过程中长大,导致活性位减少,造成催化剂稳定性下降。另一方面,虽然Co-Mo-S 结构通常被认为是加氢脱硫反应催化剂的活性相[15],但H2S 和CH4重整反应过程中CoMoS3.13物种的出现及其含量的增多并未能阻止催化剂性能的衰退。
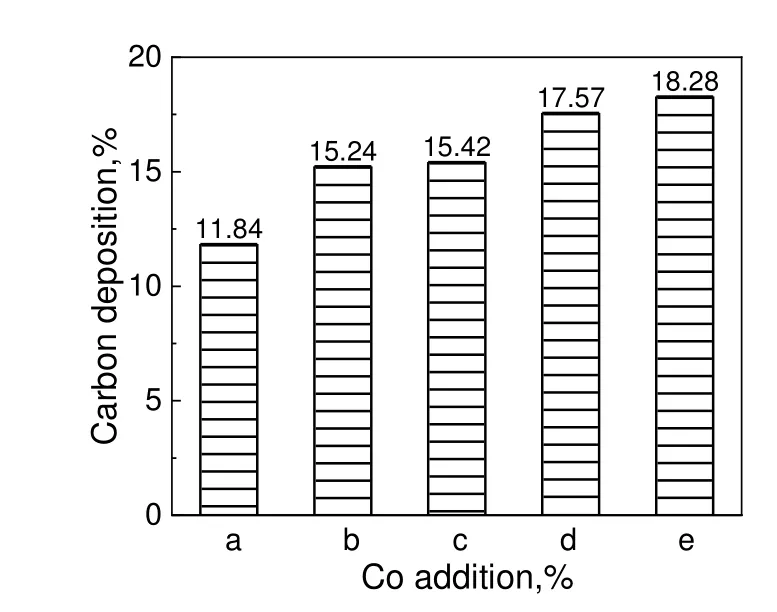
图6 不同Co 添加量的20%Mo/Al2O3 催化剂20 h 反应后的积炭量Fig.6 Carbon deposition amount of 20%Mo/Al2O3 catalysts with different Co addition after 20 h reaction test
3 结论
H2S 和CH4重整制氢是一条新型的制氢技术路线。以商业γ-Al2O3为载体、等体积浸渍法制备的20%Mo/Al2O3催化剂(MoO3重量负载量为20%),在常压、反应温度为800 ℃、H2S 和CH4的体积比为1:5、体积空速为20 000 h-1的反应条件下,存在着失活现象,通过共浸渍方式添加一定量的Co(CoO 质量分数为1%~20%)形成的催化剂对H2S 的转化影响不大,但提高了CH4的反应速率,进而促进了H2的生成,且CH4的反应速率与Co 含量有关。催化剂结构表征结果表明,Co 添加后,催化剂上的积炭量增多,且也与Co 含量有关。推测添加Co 形成的Co3Mo 合金加快了CH4的裂解反应,导致较多积炭覆盖MoS2颗粒边缘活性位,造成了催化剂稳定性的下降。因此,Co 的存在提高Mo/Al2O3催化剂产氢速率的同时,降低了催化剂的稳定性。
