Rho激酶抑制剂介导RhoA/ROCK2通路对VaD大鼠海马神经元的保护机制
2021-03-09胡跃强向军军邓秋媚莫雪妮
胡跃强, 向军军, 邓秋媚, 吴 林, 莫雪妮, 陈 炜, 姚 春
血管性痴呆(vascular dementia,VaD)是指由一系列脑血管因素引起的在脑组织损害基础上产生的以高级神经认知功能障碍为主的临床综合征[1,2]。其确切的发病机制尚未完全清楚,但临床疗效也不甚理想[3]。因此,对于VaD的机制及治疗研究显得十分迫切。新近研究发现,小G蛋白RhoGTP酶亚家族(ras homolog gene family member A,RhoA)/Rho激酶(rho-associated protein kinase,ROCK)通路在轴突生长分化、树突棘形成和维持以及记忆过程中起重要作用[4]。在认知障碍患者脑组织中,RhoA/ROCK2活性上调[5],而降低ROCK2的表达,或者抑制Rho或ROCK2的活性均可减缓认知障碍的发展[6],故其有望成为治疗VaD的重要靶点。本研究采用腺相关病毒(adeno-associated virus,AAV)基因干扰技术表达短发夹结构RNA(Short hairpin RNA,shRNA)抑制RhoA/ROCK2信号通路,观察其对VaD大鼠的影响,以期为防治本病提供新靶点和新思路。
1 材料和方法
1.1 实验动物与分组 健康雄性SPF级SD大鼠40只,3月龄,体重(250±50)g,由湖南斯莱克景达物实验动物有限公司提供,动物许可证号:SCXK湘2019-0004。随机分成4组(n=10):假手术组、模型组、ROCK2干扰组(腺相关病毒)、对照组(ROCK2空载体病毒)。
1.2 药物制备及主要仪器试剂 (1)实验药物 AAV9-ROCK2-shRNA注射液及空载体病毒:由上海吉满生物科技有限公司制造;(2)主要试剂:引物及内参(天根生物科技有限公司),BCA试剂盒、β-actin抗体(碧云天生物公司);兔抗RhoA多克隆抗体、兔抗ROCK2单克隆抗体、兔抗MLC多克隆抗体(美国Abcam);兔抗MLCP单克隆抗体(北京Bioss)。
1.3 实验模型制备及药物干预方法 参照文献制备VaD大鼠模型[7],评估模型成功后,将AAV-ROCK2-shRNA原液稀释至5.07E+12VG/ml,采用脑立体定位仪将ROCK2干扰剂注射海马组织,每只动物注射总量4 μl,持续5 min;阴性对照组注射等量空载体病毒。术后各组大鼠正常喂养,观察4 w。
1.4 指标观察
1.4.1 学习记忆能力测定 定位航行实验:第1周、第4周,每组大鼠每天上下午从4个象项各训练一次,将大鼠寻找平台的时间设置为120 s,记录大鼠从入水到爬上平台所需时间,即逃避潜伏期,此作为大鼠空间学习能力的检测指标。空间搜索实验:大鼠完成定位航行实验后,于第1周、第4周进行空间探索实验,撤走平台,依次将大鼠从4个象限放入水中,分别记录其跨越原来平台的次数作为空间记忆的检测指标。
1.4.2 实时荧光定量聚合酶链式反应(Real-time PCR)测各组大鼠RhoA、ROCK2、MLC、MLCP mRNA表达 取海马组织置于1 ml EP管内,在-80 ℃条件下保存,总RNA运用Trizol法提取,提取完成后取2 μg RNA开始逆转录。引物序列:β-actin:上游5’-GCGCAAGTACTCTGTGTGG-3’,下游5’-AGGGTGTAAAACGCAGCTCAG-3’;RhoA上游5’-AGGATTGGCGCTTTTGGGTA-3’,下游5’-TTCACAAGATGAGGCACCCC-3’;ROCK2上游5’-ACAAACCAAGCTAACTGCCT-3’,下游5’-CTACGGGTGCGGTTCTTTCT-3’;MLC上游5’-CTCGGACGAGTGAACGTGAA-3’,下游5’-GAGAACCTCTCTGCTTGCGT-3’;MLCP上游5’-CCCGAGGAT GTGATCACTGG-3’,下游5’-TGCGGCTACAAGCCTATCTG-3’。逆转录后扩增条件如下:94 ℃预变性2 min,94℃变性30 s,48 ℃退火30 s,72 ℃延伸2 min,共40个循环,最后完成72 ℃总延伸5 min,每组各取5 μl PCR产物电泳,凝胶成像仪获取图像,2-△△CT对样本基因进行表达差异相对定量分析。
1.4.3 Western blot检测大鼠RhoA、ROCK2、MLC、MLCP蛋白表达 按说明书提取各组大鼠海马组织蛋白,用BCA试剂盒测定并调整每个样本蛋白浓度之后上样,连接电泳装置及电源,电压设为120 V恒压,1.5 h后停止电泳;用封闭液(含5%脱脂奶粉的PBST溶液)室温封闭膜2 h,用新配制的封闭液稀释抗体4 ℃孕育过夜;用封闭液稀释各蛋白一抗对应的二抗,室温下孵育膜1 h,用PBST洗膜用于图像采集;加ECL工作液,在凝胶成像仪下曝光成像,采用凝胶成像分析系统进行图像分析,获取各组Western blot条带的平均光密度(OD)值,内参为β-actin,目的蛋白与内参光密度比值即为目的蛋白的相对值。
1.4.4 透射电镜观察海马病理变化 大鼠经10%水合氯醛腹腔注射麻醉后,迅速取出脑组织,取2 mm×2 mm×2 mm大小的右侧海马CA1区组织1块,置于2.5%戊二醛预固定然后入1%锇酸继续固定,经70%、80%、95%乙醇、无水丙酮脱水、环氧树脂Epon812浸透和包埋,全自动石蜡切片机超薄切片,厚度约4 μm,3%醋酸铀-枸橼酸铅双染色,透射电子显微镜观察海马组织的结构变化。
2 结 果
2.1 行为学检测 组间比较,术前各组大鼠潜伏期及跨越平台次数比较,差异无统计学意义(P>0.05);术后1 w,模型组、阴性对照组与ROCK2干扰组之间比较差异无统计学意义(P>0.05),与假手术组比较有显著性差异(P<0.01或0.05);术后4 w,与模型组比较,ROCK2干扰组潜伏期缩短、跨越平台次数显著增加(P<0.05),阴性对照组潜伏期时间与跨越平台次数较模型组差异无统计学意义(P>0.05)(见表1)。
2.2 各组大鼠RhoA/ROCK2通路相关基因mRNA表达的变化 实时荧光定量PCR结果显示,与假手术组比较,模型组及阴性对照组RhoA、ROCK2、MLC、MLCP mRNA表达量明显升高(P<0.01);与模型组比较,ROCK2干扰组RhoA、ROCK2、MLC、MLCP表达量mRNA含量显著下降(P<0.05),模型组与阴性比较四者的mRNA表达量无明显变化(P>0.05)(见表2)。
2.3 各组大鼠RhoA、ROCK2、MLC、MLCP蛋白的表达变化 Western blot检测结果表明,与假手术组比较,模型组及阴性对照组RhoA、ROCK2、MLC、MLCP蛋白表达水平明显升高(P<0.05);与模型组比较,ROCK2干扰组四者表达显著下降(P<0.05);模型组与阴性对照组比较四者的蛋白表达量无明显变化(P>0.05)(见表3、图1)。
2.4 电镜观察大鼠海马区超微结构变化 如图2所示,假手术组突触结构正常且清晰,突触前膜有大量球形突触小泡,可见清晰的线粒体,突触间隙宽度及形态正常,突触后膜厚度正常且均匀;模型组与阴性对照组突触形态结构不完整,细胞器结构不清晰,突触小泡分布零散且形态模糊;ROCK2干扰组突触结构清晰,前膜和后膜形态正常,可见清晰的线粒体结构,突触间隙宽度正常(见图2)。
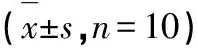
表1 各组大鼠Morris水迷宫行为学检测比较
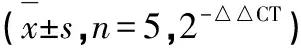
表2 各组大鼠RhoA/ROCK2通路相关基因mRNA表达的变化
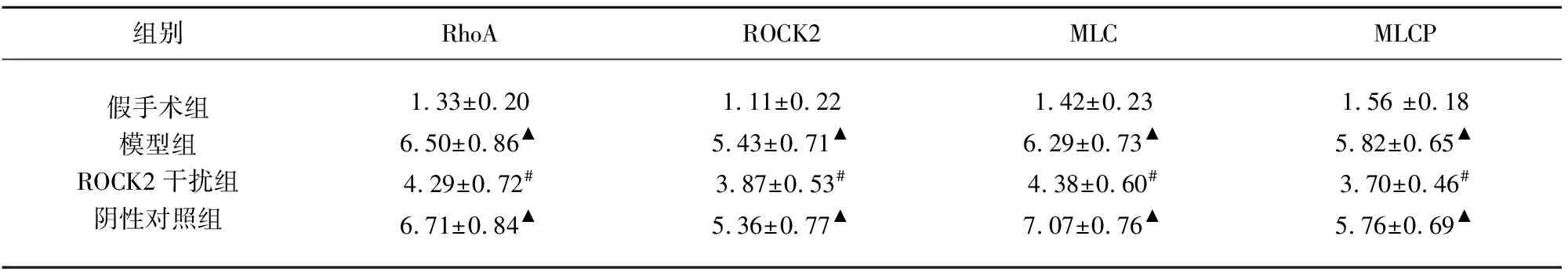
表3 各组大鼠RhoA/ROCK2通路相关蛋白OD值的表达水平比较(n=5)
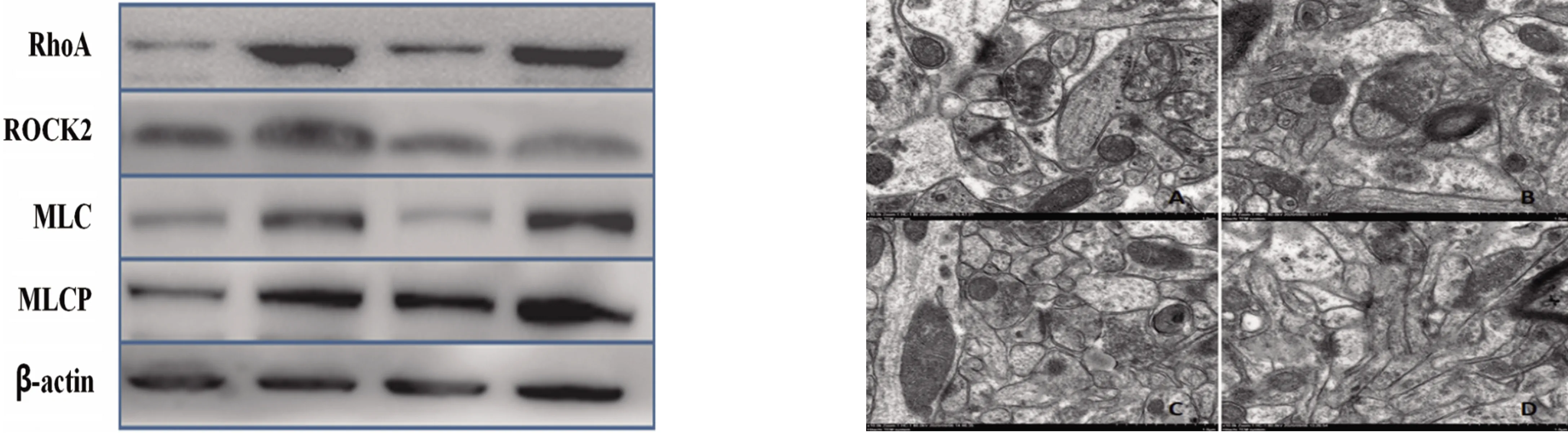
(1~4道分别代表假手术组、模型组、ROCK2干扰组、阴性对照组) (×10000,A:假手术组;B:模型组;C:ROCK2干扰组;D:阴性对照组)
3 讨 论
RhoA/ROCK信号通路被称为肌动蛋白细胞骨架的调节器,也是细胞形态异质性的调节器[8]。在神经发育过程中,Rho/ROCK信号通路参与轴突生长及轴突生长抑制因子到生长锥的肌动蛋白细胞骨架信号换能过程[9,10],在传导髓磷脂相关抑制因子引起肌动蛋白细胞骨架重组、生长锥塌陷及抑制神经突起延伸过程中起着关键作用,已成为神经损伤发生的重要病理机制[11]。激活后的RhoA/ROCK2可以影响许多生物学行为,包括细胞骨架的组装、转录因子的激活、细胞周期的调节等,在中枢神经系统中参与调节突触可塑性,而抑制Rho/ROCK信号通路可促进轴突再生及神经功能恢复[12]。
肌球蛋白轻链(myosin light chain,MLC)是Rho激酶(ROCK2)下游底物之一,其表达与突触再生密切相关。细胞内的MLC磷酸化水平对调节突出再生起到重要作用,在肌球蛋白轻链激酶和肌球蛋白轻链磷酸酶(myosin light chain phosphatase,MLCP)双重调节下,MLC发生磷酸化和去磷酸化的相互转化[13]。
研究已证实,过表达的MLC可增加与肌动蛋白丝交联产生的收缩力,最终造成细胞骨架的重排和轴突生长的抑制,导致生长锥塌陷、回缩,抑制轴突生长[12]。抑制Rho/ROCK通路可减少MLCP的肌球蛋白结合亚单位,降低MLCP的磷酸酶活性,减少MLC磷酸基团的水解;换言之,抑制RhoA/ROCK2可改善细胞骨架重排、促进轴突生长,这可能成为治疗VaD的新靶标。因此,本研究通过检测VaD大鼠海马RhoA/ROCK2通路及下游MLC、MLCP的表达情况,证实沉默ROCK2表达可导致海马组织中RhoA、ROCK2、MLC、MLCP的表达显著下调,从而起到神经保护作用。国内陈玲丽通过制作氟致小鼠智力损伤模型,得出相似的研究结果[14]。
通过本实验研究,我们认为具有较高的安全性、低免疫原性、可持续表达等特性腺相关病毒(AAV)载体[15]转染的ROCK2抑制剂可能通过抑制Rho/ROCK信号通路及其下游分子的传导,进一步促进轴突的生长及神经元的修复,从而改善智能,其机制值得进一步探索。
