急性脑梗死患者的脂肪酸代谢组学相关性分析
2021-03-09田步先
唐 诗, 田步先
脑卒中在全球发病率位居第三,死亡率位居第二,其中急性脑梗死占69.6%~70.8%[1]。脑梗死是由于多种原因导致脑部血管发生阻塞,使血管内血流被阻断或减少,导致阻塞部位脑细胞迅速死亡而引起神经功能障碍的一种疾病。脑梗死导致的缺血性病理生理改变并非完全不可逆。如果可以及时恢复受损脑组织部位的血流,则缺血半暗带区域神经细胞的功能可以得到部分恢复。
脂质组学(Lipidomics)由Han等人于2003年首次提出,其系统分析生物体中脂质代谢物质的变化特征,以及脂质介导的信号通路,为探讨疾病的发病机制提供一种新方法[2]。脂质组学已经广泛应用于动脉粥样硬化[3]、糖尿病[4]、阿尔兹海默[5]、肿瘤[6]等多种疾病的诊断及治疗中。目前,基于脂质组学探讨急性脑梗死发病与血浆游离脂肪酸(FFA)代谢物变化的相关文献较少。本文采用串联质谱技术分析脑梗死组和对照组的脂质代谢谱,筛选两组间的差异性FFA代谢物,尽可能为以后探讨脑梗死发病机制提供一种新思路。
1 资料与方法
1.1 一般资料 此研究中选择2019年10月-2021年1月在锦州医科大学附属第一医院神经内科住院的260例急性脑梗死患者为研究组,体检中心非脑血管病志愿者200例为对照组。对照组与脑梗死组的年龄及性别尽量相匹配,减少其他因素对脂质代谢组学分析所造成的误差。研究组入选标准:参照《中国急性缺血性脑卒中诊治指南2018年》[1](1)患者具有神经功能缺损症状或体征;(2)症状或体征时间不超过2 w;(3)头部CT或DWI影像学检查显示新发责任病灶。对照组纳入标准:(1)无神经功能缺损症状或体征;(2)头部CT检查排除新发梗死病灶及其他颅内器质性病变。排除标准:(1)心、肝、肾等重要脏器功能严重衰竭者;(2)糖尿病、甲状腺疾病、高尿酸血症、痛风等代谢性疾病;(3)恶性肿瘤及自身免疫性疾病者。此研究通过医院伦理委员会审批,所有研究对象均签署知情同意书。
1.2 研究方法 所有研究对象在空腹8 h后,由医务人员经由肘窝静脉采取静脉血浆样本(肝素锂抗凝),2 h之内进行离心(3000 r,10 min),取上清液置于EP管内,-80 ℃冷冻保持,送至我院遗传代谢中心进行串联质谱检测,检测方法可见参考文献[7],共测得25个游离脂肪酸代谢物指标。
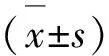
2 结 果
2.1 临床资料分析 本研究纳入了460例研究对象,其中研究组260例,对照组200例。研究组与对照组在年龄、性别、高血压、冠心病、吸烟及饮酒史方面无明显差异性(见表1)。
2.2 正交偏最小二乘法(OPLS-DA) 应用多元分析OPLA-DA法对两组进行模式判别分析,并建立散点图(见图1)。从散点图可以看出研究组与对照组之间分离比较明显,得到R2X=0.449、R2Y=0.68、Q2=0.657,R2Y与Q2(cum)之间差值<0.3,同时Q2>0.5,提示模型的解释和预测能力较强。经200次Permutation置换检验(见图2),得出截距:R2(0.0,0.0241),Q2(0.0,-0.0851),Q2回归曲线与y轴截距<0,说明OPLS-DA模型不存在过拟合现象。
2.3 差异代谢物的筛选 筛选血浆中25个游离脂肪酸代谢物。VIP值可以用于筛选对模型贡献较大的变量。ROC曲线可以评估代谢物的鉴别能力、灵敏度和特异性。AUC值(ROC曲线下面积)可以评估潜在代谢物预测疾病的能力,AUC值越接近1其诊断能力越高,AUC>0.7表示具有中等及以上的诊断价值。经分析筛选获得10个同时满足VIP>1.0、AUC>0.7、P<0.01条件的代谢物(见表2)。
2.4 Logistic回归分析与验证
2.4.1 Logistic回归分析 对上述所筛选出的10个FFA代谢物进行二元Logistic回归分析(见表3)。结果示棕榈酸(PA)、硬脂酸(SA)、亚油酸(LA)、油酸(OA)、花生四烯酸(AA)是两组间显著差异性代谢物(P<0.05)。据此建立回归方程Y=14.54-0.001*PA-0.004*SA-0.001*LA-0.001*OA-0.002*AA,该方程可作为预测脑梗死发生概率的模型。根据此回归方程,得出综合性指标W。上述5个FFA代谢物与综合性指标W在两组间的表达差异见小提琴图(见图3)。

表1 研究对象一般临床资料

表2 筛选两组主要差异代谢物
2.4.2 验证模型预测能力准确性 应用ROC曲线验证模型的准确性(见图4)。筛选出来的5种FFA代谢物的AUC值均大于0.7,综合指标W的AUC值为0.917,说明该模型预测脑梗死的能力较高,并且多种代谢指标结合会提高预测的准确性。
表3 二元Logistic回归分析中的变量
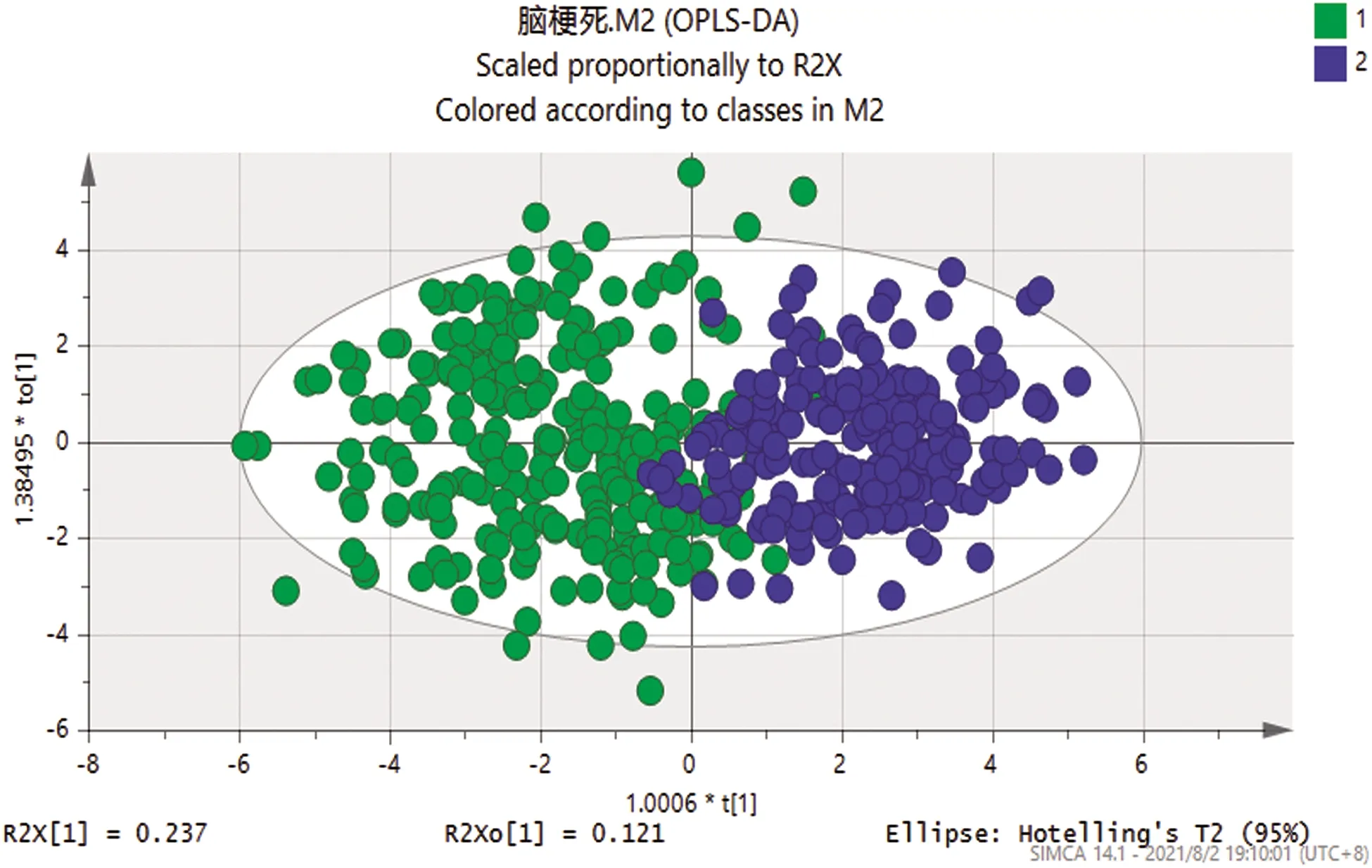
图1 OPLS-DA散点图(1:研究组:绿色;2:对照组:蓝色)
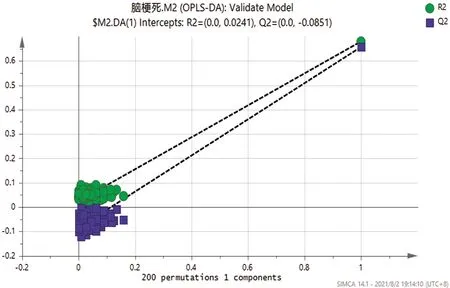
图2 Permutation检验(1:研究组:绿色;2:对照组:蓝色)
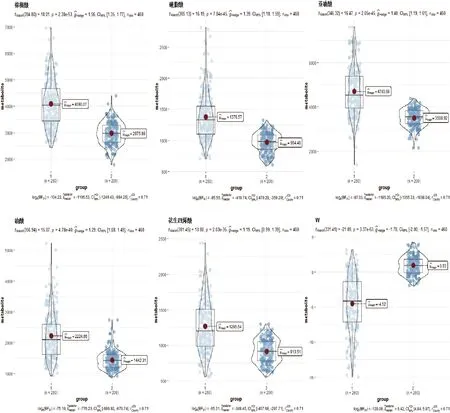
图3 小提琴图。其中每一个点代表一个统计量,中心红点代表该项代谢物的中位数

图4 ROC曲线图
3 讨 论
脑卒中的发病率及死亡率在全球一直居高不下,及时有效的治疗十分有必要。随着串联质谱技术的快速发展,小分子代谢物的精确检测逐渐成为可能。本研究利用串联质谱技术,对游离脂肪酸谱代谢物进行分析,寻找脑梗死组和对照组之间的代谢差异。
本研究对血浆FFA代谢物进行分析筛选,发现5个FFA代谢物与急性脑梗死具有一定相关性。与对照组相比,脑梗死组中棕榈酸、硬脂酸、亚油酸、油酸、花生四烯酸含量显著升高,差异有统计学意义(P<0.05)。
FFA是人体代谢过程重要的能源物质之一,其含量与心脑血管疾病有着密切地联系。神经细胞对缺血缺氧十分敏感,当脑组织缺血缺氧时,葡萄糖氧化磷酸化障碍,ATP合成减少,机体通过分解脂肪酸来调节能量[8]。在本研究中,脑梗死组中棕榈酸、硬脂酸、亚油酸、油酸、花生四烯酸增加,可能与疾病急性期维持能量稳态,脂肪酸分解代谢的增加有关。
动脉硬化是可以累及全身动脉导致血管疾病的慢性炎症性疾病。颈动脉硬化不仅是脑梗死主要危险因素,也是疾病复发的危险因素。Vorkas PA等研究发现[9],花生四烯酸在有局灶性神经症状的颈动脉斑块组的小鼠血浆中较无症状组含量显著升高,具有较好的预测卒中风险能力。花生四烯酸可以增加低密度脂蛋白(LDL)对氧化的敏感性[10],还可以通过激活、聚集血小板,形成微血栓[11]。马阳阳等人[12]发现硬脂酸在大动脉粥样硬化型(LAA)中水平明显升高,且与LDL呈正相关,原因可能与其增加LDL的浓度,促进动脉硬化的形成有关。巨噬细胞内脂质沉积是动脉粥样斑块形成的关键步骤,过多的脂质沉积可以增加氧化应激和炎症反应,损伤脑细胞。棕榈酸可以增加FABP-4和DGAT蛋白的表达,减低CPT-1表达,导致巨噬细胞内脂质沉积增多,加速脑梗死的发生[13]。本研究结果表明,硬脂酸和棕榈酸在脑梗死患者血浆中含量明显升高,其原因可能与其参与了动脉硬化的发生与发展过程相关。此外硬脂酸还可以激活凝血因子Ⅶ促进血栓的形成[14]。
高血压与血管内皮细胞功能障碍在动脉硬化的发生发展进程中相辅相成。NO具有调节血管内皮舒张的功能,在控制血压方面发挥重要作用。FFA可以通过抑制内皮细胞Ca2+和一氧化碳合酶,导致一氧化碳(NO)合成减少[15]。Lu Yihong等发现[16],在自发性高血压的小鼠血浆中油酸、亚油酸和十六烷酸等FFA的水平随着血压的增高而升高,容易诱发脑血管疾病。本研究结果示脑梗死组血浆中亚油酸和油酸水平升高,其机制可能与脂肪酸代谢异常有关,使得血管舒张功能障碍和内皮细胞受损,导致脑梗死的发生。此外,油酸和亚油酸属不饱和脂肪酸,其分子结构中含有易被氧化的双键,可以导致氧化应激损伤,破坏脑细胞结构与功能。Xin Wang等研究发现[17],脑梗死患者血浆中的亚油酸、油酸、DHA等多种FFA的水平升高。研究结果与本研究基本一致。但Shuai Yuan等研究得出亚油酸和油酸与大动脉型卒中呈负相关,花生四烯酸和硬脂酸呈正相关[18]。该项研究结论与本研究不尽相同,具体的机制还需更深层次研究。另外,C16∶0、C18∶0、C18∶1和C18∶2水平在脑缺血再灌注的小鼠血浆中明显升高,亚油酸代谢途径变化较为显著,因此控制亚油酸的水平可以预防及治疗缺血再灌注损伤[19]。FFA代谢异常与卒中后抑郁的发生也具有一定相关性,棕榈酸、亚油酸、油酸等7代谢物在脑卒中后抑郁的患者血浆中明显升高,这可能与卒中后期患者发生失代偿改变有关[20]。
基于本文的研究,我们发现棕榈酸、硬脂酸、亚油酸、油酸、花生四烯酸可作为急性脑梗死的潜在生物标志物,并建立了预测能力良好的判别模型,这将为探讨急性脑梗死疾病的发病机制提供了一些参考信息。本研究为单中心临床研究,有很多局限性。研究中存在其他不可控因素可能导致个体代谢差异,因此同一患者疾病前后血浆样本纵向分析十分必要。此外,本研究样本量相对较小,尚未将全部脂质代谢物纳入研究,还需扩大样本进一步完善与优化试验。
