基于Nrf2/ARE信号通路探讨血清AHSG、AQP1TIMP-1与急性脑梗死进展及复发的关系
2021-03-09刘建红李珍珍刘江红
刘建红, 李珍珍, 刘江红
流行病学调查显示[1],脑梗死的发病率呈现逐年上升的趋势,同时疾病的发病年龄呈现显著的年轻化趋势。在疾病的进展中[2],粥样硬化、动脉血管狭窄均是造成疾病进展的重要原因。同时,脑梗死患者较高的致残率以及致死率,已经成为临床影响患者生命质量的疾病之一[3]。胎球蛋白A(fetuin-A,AHSG)是由肝脏分泌的糖球蛋白,通过对患者胰岛素受体磷酸化的显著抑制,进而导致患者的胰岛素抵抗,在心脑血管局部病灶部位的炎性反应以及氧化应激反应中发挥重要作用[4]。
水通道蛋白1(aquaporin 1,AQP1)是脑血流灌注的重要指标。金属蛋白酶组织抑制因子1(tissue inhibitor of metalloprot Einase-1,TIMP-1)在一定程度上反映了患者的脑组织的纤维化程度[5]。核因子E2相关因子2(uclear factor ervthroid 2 related factor 2,Nrf2)与抗氧化反应元件(antioxidant response element,ARE)反映了机体的局部病灶部位的神经细胞的凋亡情况[6],本研究主要通过探讨血清AHSG、AQP1、TIMP-1与急性脑梗死进展及复发的关系进行分析,为临床诊断以及治疗效果进行分析。
1 资料与方法
1.1 临床资料 本研究采取前瞻性研究,以2017年1月-2019年12月在本院进行治疗的老年脑梗死患者120例作为研究对象,其中男性患者50例,女性患者70例,年龄在65~75岁,平均年龄为(66.55±2.57)岁,体重指数平均为(24.56±2.52)kg/m2,高血压患者59例,糖尿病患者41例,血脂异常患者43例,根据美国国立卫生研究院卒中量表(NIHSS)评分,NIHSS评分在5分以下则为轻度;5~15分则为中度;15分以上为重度。轻度患者32例,中度患者46例,重度患者42例,另选取同期进行健康体检的患者120例作为对照组,两组的性别、年龄以及体重指数之间的差异不存在统计学意义(P>0.05)(见表1)。所有患者均签署知情同意书,并经伦理委员会论证通过。纳入标准:(1)所有患者均符合脑梗死诊断标准[7];(2)所有患者均由CT或磁共振检查确诊为脑梗死;(3)所有患者从发病到入院时间均小于12 h;(4)所有患者脑梗死前均无认知障碍。排除标准:(1)经CT或核磁检查诊断为出血性脑梗死患者或脑出血患者;(2)大面积梗死患者;(3)颅内感染或者肿瘤患者;(4)对本研究药物过敏或者不耐受患者。
1.2 研究方法 所有研究对象入组后均进行静脉采血4 ml,3500 r/min离心15 min后,取上清液,采用酶联免疫法对患者的血清进行AHSG、AQP1、TIMP-1水平检测。
分别对以上样本采用免疫组化法以1∶100的浓度对Nrf2、ARE抗体进行滴加,在4 ℃下进行孵育过夜,采用多聚物酶标二抗进行滴加后,在37 ℃下继续孵育45 min,采用DAB进行显色,苏木精进行复染。细胞浆内出现棕黄色或棕褐色颗粒物即为Nrf2、ARE阳性。采用染色强度以及阳性细胞的二级计数法Nrf2、ARE进行评分,无染色则为0分;淡黄色则为1分;黄褐色则为2分;深褐色则为3分。阳性细胞数目比例为10%则为0分;10%~25%则为1分;26%~50%则为2分;51%~100%则为3分。染色强度以及染色比例的评分乘积可作为以上蛋白表达程度的评价依据,6分以下则为低表达;6分及6分以上则为高表达。
1.3 观察指标
1.3.1 两组研究对象的AHSG、AQP1、TIMP-1、Nrf2、ARE水平 分别对观察组以及对照组的AHSG、AQP1、TIMP-1、Nrf2、ARE水平进行比较。
1.3.2 不同严重程度患者的AHSG、AQP1、TIMP-1、Nrf2、ARE水平比较 分别对轻度、中度以及重度患者的AHSG、AQP1、TIMP-1、Nrf2、ARE水平比较。
1.3.3 不同复发情况患者的AHSG、AQP1、TIMP-1、Nrf2、ARE水平比较 分别对所有患者开展为期1 y的随访,以患者发生脑梗复发作为研究的终点事件,比较复发组以及非复发组患者的AHSG、AQP1、TIMP-1、Nrf2、ARE水平进行比较。
1.3.4 相关性分析 采用Spearman相关性分析,研究AHSG、AQP1、TIMP-1、Nrf2、ARE与疾病严重程度以及复发情况的相关性。
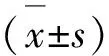

表1 两组患者一般资料比较
2 结 果
2.1 两组研究对象的AHSG、AQP1、TIMP-1、Nrf2、ARE水平比较 观察组患者的AHSG(t=79.456,P<0.001)、AQP1(t=25.668,P<0.001)、TIMP-1(t=29.429,P<0.001)、Nrf2(t=24.583,P<0.001)、ARE(t=88.561,P<0.001)水平显著高于对照组(见表2)。
2.2 不同严重程度患者的AHSG、AQP1、TIMP-1、Nrf2、ARE水平比较 不同严重程度患者的AHSG(F=4.171,P<0.001)、AQP1(F=15.482,P<0.001)、TIMP-1(F=48.098,P<0.001)、Nrf2(F=12.063,P<0.001)、ARE(F=11.022,P<0.001)水平之间差异存在统计学意义;通过两两比较,不同严重程度患者的AHSG、AQP1、TIMP-1、Nrf2、ARE水平之间差异存在统计学意义(见表3)。
2.3 不同复发情况患者的AHSG、AQP1、TIMP-1、Nrf2、ARE水平比较 复发组患者的AHSG(t=69.316,P<0.001)、AQP1(t=9.779,P<0.001)、TIMP-1(t=23.197,P<0.001)、Nrf2(t=5.972,P<0.001)、ARE(t=11.436,P<0.001)水平显著高于非复发组(见表4)。
2.4 相关性分析 通过相关性分析,脑梗死患者的疾病严重程度与复发情况与AHSG、AQP1、TIMP-1、Nrf2、ARE水平呈现正相关(见表5)。
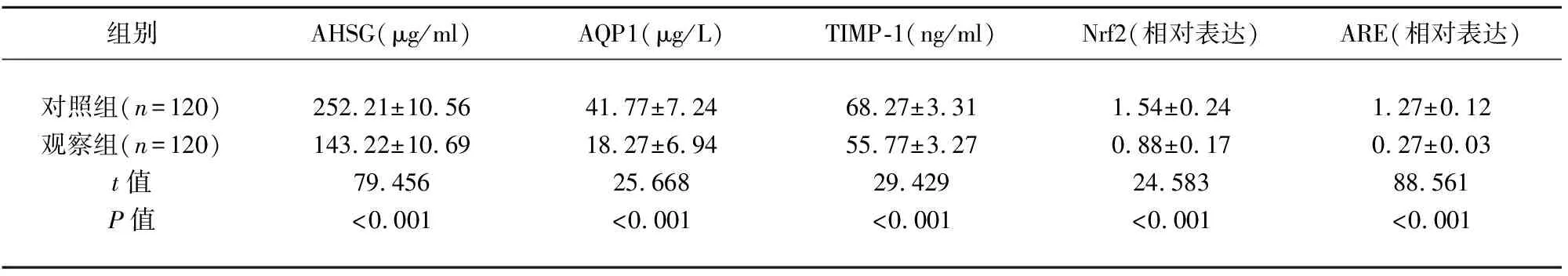
表2 两组研究对象的AHSG、AQP1、TIMP-1、Nrf2、ARE水平比较
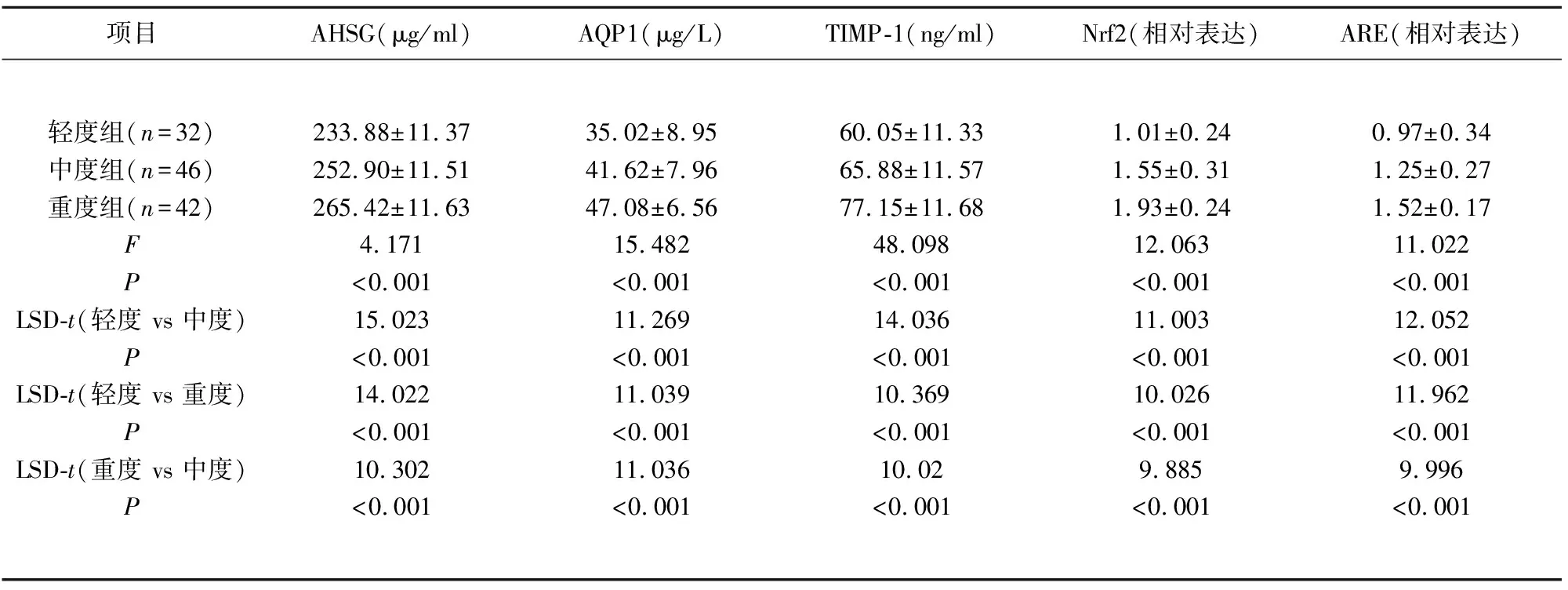
表3 不同严重程度患者的AHSG、AQP1、TIMP-1、Nrf2、ARE水平比较
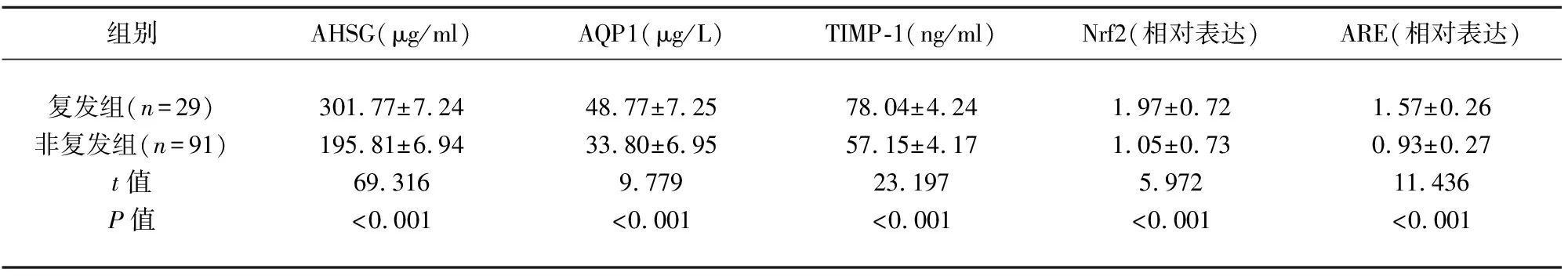
表4 不同复发情况患者的AHSG、AQP1、TIMP-1、Nrf2、ARE水平比较
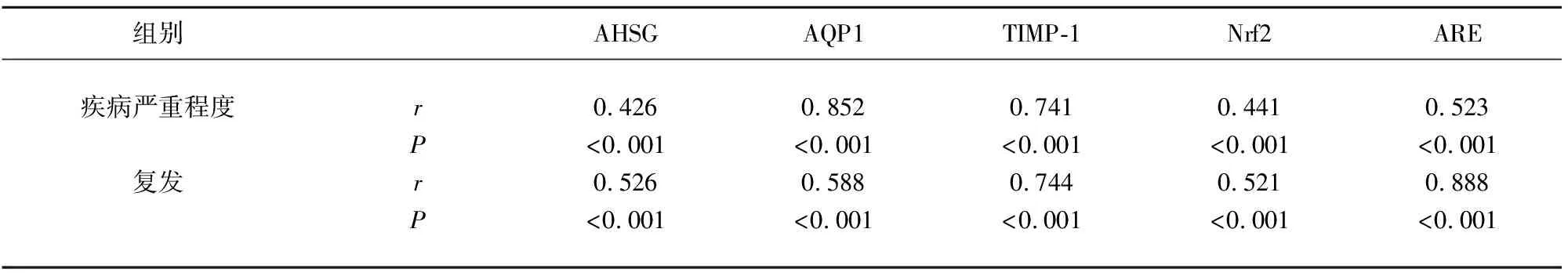
表5 相关性分析
3 讨 论
脑梗死是临床较为常见的神经系统疾病之一,主要是由于大脑的血管闭塞造成局部脑组织的缺血以及氧气的供应不足[8],进而引起一系列的神经细胞凋亡、脑组织损伤以及炎性反应[9]。而在其疾病的进展过程中往往造成患者的神经功能障碍,其较高的发病率以及致残率、致死率已经成为临床严重影响患者生命质量的疾病之一[10]。目前对于脑梗死的危险因素的研究较多,但是在实际的诊断过程中,由于多种因素对于脑梗死的预测价值不一,其稳定性不佳,所以在临床中寻找稳定性较强的指标,进一步对患者的诊断进行预测,对于患者的预后具有积极的意义[11]。
AHSG主要在患者的肝脏进行合成,通过对AHSG的分泌量的增加,在一定程度上降低机体的糖代谢水平,同时肝脏对于葡萄糖的摄取能力以及利用效能显著降低,同时脑组织对于糖分以及氧气的摄取的能力显著下降,进一步造成脑组织的损伤。同时也有研究报道显示,AHSG可通过对患者的胰岛素抵抗的调控作用,进一步对患者的受损脑组织的损伤。在本研究中,随着疾病的进展,患者的AHSG水平显著升高,同时AHSG水平与疾病的复发呈现显著的相关性。范磊等[12]通过对脑梗死患者的AHSG水平分析,随着患者的疾病进展,AHSG水平呈现显著的上升趋势,与本研究结果一致。TIMP-1与脑部损伤组织纤维化的进程有明显的相关性[13],在脑梗死的疾病状态下,脑组织的损伤后的修复处于较为活跃的状态,而在此过程中,患者的TIMP-1水平呈现显著的上升的趋势。而在炎性反应水平的分析,随着疾病的进展,患者的Nrf2、ARE呈现显著的上升趋势。有研究报道显示[14],Nrf2/ARE是机体氧化应激反应的重要指标,在疾病的进展中,随着局部氧化应激反应水平的显著升高,Nrf2向机体的细胞核中进行移动,进一步对机体的NO水平进行有效调控,随着机体的损伤的加重,大量的活性氧被Nrf2进行攻击以及偶联,并向机体的血清内大量释放ARE,所以随着疾病的进展,患者的Nrf2、ARE呈现显著的升高趋势。而在对患者的AQP1水平的分析中,随着疾病的进展,患者的AQP1呈现显著的升高趋势。在损伤的脑组织中,局部病灶部位的血管的破坏,大量的新生血管以及神经元细胞进行恢复,患者的AQP1呈现显著的上升趋势。安宏娜等[15]在对急性脑梗死患者的脑水肿与AQP1水平的相关性分析中,患者的AQP1与脑水肿的疾病进展呈现显著的相关性,与本研究结果一致。
但是本研究还存在一定的局限性,由于纳入研究的样本量较低,在临床的推广存在局限性,有待在日后的大样本研究中进行验证。
综上所述,在脑梗死疾病的进展以及复发中,通过对Nrf2/ARE信号通路的调控作用,血清AHSG、AQP1、TIMP-1水平呈现显著的上升趋势。
