布里亚特顿金斯克区发酵乳制品中乳酸菌分离鉴定
2021-03-08党娜刘逸群武岳史迪刘文俊孙天松
党娜,刘逸群,武岳,史迪,刘文俊,孙天松
(内蒙古农业大学乳品生物技术与工程教育部重点实验室呼和浩特010018)
0 引 言
每个国家与民族都有独具特色的传统发酵乳制品,俄罗斯布里亚特地区传统发酵乳制品的品种丰富,味道鲜美,深受其它国家的喜爱[1-2]。传统发酵乳制品的制作早已经历了几千年的传承,再加上工艺条件、环境、地理因素等的不同,使其成为了蕴涵复杂乳酸菌资源的优良载体[3-4]。乳酸菌等多种微生物对乳制品的口味、质地、营养特性和储藏特性具有很大程度的影响[5-7]。此外,乳酸菌可以改善胃肠功能、增强免疫力、缓解过敏、降血脂等[8-9]。本文对布里亚特共和国顿金斯克区发酵乳制品中乳酸菌的组成与种类进行研究,不仅可以为传统发酵乳制品中乳酸菌多样性研究提供原始数据,而且能够丰富我国的乳酸菌菌库,同时为优良乳酸菌筛选与工业应用提供菌株资源。
1 实 验
1.1 材料
1.1.1 样品来源及采集
本研究所用8份样品于2016年9月采集,采集样品信息如表1所示。用无菌勺将样品放入无菌螺口采样管(0.5 g,M淀粉∶MCaCO3=50∶1),写好样品号立即放置在低温保存,尽快将样品运回实验室[10]。

表1 俄罗斯布里亚特共和国顿金斯克区采集样品信息
1.1.2 试剂与仪器
CM1175,M.R.S.BRO TH和 CM1163,M.R.S.AGAR,英国OXO ID公司。提取基因组DN A、16S rRNA基因的PCR扩增、电泳检测用的缓冲液和试剂参考文献[11]。仪器设备及厂家信息参考文献[12]。
1.2 方法
1.2.1 乳酸菌计数及分离纯化
10倍稀释法进行梯度稀释,乳酸菌计数和分离分别采用倾注法、涂布法[13]。计数板和涂布板培养条件:37℃,厌氧,48 h。计数板进行计数;从涂布板上挑选出菌落形态明显不同的单菌落,并记录其菌落形态,如颜色、形状、大小等,划线纯化培养物[14]。经革兰氏染色,过氧化氢酶触试验,将疑似乳酸菌的纯培养物进行保藏,以待后续试验[15]。
1.2.2 基因组DNA提取及16S rRNA基因的PCR扩增
提取菌株基因组DNA试剂盒:TIAN am pBacteria DNA Kit(北京天根生化科技有限公司)。
PCR扩增体系:DN A tem p late(100 ng/μL)2μL,10×Bu ffer(Mg2+)5μL,d N TPs(2.5 mm o l/L)4μL,DNA r-Taq enzym e(5 U/μL)0.5μL,FA-27F(10mm ol/L)1.5μL,RA-1495R(10 mm o l/L)1.5μL,三蒸水35.5μL[16]。前后引物为通用引物,参考文献[17]。
PCR扩增条件:首先94℃预变性5 min;然后94℃变性1 min,58℃退火1 min,72℃延伸2 min(30个循环);最后72℃末端延伸10min[18]。
1.2.3 16S rRNA序列测定、同源性比对和系统发育树的构建
PCR产物双向测序(上海桑尼生物技术有限公司),首先用SepMan(DNAStar 6.1)软件整理、拼接、校准序列。然后把同源性大于99%作为种的鉴定阈值,用BLAST软件(http://blast.ncbi.n lm.nih.gov/Blast.cgi)在数据库(GenBank/EMBL/DDBJ)进行同源性比对[19]。最后用Mega 6.0软件构建系统发育树[20-21]。
2 结果与分析
2.1 乳酸菌计数及分离结果
由表2可知,奶酪样品中乳酸菌数(对数值)为(7.07±0.02)m L-1及(8.01±0.08)m L-1,结果与Bao Q iuhua对四川曲拉及甘肃牦牛乳曲拉(曲拉与奶酪生产工艺相似)计数结果相近,平均乳酸菌数为(7.18±1.49)m L-1[14]及(7.9±0.89)m L-1[22]。乳清样品中乳酸菌数在7.75~7.89 m L-1之间。酸牛奶及发酵乳饮料样品活菌数在6.88~8.90 m L-1之间,满足新酸奶国家标准。所有样品的活菌数都处于106m L-1以上,满足国家卫生标准,也达到了酸奶国家标准。
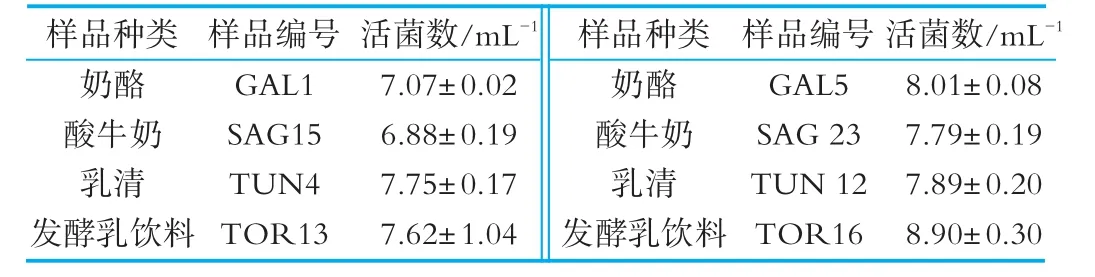
表2 俄罗斯布里亚特共和国顿金斯克区样品中乳酸菌的计数结果(对数值)
根据菌落的形态特征、革兰氏染色和过氧化氢酶试验,初步将50株菌定为乳酸菌。在涂布板上菌落形状呈圆形、大小中等,中心凸起,颜色为白色或乳白色,边缘整齐,表面有的光滑,有的粗糙。
2.2 菌株DNA提取及16S rRNA基因扩增结果
所有菌株DN A的OD 260/280值均在1.8~2.0之间,为纯的DNA。将提取的DNA浓度稀释至100 ng/μL进行16S rRNA基因扩增。扩增产物用1.0%AGE(琼脂糖凝胶电泳)检测之后,能看到在大约1 500 bp位置处有条清晰明亮的条带且无弥散现象,如图1。
图1 部分分离株16S rDNA的PCR产物凝胶电泳图
2.3 系统发育树的构建及乳酸菌鉴定结果
由图2可知,菌株BL4-11与模式株Pediococcus acidilactici DSMZ 20284T聚为一类,同源性为99%,故将其鉴定为Pediococcus acidilactici。菌株BL1-6与模式株Pediococcus pentosaceus ATCC 33316T聚为一类且同源性高达100%,将其鉴定为Pediococcus pentosaceus。菌株BL12-8与模式株Lactobacillus plantarum ATCC 14917T聚为一类且同源性为100%,故将其鉴定为Lactobacillus plantarum。菌株BL16-2与模式株Lactobacillus paracasei ATCC 25302T聚为一类且同源性为100%,将其鉴定为Lactobacillus paracasei。菌株BL23-9-1与模式株Leuconostocmesenteroides JCM6124T聚为一类且同源性为100%,将其鉴定为Leuconostoc mesenteroides。菌株BL13-10与模式株Streptococcus thermophilus ATCC 19258T聚为一类且同源性为100%,将其鉴定为Streptococcus thermophilus。菌株BL15-2与模式株Lactococcus lactis ATCC 19435T聚为一类且同源性为100%,将其鉴定为Lactococcus lactis。菌株BL15-12与模式株Enterococcus italicus DSM15952T聚为一类且同源性为100%,故将其鉴定为Enterococcus italicus。菌株BL13-1与模式株Enterococcus faecalis NBRC 100480T聚为一类且同源性为100%,将其鉴定为Enterococcus faecalis。菌株BL5-1-1与模式株Enterococcus durans NBRC 100479T聚为一类且同源性为100%,将其鉴定为Enterococcus durans。菌株BL5-2与模式株Enterococcus faecium NBRC 100485T聚为一类且同源性为100%,因此将其鉴定为Enterococcus faecium。
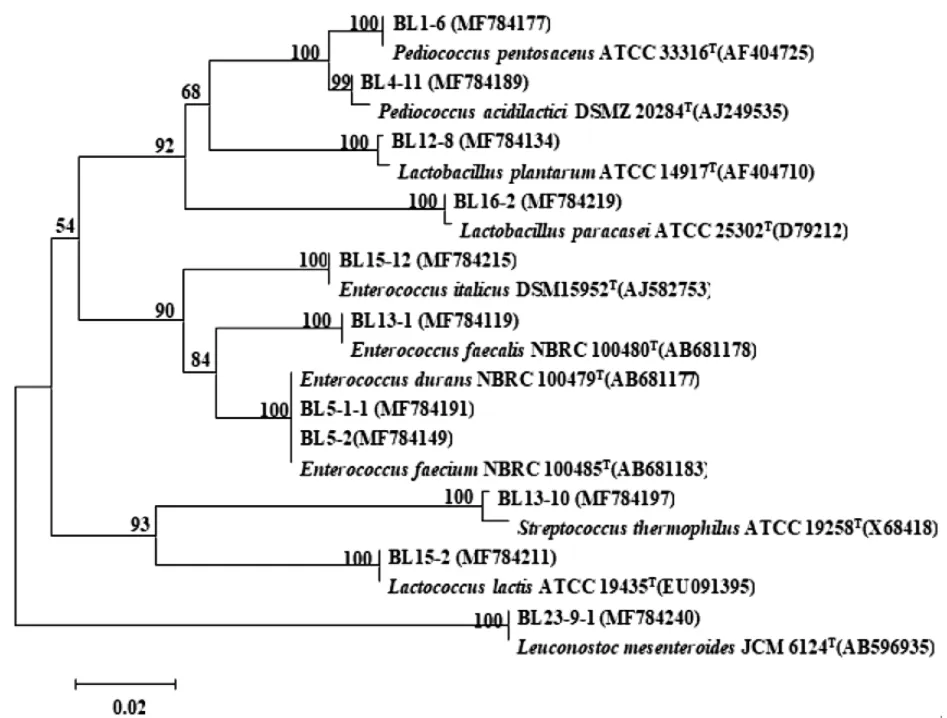
图2 布里亚特共和国顿金斯克区部分菌株的16S rDNA序列的系统发育树
2.4 优势菌种分析
布里亚特共和国顿金斯克区传统乳制品中乳酸菌的分离结果如表3所示。除了奶酪1(GAL1)以外,所有的样品均分离到Lactococcus lactis,占总分离株的40%,为布里亚特共和国顿金斯克区传统发酵乳制品的优势菌种。其次乳清4和乳清12(TUN 4和TUN 12)中均分离到Lactobacillus plantarum,共7株,占总分离株的14%,为布里亚特共和国顿金斯克区乳清的优势菌。奶酪1(GAL1)、乳清4(TUN 4)、发酵乳饮料13(TOR 13)分离的菌种类别最多,都有5种。由于本次采样酸牛奶23(SAG 23)采样量较少且未进行全面采样,因此其分离的菌种类别和数量会比较少,在今后的研究中需进行改善。综上所述,布里亚特共和国顿金斯克区发酵乳制品的优势种为Lactococcus lactis,占总分离株的40%。

表3 布里亚特共和国顿金斯克区传统乳制品中乳酸菌的分离结果
3 讨 论
本文对俄罗斯布里亚特共和国顿金斯克区的传统奶酪样品进行乳酸菌分离鉴定,分离株分别归属于Enterococcus、Lactobacillus、Leuconostoc等菌属,这与杨彦荣的结果符合,杨彦荣等[16]研究的卡尔梅克传统奶酪中乳酸菌分别归属于Enterococcus、Lactobacillus和Leuconostoc3个菌属。不同的环境条件下,传统发酵奶酪的菌群组成是不同的:Aydemir等[23]研究的奶酪优势菌为Lactobacillus casei和 Lactobacillus plantarum;Do lci等[24]研究的Castelm agno PDO奶酪优势菌为Lactobacillus plantarum和Lactobacillus paracasei;Coppo la R等[25]研究的Caciocavallo奶酪优势菌为Lactobacillus pentosus和Lactobacillus coryneformis subsp.Torquens;Coppo la S等[26]研究的Mozzarella奶酪优势菌为Streptococcus thermophilus;PIRAINO P等[27]研究的奶酪优势菌还有Lactobacillus fermentum。本研究从酸牛乳中分离出的乳酸菌被鉴定为 3个属Lactococcus、Enterococcus和 Leuconostoc,其中 Lactococcus lactis为该地区酸牛乳中的优势种。卿蔓君[28]研究内蒙古东部地区发酵酸牛乳中发现Lactococcus lactis subsp.lactis、和 Leuconostocmesenteroides subsp.Mesenteroides为其中的优势菌株。雷霞[29]研究内蒙古伊敏河岸、海拉尔河岸牧区发酵乳发现乳酸菌归属于4个属,Lactobacillus、Lactococcus、Enterococcus和 Leuconostoc,其 中Lactobacillus plantarum和Lactococcus lactis subsp.lactis为该地区传统乳中的优势菌群。本研究乳清中分离到的乳酸菌被鉴定为4个属(Lactococcus、Enterococcus、Lactobacillus、Pediococcus)5个种,其中Lactobacillus plantarum为该地区乳清中的优势种,其次是Lactococcus lactis。本研究发酵乳饮料中分离到的乳酸菌被鉴定为5个属(Lactococcus、Enterococcus、Lactobacillus、Pediococcus、Steptococcus)6个种,其中Lactococcus lactis为该地区发酵乳饮料中的优势种,这与呼斯楞的结果相符合,呼斯楞[30]运用与本文一样的研究方法得出内蒙古呼伦贝尔地区液体发酵乳制品中的优势菌种为Lactococcus lactis。海拔、气候、温度、大气压、阳光等各种环境因素的差异以及乳制品的制作工艺条件和制作环境等因素也影响成品的菌群结构,在所有因素的综合作用下,不同地区的不同乳制品都具有了独特性[7,31]。
目前在发酵乳制品生产中涉及的乳酸菌属有Lactococcus、Lactobacillus、Pediococcus、Leuconostoc、Streptococcus、Bifidobacterium[32]。布里亚特共和国顿金斯克区8份发酵乳制品中分离到的50株乳酸菌鉴定为6个菌属,包括上述的前5个乳酸菌属(没有分离到Bifidobacterium),还有Enterococcus。Enterococcus一直存在于众多的发酵乳制品中,在乳制品中经常会分离到Enterococcus faecalis和Enterococcus faecium,Enterococcus durans也经常在奶制品中分离出来,但在发酵过程中的应用仍存在争议。有研究表明,Lactococcus和Streptococcus这两个菌属的某些菌株有助于乳制品的酸化、凝乳以及酪蛋白水解过程[33]。Streptococcus thermophilus可以对乳酸发酵的生态环境进行改善,而且可以降低胆固醇水平[34]。Lactococcus lactis具有快速酸化以及凝乳的能力,能够通过促进乳酸的形成进而增强乳制品的风味及质地[7,35]。Leuconostoc与Enterococcus能够对乳制品的味道和质地产生影响[36]。Lactobacillus中瑞士乳杆菌凭借其蛋白水解能力可以减少某些乳制品,如奶酪等的苦味[37]。
4 结 论
本文从俄罗斯布里亚特共和国顿金斯克区采集的8份传统发酵乳制品样品中乳酸菌数(对数值)为(6.88±0.19)m L-1至(8.90±0.30)m L-1,乳酸菌活菌数都比较高。采用传统纯培养方法分离得到50株菌株,然后通过16S rDNA序列分析方法将其鉴定为Lactococcus,Lactobacillus,Enterococcus,Pediococcus,Leuconostoc,Streptococcus,共6个属,11个种。其中,Lactococcus lactis分离到20株,占总菌株的40%,为布里亚特共和国顿金斯克区传统发酵乳制品中的优势菌种。
