白藜芦醇通过诱导细胞自噬性死亡抑制宫颈癌的研究
2021-03-08孙晓东谢丽霞杜凯丽
孙晓东,周 珍,曾 炼,谢丽霞,杜凯丽,桑 明,2*
1湖北医药学院附属襄阳市第一人民医院,襄阳 441000;2湖北医药学院 武当特色中药研究湖北省重点实验室,十堰 442000
白藜芦醇(resveratrol,RES),是一种非黄酮类的多酚化合物,广泛存在于葡萄、花生等植物以及虎杖等中药材,作为低毒性的天然药物发挥抗炎、抗氧化、抗血小板聚集、抗动脉粥样硬化等作用,此外,白藜芦醇也是一种很有前景的抗肿瘤药物[1-3]。它的靶点广泛,如mTOR、JAK、β-amyloid、Adenylyl cyclase、IKKβ、DNA polymerase,也是一种特异性的SIRT1活化剂和有效的孕烷X受体(PXR)抑制剂[4,5]。新近研究发现,RES对多种肿瘤具有体内外抑制活性[6-9],但RES作为一种抗癌药物的临床试验还是很有限,在肿瘤动物模型中测试RES的研究结果表明,RES对胃肠道肿瘤主要发挥预防作用。而在乳腺癌动物模型中RES有可能成为癌症治疗剂,然而,这种有益作用取决于动物和细胞类型[10]。RES对于人类HPV病毒感染的宫颈癌模型发挥什么样的作用,相关报道较少。本研究主要利用HeLa细胞在裸鼠皮下成瘤,检测RES在体内的抑癌效应,通过检测RES在宫颈癌细胞自噬方面发挥的作用,从体内外两方面探讨RES通过促进细胞自噬性死亡抑制宫颈癌的机制。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器
细胞培养及研究所用的DMEM(11965-092)、胰酶(25300054)(Gibco公司,美国);二甲基亚砜(DMSO,D2650)、Trizol试剂(93289-100ML)(Sigma公司,美国);逆转录酶(M1705)、RNA酶抑制剂(N2511)(Promega公司,美国);SYBR Green PCR Mix(1725204)(Bio-Rad公司,美国);Rabbit Anti-LC3 Polyclonal Antibody(abs127815)、Rabbit anti-p62/SQSTM1 Polyclonal Antibody(abs143300)、Rabbit Anti-TMEM49 Polyclonal Antibody (abs126424)、Rabbit Anti-Beclin 1 Polyclonal Antibody(abs122672)(爱必信生物科技有限公司,中国);细胞凋亡-Hoechst染色试剂盒(C0003)、Ad-GFP-LC3B(C3006-1ml)、Ad-mCherry-p62(C3016-1ml)、Ad-mCherry-GFP-LC3B(C3011-1ml)、Mito-Tracker Red CMXRos(C1049-50 μg)、HRP标记的山羊抗兔二抗(A0208)、山羊抗小鼠二抗(A0216)(碧云天生物科技有限公司,中国);SpectraMax i3x酶标仪(Molecular Devices公司,美国);Ⅸ70倒置荧光显微镜(Olympus公司,日本);ABI 7500-PCR仪(Life technology公司,美国);BD FACSAria II流式细胞仪(BD公司,美国)。
1.1.2 实验动物
SPF级BALB/c裸小鼠,6周龄,雌性,体重18~20 g,购自湖南斯莱克景达公司[SCXK(湘)2019-0004],在本实验室无特定病原体(specific-pathogen free,SPF)的饲养间【SCXK(鄂)2017-0093】饲养。按实验动物使用的3R原则给予人道的关怀,所有动物实验通过襄阳市第一人民医院动物伦理委员会审批(审批号:20170622)。
1.2 方法
1.2.1 动物及肿瘤细胞株
18只Balb/C nude鼠,均于右侧腋中线皮下注射瘤细胞(2×107/mL,100 μL/只),每三天测量并根据公式(V= a×b2/2)计算瘤体的体积,做记录,对实验小鼠进行称重。瘤体直径大于2 mm视为成瘤,将小鼠随机分成3组:对照组、RES治疗组(50 mg/kg)、RES治疗组(100 mg/kg),每组6只。RES治疗组采用灌胃给药,对照组给予等体积含相同浓度溶剂的生理盐水。每天给药一次,连续给药三周。给药期间观察各组小鼠的精神、活动、饮食、饮水情况。给药三周后处死全部裸鼠。
HeLa细胞(人宫颈癌细胞,HPV18阳性)、SiHa细胞(人宫颈癌细胞,HPV16阳性)、End1/E6E7细胞购自湖南丰汇生物科技有限公司,通过STR鉴定,与文献报道一致[11,12]。培养于高糖DMEM,添加10%胎牛血清,37 ℃,5% CO2培养箱中培养。
1.2.2 免疫组化检测LC3B、Beclin-1和P62蛋白在肿瘤组织中的表达
取肿瘤组织,4%多聚甲醛固定、石蜡包理,5 μm连续切片。采用免疫组化检测肿瘤组织中LC3B、Beclin-1和P62蛋白的表达,阳性染色呈棕黄色,先在低倍镜下扫视整个组织切片,在细胞染色清晰,背景良好的区域选择4个视野,进行高倍镜拍照,用Image J软件读取4个视野的阳性面积,计算相对表达量。
1.2.3 Real-time RT-PCR检测自噬相关基因表达
HeLa细胞用不同浓度RES(10、20、40 μM)、Rapa处理24 h,采用TRIzol试剂提取总RNA,合成 cDNA,用SYBR Green PCR Mix进行PCR反应条件:95 ℃ 预变性5 min,然后95 ℃ 15 s、56 ℃ 30 s、72 ℃ 30 s进行40个循环,熔解曲线检测引物特异性。以GAPDH作为内参照,2-△△CT计算目的基因相对表达量。引物由金凯瑞生物科技有限公司合成(武汉),序列如下表1。

表1 引物列表Table 1 List of primers
1.2.4 Western blot检测自噬相关蛋白的表达
HeLa细胞同“1.2.3”处理,用预冷的PBS清洗培养板的细胞,加蛋白裂解液冰上提取蛋白。BCA法测定蛋白浓度,调整蛋白浓度后加样缓冲液混合,100 ℃煮5 min。在12% SDS-PAGE电泳胶中电泳分离,转膜,孵育一抗、二抗,以GAPDH为内参照,用ECL发光法显色,用Bio-Rad成像设备曝光采图,Image Lab软件读取条带灰度值,计算相对表达量。
1.2.5 腺相关病毒Ad-GFP-LC3B、Ad-mCherry-p62、Ad-mCherry-GFP-LC3B感染HeLa细胞
HeLa细胞接种到24孔细胞爬片上,每孔2.5×104个细胞,培养24 h完全贴壁后,换800 μL新鲜培养液,按照美国CDC的生物安全等级及其操作与防护要求进行感染实验,每孔以MOI值为5进行腺病毒感染,感染后约24 h,除去含有病毒的培养液,每孔加入1 mL新鲜的完全培养液,按照分组对细胞进行干预,继续培养24 h后,用Hoechst染细胞核,PBS清洗后,取出细胞爬片,扣于有封片剂的载玻片上,荧光显微镜下观察细胞生长状况及荧光蛋白表达情况,根据荧光强度判断细胞自噬水平。
1.2.6 JC-1试剂盒检测细胞线粒体膜电位(mitochondrial membrane potential)△Ψm
JC-1是一种广泛用于检测△Ψm的理想荧光探针。在△Ψm较高时,JC-1聚集在线粒体的基质(matrix)中,形成聚合物(J-aggregates),可以产生红色荧光;在△Ψm较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体(monomer),可以产生绿色荧光。常用红绿荧光的相对比例来衡量线粒体去极化的比例。△Ψm的下降是细胞凋亡早期的一个标志性事件。通过JC-1从红色荧光到绿色荧光的转变可以很容易地检测到△Ψm的下降,同时也可以作为细胞凋亡早期的一个检测指标。将HeLa和SiHa细胞分为对照、RES、自噬激活剂雷帕霉素(rapamycin,Rapa)、自噬抑制剂巴伐洛霉素A1(bafilomycin A1,BAFA1)、RES+Rapa、RES+BAFA1,共6组,RES工作浓度为40 μM,Rapa工作浓度为100 nM,BAFA1工作浓度为100 μM。处理24 h,用PBS洗涤细胞两次,直接用1 mL JC-1染色工作液孵育细胞,或用0.25%的胰酶消化后收集细胞,用1mL JC-1染色工作液充分混匀,37 ℃ 孵育15 min,根据试剂说明,用流式细胞仪检测进行检测。
1.2.7 一步法TUNEL细胞凋亡检测试剂盒(红色荧光) 检测细胞凋亡
将HeLa按照“1.2.6”方法处理24 h,用PBS洗涤细胞两次,4%多聚甲醛固定细胞30 min,用PBS洗涤一次,加入含0.3% Triton X-100的PBS,室温孵育5 min,用一步法TUNEL细胞凋亡检测试剂盒进行检测,TdT酶与荧光标记液按1∶9配制,每孔细胞加TUNEL检测液50 μL,室温避光孵育60 min,PBS洗涤3次,用抗荧光淬灭封片剂封片,荧光显微镜下观察拍照。
1.3 统计学处理
2 结果
2.1 RES显著抑制裸鼠皮下移植瘤生长
用药期间,每组裸鼠进食、饮水、体重及活动状况良好,未见明显不良反应。与对照组相比,RES(50 mg/kg)和RES(100 mg/kg)治疗组肿瘤大小和质量明显低于Vehicle组(P<0.05)。结果见图1a和1b。
2.2 RES显著促进肿瘤组织中LC3B和Beclin-1表达、抑制P62表达
免疫组化检测肿瘤组织中LC3B、P62和Beclin-1蛋白的表达量,结果显示RES可以上调LC3和Beclin-1的蛋白表达水平同时下调P62蛋白表达水平,且有一定的浓度依赖。结果如图1c所示。这提示RES抑制宫颈癌生长可能与促进细胞自噬有关。
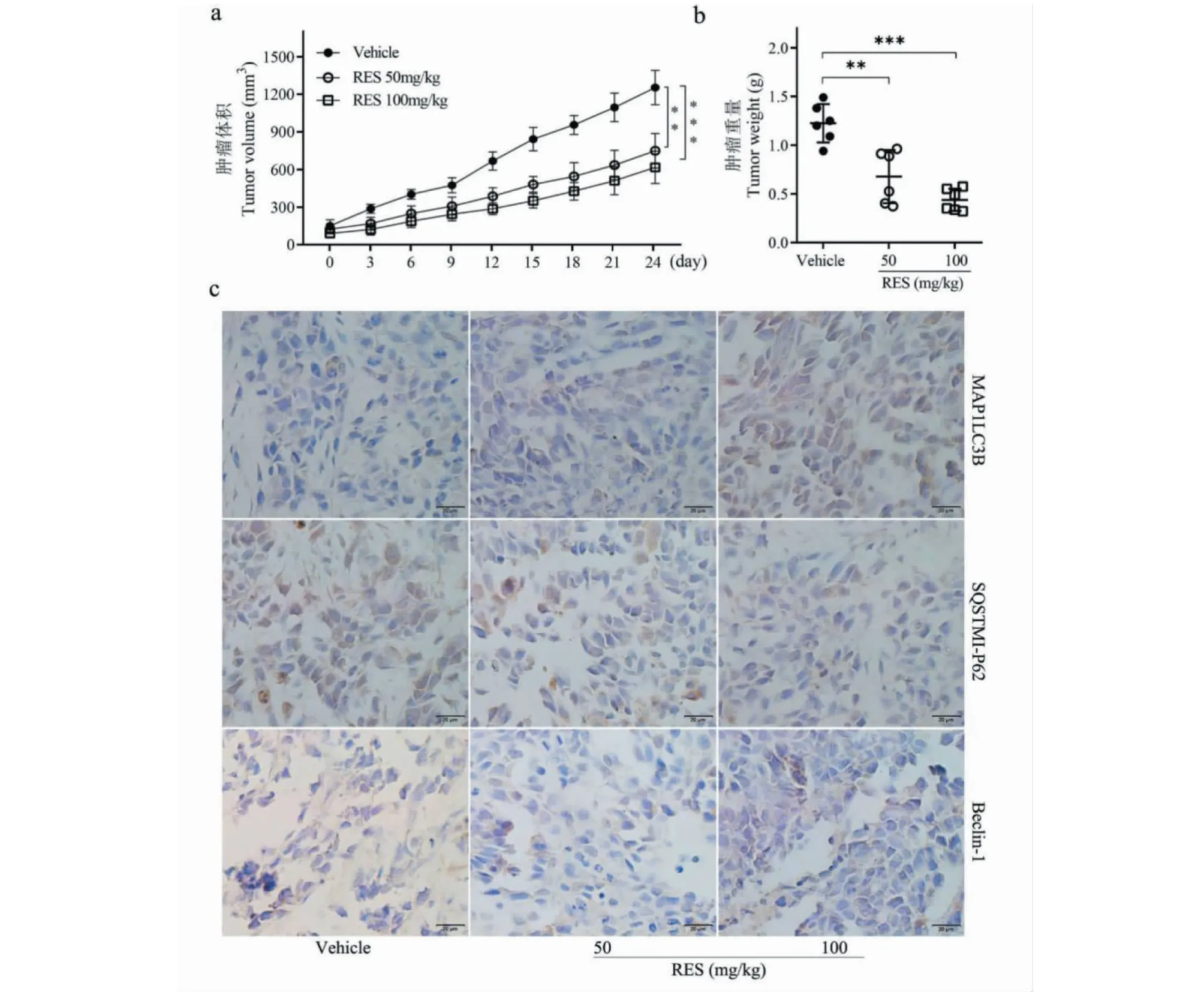
图1 RES抑制宫颈癌裸鼠皮下移植瘤的生长Fig.1 RES inhibits the growth of cervical cancer subcutaneous xenografts in nude mice注:(a)HeLa细胞裸鼠皮下移植肿瘤生长体积;(b)HeLa细胞裸鼠皮下移植肿瘤重量,与Vehicle组相比较,**P < 0.01,***P < 0.001;(c)肿瘤组织切片进行免疫组化检测自噬相关蛋白P62、Beclin-1和LC3B(标尺:20 μm)。Note:(a)The tumor volume;(b) The tumor weight,compared with vehicle,**P <0.01,***P <0.001.(c) The autophagy-related protein levels of P62,Beclin-1,and LC3B in tumor tissue was detected using immunohistochemical (Scale bar:20 μm).
2.3 RES调控细胞自噬相关基因mRNA和蛋白的表达
为证实RES是否调控宫颈癌细胞自噬,我们通过Real-time RT-PCR检测细胞自噬相关基因VMP1、Beclin-1和P62的mRNA表达,结果显示RES可以显著促进自噬基因VMP1、Beclin-1的表达,显著抑制P62的表达,与自噬激活剂Rapa的效果相似,其中40 μM RES与对照组相比均有统计学意义(P<0.05),结果如图2a所示。Western blot检测结果也显示RES促进自噬相关蛋白VMP1、Beclin-1和LC3B的表达,如图2b所示。Ad-GFP-LC3B和Ad-mCherry-p62感染细胞后,荧光显微镜检测结果显示,RES抑制P62的表达,促进LC3B的表达,如图2c所示。
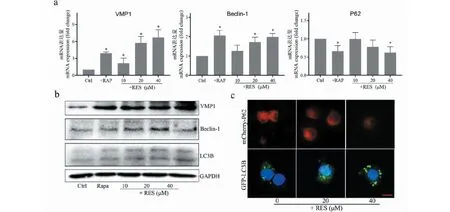
图2 RES促进宫颈癌细胞自噬Fig.2 RES promotes autophagy of cervical cancer cells注:(a)Real-time RT-PCR检测HeLa细胞中VMP1、Beclin-1、P62 mRNA表达水平,与对照组比,*P < 0.05;(b)Western blotting检测HeLa细胞中VMP1、Beclin-1、LC3B 蛋白表达水平;(c)Ad-GFP-LC3B和Ad-mCherry-p62感染细胞后,荧光显微镜检测小体(标尺:20 μm)。Note:(a)The expression levels of VMP1,Beclin-1,P62 mRNA in HeLa cells was detected using Real-time RT-PCR,compared with the control group, *P <0.05;(b) The protein levels of VMP1,Beclin-1,LC3B in HeLa cells was detected using Western blotting;(c)RES inhibited the expression of P62 and promoted the expression of LC3B,increased the number of autophagosomes (Scale bar:20 μm).
2.4 RES促进HeLa细胞发生细胞自噬
为检测RES诱导的细胞自噬是否与线粒体损伤相关,在感染 Ad-GFP-LC3B后,RES、Rapa、BAFA1单独或联合作用细胞24 h后,再用Mito-Tracker Red CMXRos标记线粒体,然后用荧光显微镜检测拍照,结果发现GFP-LC3B标记的自噬小体增加伴随Mito-Tracker Red CMXRos标记的线粒体的减少,如图3a所示。因为BAFA1抑制自噬小体的酸化,所以RES与BAFA1联合组自噬小体累积明显(图3a)。而P62蛋白在RES组、Rapa组、RES + Rapa组都明显降低,BAFA1组、BAFA1 + RES组没有明显变化(图3b),这也说明BAFA1或者BAFA1与RES联用抑制自噬小体的降解。另外,为检测RES对自噬流的影响,用双荧光标记的腺相关病毒载体Ad-mCherry-GFP-LC3B感染HeLa细胞,24 h后再用RES、Rapa、BAFA1单独或联合作用细胞24 h,然后用荧光显微镜检测拍照,在非自噬的情况下,荧光显微镜下mCherry-GFP-LC3B以弥散的黄色荧光(mCherry和GFP的综合效果)形式存在于细胞质中;而在自噬的情况下,荧光显微镜下mCherry-GFP-LC3B则聚集在自噬体膜上,以黄色斑点的形式表现出来(LC3B dot or punctae);当自噬体与溶酶体融合后,因GFP荧光的部分淬灭而以红色斑点的形式表现出来。结果显示RES促进HeLa细胞自噬流的发生,RES组与对照组相比,细胞内黄色斑点明显增加,说明自噬小体形成增多;RES + Rapa组比Rapa组红色斑点增加,说明自噬溶酶体增多;BAFA1组、RES + BAFA1组只有绿色荧光,而且绿色荧光有进入细胞核的现象,如图3c。这些提示RES促进细胞自噬流的形成,而 BAFA1阻断自噬流后RES不能再恢复自噬流。

图3 RES对HeLa细胞自噬的影响Fig.3 Effects of RES on autophagy of HeLa cells注:(a)Ad-GFP-LC3B标记自噬小体,Mito-Tracker Red CMXRos标记线粒体,荧光显微镜观察自噬小体的变化(标尺:20 μm);(b)Ad-mCherry-p62标记P62,RES与Rapa、BAFA1处理HeLa细胞24 h后,荧光显微镜拍照(标尺:20 μm);(c)Ad-mCherry-GFP-LC3B检测自噬流(标尺:20 μm)。Note:(a) Ad-GFP-LC3B labeled autophagosomes,Mito-Tracker Red CMXRos labeled mitochondria,the changes of autophagosomes was observated by fluorescence microscope (Scale:20 μm);(b) Ad-mCherry-p62 labeled P62,RES and Rapa,BAFA1 treated HeLa cells for 24 h,the changes of autophagosomes was observated by fluorescence microscope (Scale:20 μm);(c) Autophagic flow of HeLa cells was detected by using Ad-mCherry-GFP-LC3B (Scale bar:20 μm).
2.5 RES抑制宫颈癌与降低△Ψm相关
JC-1检测结果显示RES,Rapa和BAFA1对宫颈癌细胞的△Ψm具有不同的影响,RES和BAFA1不同程度的诱导HeLa细胞(图4a、c)和SiHa(图4b、c)△Ψm降低,Rapa对△Ψm的影响不明显(图4a、b、c); 与单独使用RES组相比,同时使用RES和Rapa,△Ψm降低比例有所减少,但没有统计学差异,而同时使用RES和BAFA1组的细胞△Ψm降低更加显著,如图4a、b、c。△Ψm的降低,是细胞凋亡级联反应过程中最早发生的事件,它可引起线粒体膜发生一连串的生物化学变化,导致细胞凋亡级联反应,因此JC-1可以用于早期的细胞凋亡检测,△Ψm下降的比例增加,也说明发生早期凋亡的细胞比例也增加。接下来,用TUNEL试剂检测HeLa细胞各组处理后的凋亡情况,发现HeLa细胞凋亡比例的变化与△Ψm降低的比例基本一致,RES和BAFA1不同程度的诱导HeLa细胞凋亡,两者联合使用后,细胞凋亡比例增加;Rapa对细胞凋亡没有明显作用,与单独使用RES相比,RES和Rapa联合组细胞凋亡比例有所下降(如图4d)。这些结果提示RES对线粒体膜电位以及细胞凋亡的作用在与BAFA1联用后有叠加效应,与Rapa联用后有消减效应,说明RES对宫颈癌细胞的自噬和凋亡都有影响,自噬激活的情况下凋亡减弱,自噬抑制的情况下凋亡增强。

图4 RES与Rapa、BAFA1诱导宫颈癌细胞凋亡Fig.4 RES and Rapa,BAFA1 induce cervical cancer cell apoptosis注:(a)流式检测RES与Rapa、BAFA1对HeLa细胞线粒体膜电位的影响;(b)流式检测RES与Rapa、BAFA1对SiHa细胞线粒体膜电位的影响;(c)图a和图b结果的统计分析,与对照组相比,*P<0.05,**P<0.01;(d)荧光显微镜检测RES与Rapa、BAFA1对HeLa细胞凋亡的影响。Note:(a) The effect of RES,Rapa,and BAFA1 on the mitochondrial membrane potential of HeLa cells;(b) The effect of RES,Rapa,and BAFA1 on the mitochondrial membrane potential of SiHa cells;(c) Statistical analysis of (a) and (b),compared with the control group,*P <0.05,**P <0.01;(d) The effect of RES,Rapa,and BAFA1 on apoptosis of HeLa cells was used by fluorescence microscopy.
3 讨论
宫颈癌治疗以手术为主,术后联合化、放疗。由于化疗药物大多具有较强的不良反应和易产生耐药性,限制了宫颈癌的临床治疗及预后,因而寻找抗瘤效果好而毒性低的药物是临床治疗的紧迫需求。近年来的大量研究证实RES具有良好的抗肿瘤能力,在肿瘤发生、发展中均有功效[6,7,9,13]。研究证实,在宫颈癌细胞中组织蛋白酶L介导了白藜芦醇诱导的自噬性和凋亡性细胞死亡[14],白藜芦醇诱导宫颈癌细胞系的线粒体膜电位降低,促进其凋亡的发生,也可以增加溶酶体通透性[15]。本研究进一步通过体内外实验验证了白藜芦醇通过自噬途径抑制宫颈癌的效应,首先通过体内实验证实RES显著抑制宫颈癌的进展,而且,组织水平检测发现自噬相关蛋白的表达受到RES的调节,因此推测RES抑制宫颈癌的机制可能与RES诱导自噬性细胞死亡(autophagic cell death,ACD)的发生有关。ACD是细胞发生过度自噬的结果,也是与细胞凋亡不同的Caspase非依赖性的Ⅱ型程序性细胞死亡[16],其主要特征为细胞质中出现大量自噬体和自噬溶酶体,胞质中绝大部分物质被降解,但细胞核依然保持完整性[17]。在持续的应激状态及持续进展的自噬作用下,细胞会由于过度的自我损耗而死亡[18]。这类细胞的死亡常常带有自噬特征,主要表现为Beclin1的过表达以及细胞中产生大量自噬体和自噬溶酶体[19]。液泡膜蛋白(vacuole membrane protein-1,VMP1)是公认的自噬蛋白,其表达水平与肿瘤恶性程度负相关[20],与Beclin-1共同作为激活自噬的分子开关[21]。VMP1在宫颈癌中的表达以及作用还未见报道。
通过RT-PCR、Western blot以及自噬小体检测均证实,RES促进宫颈癌细胞ACD的发生。结果显示,在宫颈癌细胞中Beclin-1、VMP1以及位于自噬小体和自噬溶酶体内膜的LC3B可以被RES诱导高表达,效应与Rapa相似。Rapa是哺乳动物TOR(mTOR)激酶的抑制剂,与FKBP12结合抑制mTORC1激活自噬,从而发挥肿瘤抑制作用[22,23]。进一步检测自噬小体及自噬流,发现RES和Rapa均可促进自噬小体和自噬溶酶体的形成,两者联用后自噬小体和自噬溶酶体进一步增加,伴随P62和线粒体的减少,但细胞核仍保持完整;同时,我们观察到BAFA1可阻断RES造成的宫颈癌细胞的自噬流,BAFA1与RES联用造成自噬小体和P62的累积,伴随线粒体的显著减少,而且细胞核明显异常与其它组。BAFA1是一种从链霉菌属物种中分离的大环内酯类抗生素,是特异的 vacuolar-type H+ ATPase(V-ATPase)抑制剂。BAFA1可以靶向线粒体,诱导凋亡诱导因子从线粒体转至细胞核,促进caspase非依赖性凋亡。此外,BAFA1诱导Beclin-1与Bcl-2结合,进一步抑制自噬,促进细胞凋亡[24]。我们的实验结果也证实了这一点,通过检测线粒体膜电位和TUNEL阳性率,我们发现RES可以诱导线粒体膜电位下降促进细胞凋亡,而在自噬激活和自噬抑制的情况下会产生对宫颈癌细胞的不同反应。有文献报道,RES阻止Rapa诱导的P62降解,因此Rapa和RES的联合能够阻止自噬的上调并诱导乳腺癌细胞凋亡[25]。但在本研究中,我们发现RES和Rapa联用可促进宫颈癌细胞过度自噬,自噬溶酶体的大量形成造成ACD的发生;而当宫颈癌细胞的自噬流被阻断,RES又可通过降低线粒体膜电位诱导内源性的细胞凋亡。
由此可见,RES在妇科肿瘤宫颈癌的治疗方面有良好的应用前景,而且与自噬激活剂Rapa或者自噬抑制剂BAFA1联合使用,能从促进自噬性死亡或者促进细胞凋亡两个途径起到更加积极的抗癌作用。
