红花降糖活性成分谱效关系研究
2021-03-08武鹤婷赛那瓦尔芒思尔高彦华信学雷宁慧霞
武鹤婷,赛那瓦尔·芒思尔,高彦华,信学雷 *,宁慧霞
1中国科学院新疆理化技术研究所 中国科学院干旱区植物资源化学重点实验室省部共建新疆特有要用资源利用重点实验室,乌鲁木齐 830011;2中国科学院大学,北京 100049
红花为菊科植物红花(CarthamustinctoriusL.)的干燥花,具有活血通经,散瘀止痛。用于经闭、痛经、恶露不行、癥瘕痞块、胸痹心痛、瘀滞腹痛、胸胁剌痛、跌扑损伤、褡疡肿痛之功效[1]。红花主产于新疆,维语名为扎朗子古力,是活血化瘀的传统药材之一,其主要活性成分是红花黄色素(saffloryellow,SY),羟基红花黄色素A(hydroxysafflor yellow A,HSYA)、红花苷、红花醌及新红花苷等[2]。现代药理学研究表明:红花提取物可以有效缓解四氧嘧啶所致小鼠糖尿病[3,4],通过抗氧化清除自由基改善糖尿病症状[5],并在糖尿病肾病[6]、视网膜病变[7]、糖尿病性心肌病[8]等并发症的治疗中发挥了重要的作用,但对其中主要降糖活性成分谱效关系的研究尚未见相关报道。
蛋白酪氨酸磷酸酯酶1B(protein tyrosine phosphatase 1B,PTP1B)是蛋白酪氨酸磷酸酶家族中的主要成员之一,它是引起胰岛素抵抗的重要原因,也是治疗糖尿病和肥胖症的重要靶点,通过抑制PTP1B活性,可显著改善糖尿病及肥胖症状,在糖尿病的发生、发展中起着关键的作用[9]。
本研究通过大孔树脂富集红花水提取物中的降糖活性成分,评价了降糖活性,建立了红花降糖活性成分指纹图谱并进行了聚类分析和主成分分析;通过对照品指认其中主要化学成分后,并采用灰色关联度和正交偏最小二乘法研究红花降糖活性成分指纹图谱与其降糖活性的关系,以关联度的大小来衡量指纹特征峰对药效贡献的大小,最终确定最能反映其药效的特征峰。最后,利用《中华人民共和国药典》方法测定了不同产地红花中HSYA和山柰素的含量,为科学评价红花降糖作用提供理论基础。
1 材料与仪器
1.1 仪器
Waters alliance e2695高效液相色谱仪(美国沃特世公司);Waters 2487 紫外检测器;Sartorius BP211D 十万分之一分析天平(北京赛多利斯仪器系统有限公司);微孔滤膜( 日本岛津公司NY 0.22 μm);KQ-250DB型数控超声波清洗器(昆山市超声仪器有限公司);SpectraMax MD5酶标仪(美国Molecular Devices)。
1.2 药材
红花采自新疆吉木萨、裕民县、伊犁霍城县(见表1),由中国科学院新疆生态与地理研究所标本馆冯缨研究员鉴定为CarthamustinctoriusL.的花。
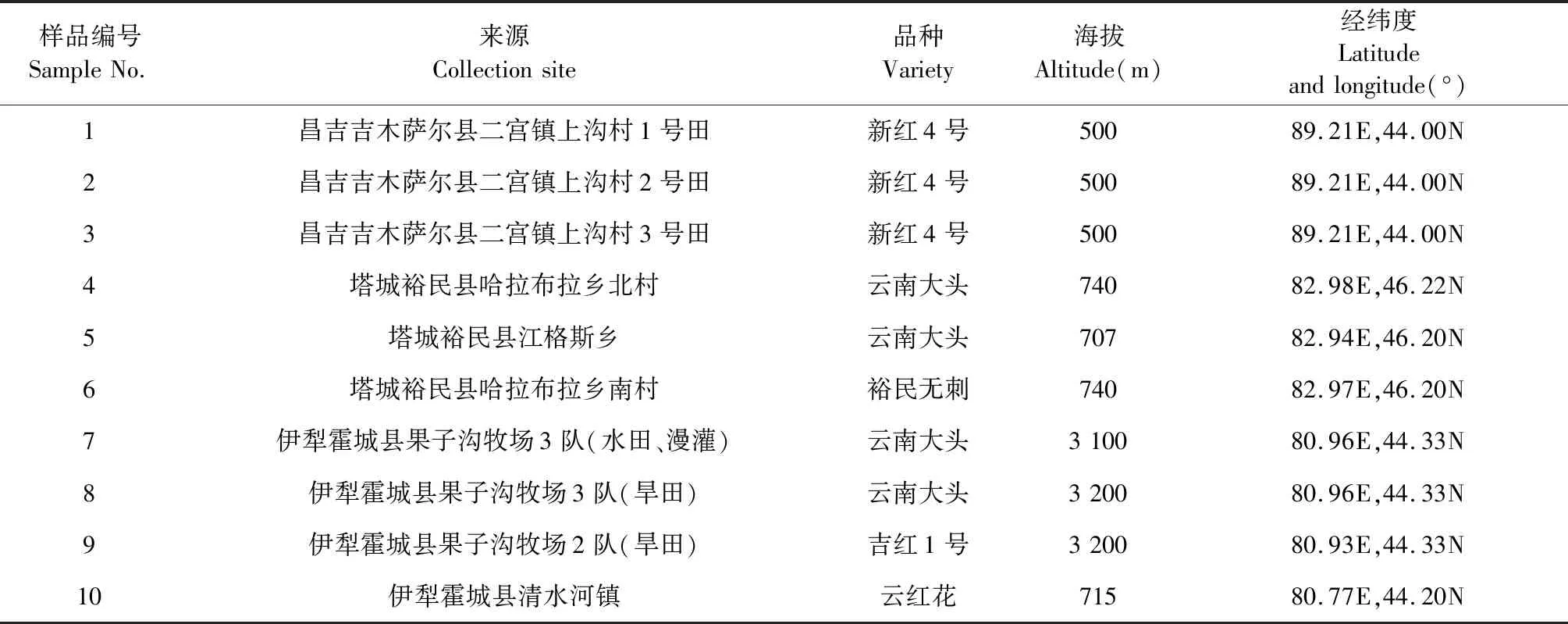
表1 红花药材的来源与种Table 1 Origins and varieties of the flowers of C.tinctorius
1.3 试剂
提取用水为超纯水;纯化用乙醇(食品级)由天津市百世化工有限公司提供;甲醇(色谱级,Fisher Scientific);乙腈(色谱级,Fisher Scientific);甲酸(分析级,默克试剂);乙醇(食用乙醇)由天津市百世化工有限公司提供;AB-8型大孔树脂(沧州宝恩化工有限公司)。
PTP1B、醛糖还原酶(aldose reductase,AR)中国科学院干旱区植物资源化学重点实验室克隆表达、纯化;α-葡萄糖苷酶(α-glucosidase,GAA)、二肽基肽酶IV(dipeptidyl peptidase-4,DPPIV)、对硝基苯磷酸二钠盐(pNPP)、矾酸钠、对硝基苯基-β-D-吡喃葡萄糖苷(PNPG)、NADPH、DL-甘油醛、阿卡波糖、西他列汀、托瑞司他、二甲基亚砜(DMSO)(美国Sigma公司);Compound-2(3-(3,5-dibromo-4-hydroxy-benzoyl)-2-ethylbenzo -furan-6-sulfonicacid-(4-(thiazol-2-yl-sulfamyl)-phenyl)-amide)由美国Merck公司提供。
1.4 对照品
HSYA对照品(中国科学院新疆理化技术研究所制备,批号:GSB11-3214-2014);6-羟基山柰酚-3,6-二-O-葡萄糖基-7-O-葡萄糖苷(自制,HPLC测定纯度>98%);其他对照品来自中国食品药品检定研究院;对照品山柰素(批号:110861- 200808);绿原酸(批号:110753-201716 );异鼠李素(批号:110860-201611);芦丁(批号:100080-201811);金丝桃苷(批号:111521-200303)。
2 实验方法
2.1 红花降糖活性成分的制备
制备方法参照文献[10]略加改进,称取300 g红花药材,加入35倍量的超纯水于10 L圆底烧瓶中,70 ℃水浴浸泡30 min,回流40 min,提取2次,合并提取液。将水提液密度浓缩至1.01~1.05 g/mL,然后进行AB-8型大孔吸附树脂色谱,色谱柱直径与高度之比为1∶9,洗脱速度为1 mL/min。先用超纯水洗脱糖分,待流出液Molisch反应基本呈阴性时,以10%食用级乙醇洗脱,收集流份,浓缩浸膏。
2.2 降糖活性成分指纹图谱的建立
2.2.1 色谱条件
Waters alliance e2695高效液相色谱仪;Phenomenex Gemini 110A-C18色谱柱(250 mm × 4.6 mm,5 μm);流动相:甲醇、乙腈、0.2%甲酸水溶液(V/V,%);按下表进行梯度洗脱;检测波长:265 nm;流速1.0 mL/min;柱温:室温;进样量20 μL,流动相条件见表2。以理论板数按HSYA峰计算应不低于4 000。

表2 流动相梯度洗脱条件Table 2 Condition of gradient elution of the extract
2.2.2 供试样和对照品溶液的制备
分别称取10批红花药材,按照“2.1”制备10个批次的活性部位,分别精密称取活性部位粉末8.0 mg于5 mL容量瓶中,加25% 甲醇水定容,用0.22 μm有机膜过滤,即得。
取HSYA对照品3.0 mg,精密称定,置容量瓶中,加25% 甲醇水定容制成每1 mL含0.3 mg的溶液,用0.22 μm 有机膜过滤,取滤液,即得。
2.2.3 方法学考察
取同一份红花样品的供试品溶液连续进样6次,按“2.2.1”色谱条件进样检测,以HSYA为参比峰,考察各共有峰的相对保留时间和相对峰面积的一致性,结果表明,各共有峰的相对保留时间和相对峰面积的RSD为2.60%,表明仪器精密度良好,符合指纹图谱的检测要求。
取同一批红花样品5份,按“2.2.2”的方法制备供试品溶液,按“2.2.1”色谱条件进样检测,以HSYA为对照峰,计算共有峰的相对保留时间和相对峰面积,结果表明,各共有峰的相对保留时间和相对峰面积的RSD为2.68%,表明该方法具有较好的重复性。
取同一份红花样品作为供试品溶液,分别于0、3、9、12、15、24 h检测指纹图谱,以HSYA为对照峰,计算共有峰的相对保留时间和相对峰面积,结果表明,各共有峰的相对保留时间和相对峰面积的RSD为2.12%,表明样品溶液在24 h内稳定,符合指纹图谱检测要求。
2.2.4 活性成分指纹图谱的建立
将10批红花活性提取物按“2.2.2”方法制备供试品,按“2.2.1”色谱条件进样检测,并记录相关色谱数据。将10批红花HPLC图谱数据导入到“中药色谱指纹图谱相似度评价系统(2004A 版)”进行相似度评价,谱图见图1。
2.2.5 共有峰的鉴定
按“2.2.1”项的色谱条件,将绿原酸、6-羟基山柰酚-3,6-二-O-葡萄糖基-7-O-葡萄糖苷、异鼠李素、芦丁、HSYA、金丝桃苷、山柰素的对照品分别进样,根据样品保留时间,对指纹图谱特征峰进行指认,确认其峰归属。各对照品保留时间如图 2所示。
2.2.6 聚类分析
将10批红花样品共有峰的相对峰面积作为原始数据导入SPSS 20.0软件,采用平方欧式距离为样品间距离计算方法,对数据进行标准化转换,进行聚类分析。
2.2.7 主成分分析
为了进一步探讨不同产地的红花成分间的差异性,在相似度和聚类分析的基础上,对指纹图谱所得到的8个共有峰的峰面积进行标准化处理,以标准化后的共有峰峰面积为变量,采用SPSS 20.0软件进行主成分分析。
2.3 降糖活性的测定
所有活性测定样品用DMSO溶解,反应体系中DMSO终浓度<2%(V/V)。
2.3.1 PTP1B活性的测定
用对-硝基苯基磷酸二钠(pNPP)作为底物,参照文献[11]方法进行测定,获得不同浓度的抑制率,并运用IBM SPSS 20.0统计分析软件计算最大半数抑制浓度(IC50)。
2.3.2α-葡萄糖苷酶抑制活性的测定
以PNPG为底物,参照文献[11]方法进行测定,以不含酶溶液体系为空白,以阿卡波糖为阳性对照,获得不同浓度的抑制率,并运用IBM SPSS 20.0统计分析软件计算IC50。
2.3.3 二肽基肽酶IV(DPPIV)抑制活性的测定
参照文献[12]方法进行测定,以不含酶溶液体系为空白,以西他列汀为阳性对照。获得不同浓度的抑制率,并运用IBM SPSS 20.0统计分析软件计算IC50。
2.3.4 醛糖还原酶抑制活性的测定
参照文献[12]方法进行测定,按不同剂量加入样品,340 nm处测定吸收值,每个实验重复 3 次,获得不同浓度的抑制率,并运用IBM SPSS 20.0统计分析软件计算IC50。
2.4 灰色关联度分析
2.4.1 原始数据处理
将各差异样品的药效学指标组成参考数列,将各差异样品的指纹图谱中的各共有峰峰面积组成比较数列。对所述参考数列和比较数列进行无量纲化处理;优选采用均值化方法进行处理。
2.4.2 求绝对差序列
以药理效应值即样品对PTP1B酶抑制作用的 IC50值列为参考数列(Yo(m)),指纹图谱共有峰峰面积列为比较数列(Yi(m)),按公式计算绝对差数列(△oi(m)),其中△oi(m)=丨Yo(m)-Yi(m)丨。所得的无量纲化的参考数列和比较数列,以用于计算各共有峰与药效之间的关联度。
2.4.3 求关联系数
关联系数反映2个被比较序列的靠近程度。比较序列(Yi(m))与参考序列(Yo(m))的关联系数按公式计算:Koi=(△min+ρ△max)/(△oi(m)+ρ△max)(分辩系数取ρ=0.2)。
2.4.4 求关联度
各类关联系数以平均值法求得,对步骤“2.4.3”所得关联度进行排序,以评价共有峰的药效活性,关联度大于0.6,视为活性组分。据此可寻找指纹特征峰对应的化学成分与药效间的联系。
2.5 正交偏最小二乘法验证
灰色关联度分析方法虽然能够很好地识别出指纹图谱中与抑制活性有较高相关性的峰,但其不能识别出抑制活性与相关峰的正、负关系。本研究使用SIMCA-P14.1软件,采用正交偏最小二乘法进一步验证了各产地活性成分PTPT1B的IC50与指纹图谱中8个峰的相关性。
2.6 不同产地红花中主要成分的测定
按照《中华人民共和国药典》2015版中记载的红花HSYA、山柰素含量测定方法,测定不同产地10批次红花原料中HSYA、山柰素含量。
2.6.1 HSYA的测定时对照品及供试品溶液的制备
分别取10批红花粉末(过三号筛)0.4 g,精密称定,置具塞锥形瓶中,精密加入25% 甲醇水溶液50 mL,称定重量,超声处理(功率300 W,频率50 kHz)40 min,放冷,再称重,用25%甲醇水溶液补足减失的重量,摇匀,用0.22 μm有机膜过滤,取滤液,即得。
精密称定HSYA对照品5.07 mg置10 mL容量瓶中,用25%的甲醇水溶液定容,再稀释为0.15 mg/mL的溶液,用0.22 μm 有机膜过滤,取滤液,即得。
2.6.2 山柰素的含量测定时对照品及供试品溶液的制备
精密称定山柰素对照品2.19 mg置25 mL容量瓶中,用甲醇稀释定容至刻度,再稀释为0.087 6 mg/mL的溶液,用0.22 μm有机膜过滤,取续滤液,即得。
分别精密称取10批红花粉末0.5 g,置锥形瓶中,精密加入甲醇25 mL,称重,加热回流30 min,放冷,再称重,用甲醇补足减失重量,摇匀,滤过,精密量取续滤液15 mL,置平底烧杯中,加盐酸溶液5 mL,摇匀,置水浴中加热水解30 min,立即冷却,转移至25 mL容量瓶中,用甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。
2.7 统计分析
文中所涉及的所有统计分析使用SPSS20.0或SIMCA-P14.1完成。
3 结果与分析
3.1 红花降糖活性部位的制备
按照“2.1”中所述方法得到黄色粉末13 g,室温干燥并保存作为红花活性部位(得率约为4%),备用。
3.2 降糖活性成分指纹图谱的建立
3.2.1 指纹图谱的建立
将10批红花活性提取物按“2.2.2”方法制备供试品,按“2.2.1”色谱条件进样检测,并记录相关色谱数据。将10批红花HPLC图谱数据导入到“中药色谱指纹图谱相似度评价系统(2004A版)”进行相似度评价,谱图见图1。设定参照图谱,将各色谱图自动匹配,生成对照谱图,进行相似度计算,结果见表3。10批新疆不同产地的红花相似度在0.95以上,均已达到相似度的基本要求,说明样品之间具有良好的相似度。
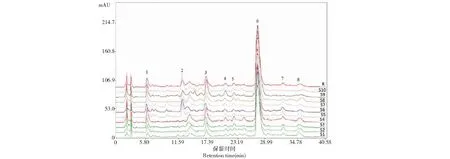
图1 10批红花药材有效部位HPLC指纹图谱Fig.1 HPLC chromatograms of the water extract of the flowers of C.tinctorius
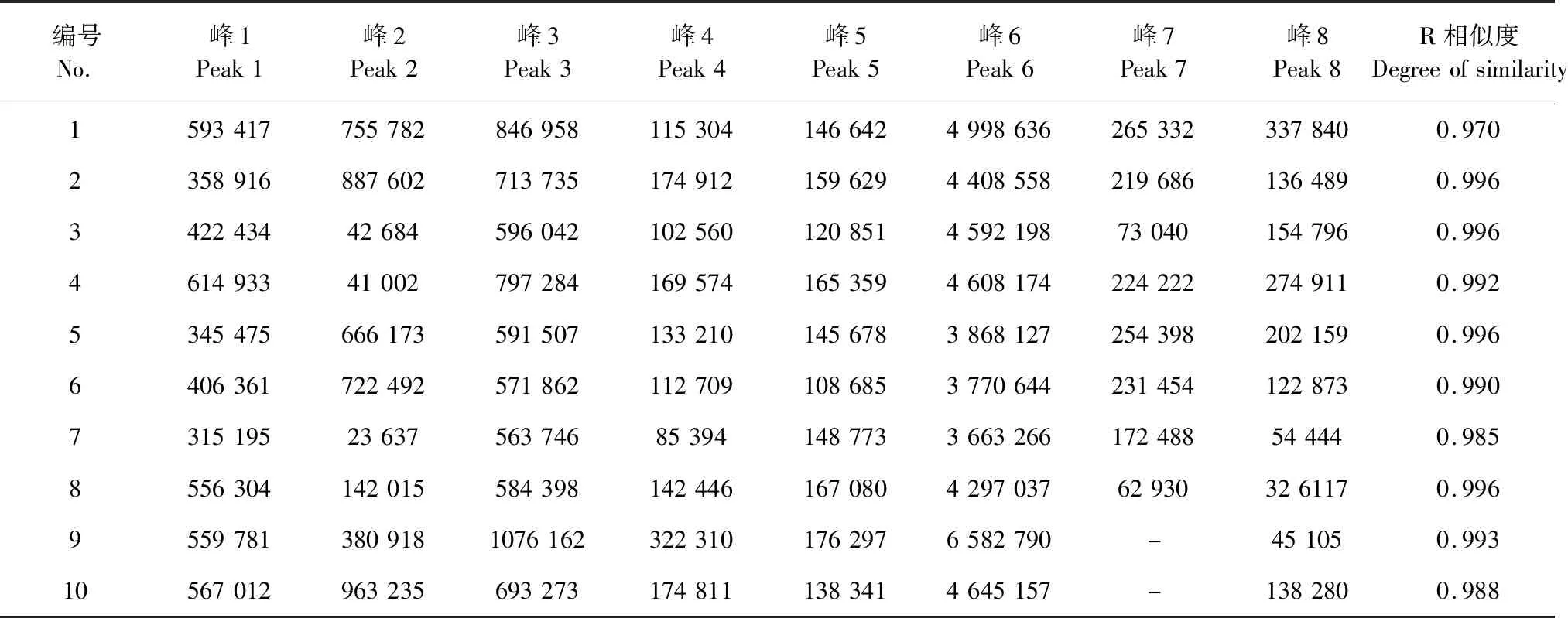
表3 10批红花药材有效部位的共有峰峰面积与相似度RTable 3 Common peaks of the water extract in HPLC spectrum from 10 samples and gray relation grades
3.2.2 主要化学成分的指认
通过对照品及保留时间对对照指纹图谱进行指认,确定共有峰2~8号分别为绿原酸、6-羟基山柰酚-3,6-双-O-葡萄糖基-7-O-葡萄糖苷、异鼠李素、芦丁、HSYA、金丝桃苷和山柰素(见图2)。
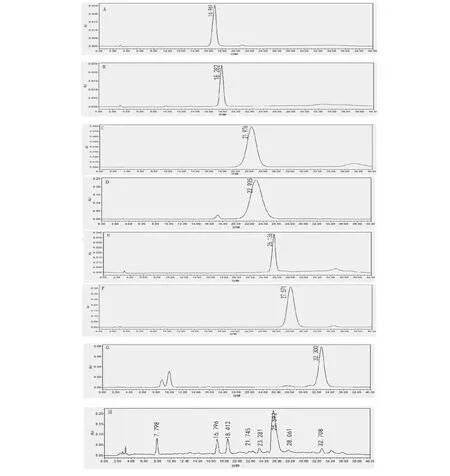
图2 红花降糖提取物中主要成分确认Fig.2 Recognition of main principles in antidiabetic extract from the flowers of C.tinctorius 注:A:绿原酸对照品;B:6-羟基山柰酚-3,6-二-O-葡萄糖基-7-O-葡萄糖苷;C:异鼠李素对照品;D:芦丁对照品;E:HSYA对照品;F:金丝桃苷对照品;G:山柰素对照品;H:红花降糖提取物。Note:A:Chlorogenic acid;B:6-Hydroxykaempferol-3,6-di-O-glucose-7-O-glucoside;C:Isorhamnetin;D:Rutin,E:HSYA;F:Hyperoside;G:Kaempferide;H:Antidiabetic extract of the flowers of C.tinctorius.
3.2.3 聚类分析
将10批红花样品共有峰的相对峰面积作为原始数据导入SPSS 20.0软件,采用平方欧式距离为样品间距离计算方法,对数据进行标准化转换,进行聚类分析,从树状谱系图(图3)结果可以看到,当类间距离>5时,可将样品分为2类,9为第I类,2、10、1、5、6、7、3、4、8为第II类,即伊犁产吉红1号与其他产地红花之间存在差异。
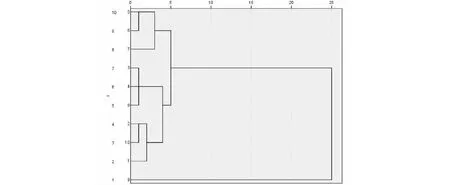
图3 不同产地红花聚类分析图Fig.3 Cluster analysis of the flowers of C.tinctorius from different area
3.2.4 主成分分析
采用SPSS 20.0软件进行主成分分析,结果见表4,选取前3个特征值>1成分为主成分,对红花指纹图谱进行描述,其累计方差贡献率为82.105%,能够较好地反映其化学成分特征。并根据公式 F= (0.478 42F1+0.197 05F2 +0.145 57F3)/82.105,计算综合得分结果见表5、6。

表4 主成分特征值及累计方差贡献率Table 4 Principal component eigenvalues and cumulative variance contribution rate

表5 主成分矩阵Table 5 Principal component matrix
3.3 降糖活性成分分析
通过PTP1B、GAA、DPP IV和HAR四个体外降糖活性测定,发现红花活性部位对PTP1B有较好的抑制作用,其IC50为8.43 μg/mL,红花水提取物对GAA抑制作用优于阳性药阿卡波糖;而对DPPIV和HAR抑制作用较弱。结果表明红花活性部位能抑制PTP1B,提高胰岛素敏感性;抑制GAA能延缓葡萄糖的吸收,结果见表7。PTP1B抑制活性可以进一步用于谱效关系分析,不同产地红花活性成分的PTPT1B抑制率见表8。
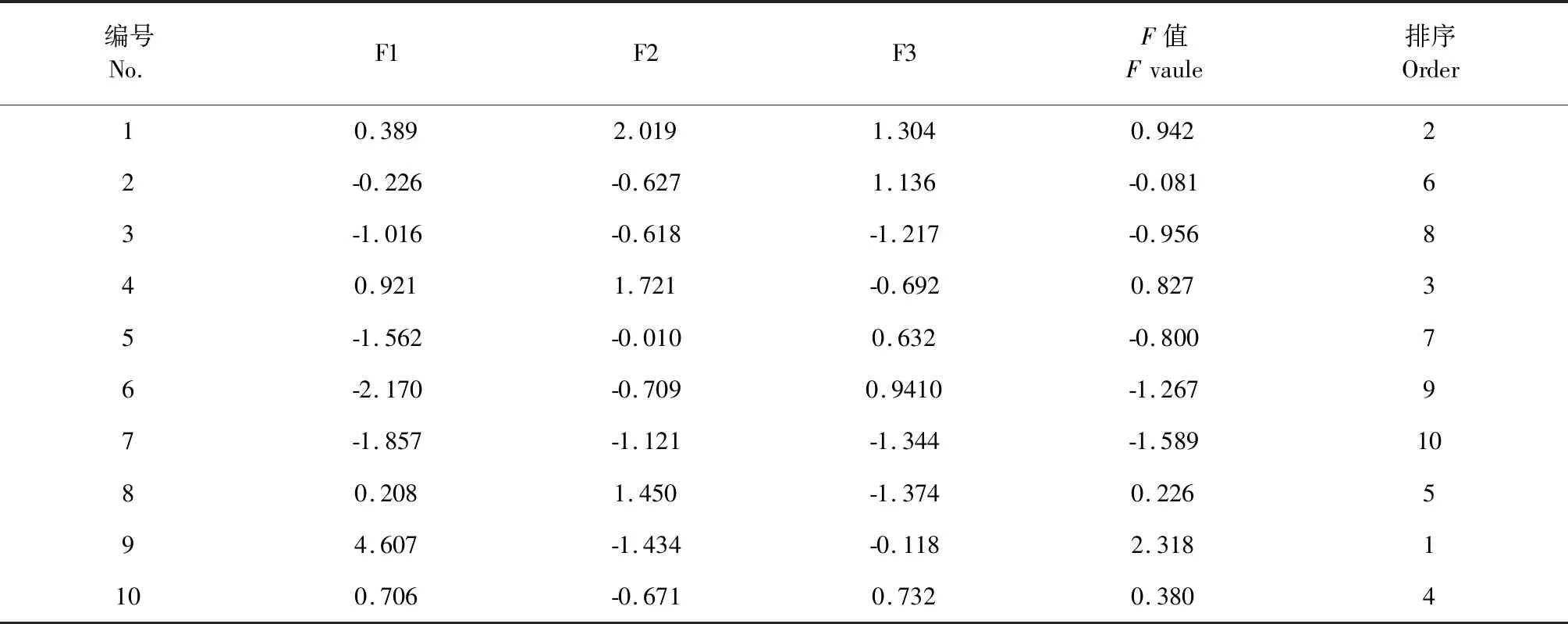
表6 不同产地红花主成分得分和综合评分Table 6 Principal component score and comprehensive score of the flowers of C.tinctorius from different area
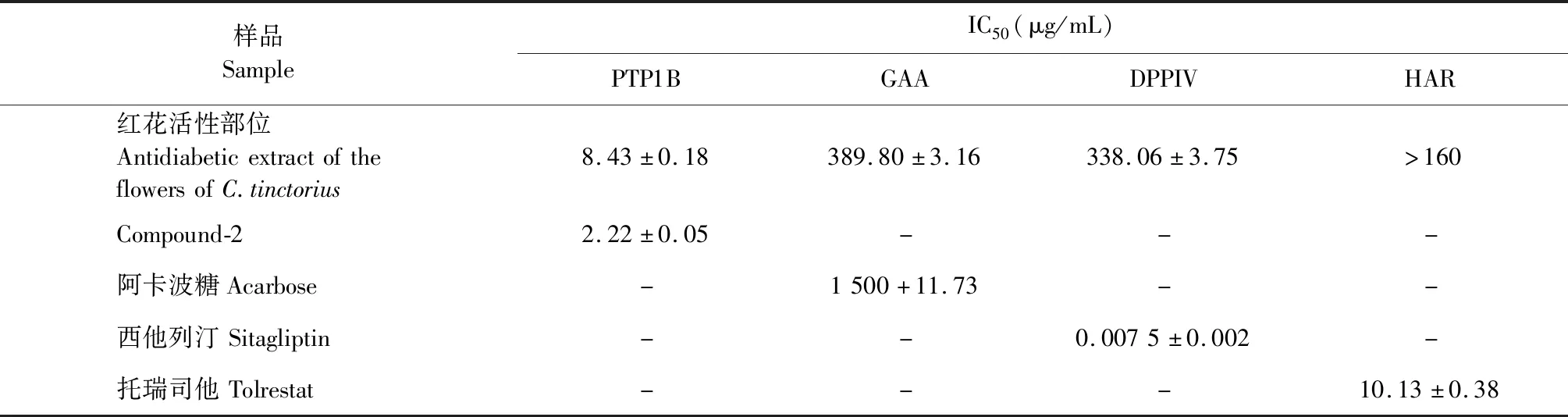
表7 红花水提取物针对胰岛素抵抗的四个酶分子靶点的抑制作用(mean±SD)Table 7 The inhibition of insulin resistance in four molecular target enzymes of water extracts of the flowers of C.tinctorius (mean±SD)
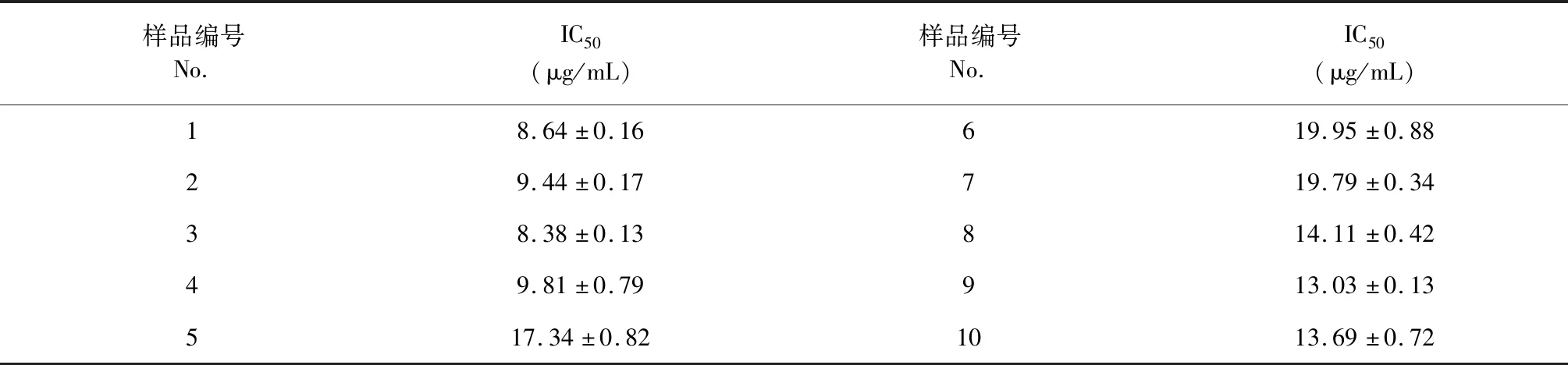
表8 10批红花药材的有效部位的PTP1B酶抑制活性(mean±SD)Table 8 Effect of the water extracts of 10 samples on PTP1B inhibition activity(mean±SD)
3.4 灰色关联度分析
以药理效应值即样品对PTP1B酶抑制作用的IC50(表5)值列为参考数列(Yo(m)),指纹图谱共有峰峰面积(表3)列为比较数列(Yi(m)),按照“2.4”的方法进行灰色关联度计算,所得结果见表9。

表9 红花降糖有效部位的谱效关系Table 9 Antidiabetic spectrum-effect relationship of water extraction from the flowers of C.tinctorius
灰色关联度分析表明:其抑制活性与指纹图谱中获得的7个共有峰有关联,说明这7个峰在降糖作用中具有协同作用,其中关联度和含量都比较高的是HSYA(6号峰)和6-羟基山柰酚-3,6-二-O-葡萄糖基-7-O-葡萄糖苷(3号峰)。7个色谱峰关联度从大到小,顺序为P5>P6>P3>P1>P7>P4>P8。
3.5 正交偏最小二乘法验证
灰色关联度分析方法虽然能够很好地识别出指纹图谱中与抑制活性有较高相关性的峰,但其不能识别出抑制活性与相关峰的正、负关系。本研究使用SIMCA-P14.1软件,采用正交偏最小二乘法进一步验证了各产地活性成分PTPT1B的IC50与指纹图谱中8个峰的相关性,得到IC50与8个峰的标准化回归系数图,如图4。由图4可以看出,峰7与IC50呈正相关,峰1、峰3、峰4、峰5、峰6和峰8等6个峰与IC50呈负相关。峰2对抑制活性几乎无影响。通过回归系数的绝对值可知,7个峰对于IC50的影响顺序为P6>P3>P1>P8>P4>P5>P7。拟合结果与灰色关联度法结果相近。
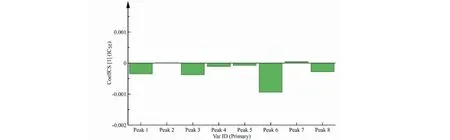
图6 标准化回归系数图Fig.6 Normalized regression coefficient diagram
3.6 红花药材HSYA和山柰素含量测定结果
对10批不同来源的红花样品中HSYA和山柰素的含量测定结果见表8。从新疆不同产地红花的含量测定结果可以看出,HSYA的含量范围在1.670 1%~1.937 5%之间,所有的红花样品中HSYA的含量均远高于《中华人民共和国药典》标准(1%)。从伊犁的测定结果可以看出,同一产地样品中,旱地的HSYA含量高于漫灌水田;伊犁地区中,高海拔种植的样品HSYA含量较高。
由所得数据也可以看出新疆不同产地红花中山柰素的含量比较稳定,山柰素的含量范围在0.094%~0.124 2%之间,远高于《中华人民共和国药典》标准(0.050%),新疆是红花的适宜种植区域。
4 讨论与结论
红花在世界范围内广泛种植,是一种药食两用的作物。中药指纹图谱能够较好反映中药的“多组份、多靶点、多途径综合调节作用”的特点,然而,目前大多数中药的活性成分及其物质基础是不明确的,建立在中药化学指标成分之上的中药指纹图谱并不能有效地表现其与药效的相关性,因此只有将标示有中药活性成分群的特征峰的指纹图谱与其药效结果对应起来,即将中药指纹图谱中化学成分含量变化与其药效变化联系起来,建立起中药谱效关系,才能有效地反映其内在质量。在本研究中,首次联合评价了红花降糖有效部位指纹图谱中所标示的化学成分与活性的关系。
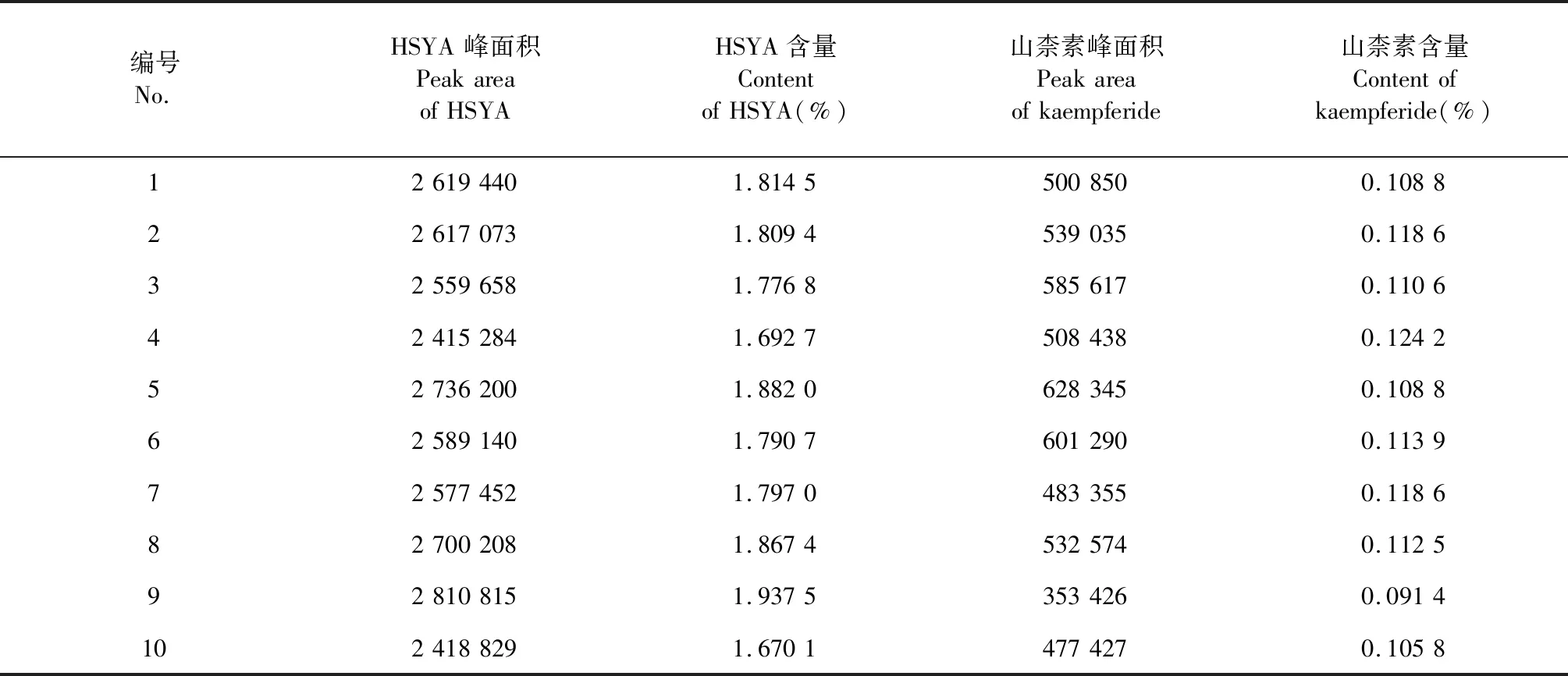
表10 10批红花药材中HSYA和山柰素的含量测定Table 10 Contents of the hydroxysafflor yellow A and kaempferide in the 10 batches of the flowers of C.tinctorius samples
红花降糖有效部位的制备方法,是通过对红花加热回流提取、大孔树脂分离纯化获得,通过建立红花降糖活性部位指纹图谱,找到了不同产地药材的8个共有峰,结合红花中化学成分的报道,通过对照品比对指认出其中7个峰。聚类分析表明除吉红1号外,其他品种之间没有差异。
通过对活性部位进行降糖活性筛选,发现不同产地的药材的活性成分均能有效抑制PTP1B和α-葡萄糖苷酶,且对 PTP1B 的抑制活性较突出,故选取其作为谱效关系的研究对象,利用灰色关联度和正交偏最小二乘法进行谱效关系分析,为红花降糖活性成分的质量控制提供了更为全面和准确的信息。灰色关联度分析法被广泛应用于中药谱效研究,虽然它对样本要求不高,但容易受到分辨系数的影响,且关联度均为正值,不好判断其具体的作用[13],因此我们选用正交偏最小二乘法与之联用,并得到了类似的结果。两种分析方法均表明其抑制活性与指纹图谱中获得的7个共有峰有关联,说明这7个峰在降糖作用中具有协同作用,其中HSYA(6号峰)和6-羟基山柰酚-3,6-二-O-葡萄糖基-7-O-葡萄糖苷(3号峰)是其中主要的活性成分,这一工作也为红花在糖尿病药物研发领域的应用提供了支撑。
红花中HSYA和山柰素含量测定结果也表明,新疆红花中这两种主要成分的含量远高于《中华人民共和国药典》标准,证明红花品质优良,新疆是红花适宜种植的区域。
