熔融挤出法制备阿司匹林肠溶颗粒*
2021-03-08刘瑢张鹏史博文王文苹
刘瑢,张鹏,史博文,王文苹,3
(1.宁夏医科大学总医院,银川 750004;2.宁夏医科大学药学院,银川 750004;3.云南中医药大学中药学院,昆明 650500)
熔融挤出(hot melt extrusion,HME)是将药物、载体与改性辅料在一定温度下熔融混合,以一定扭矩、压力挤出成型的技术[1-2]。熔融挤出法可以提高药物溶解性能,或通过选用不同载体制备缓控释及肠溶制剂,广泛应用于药剂研发领域。
醋酸羟丙甲纤维素琥珀酸酯 (hydroxypropyl methyl cellulose acetate succinate,HPMCAS)是羟丙甲纤维素乙酸酯和琥珀酸酯混合物,具有两亲性,玻璃化转变温度约为120 ℃[3]。其粒化挤出物显示出较高机械强度和韧性[4]。药物分散在HPMCAS中,形成具有极低晶态的固体分散体或具有非晶形的玻璃态,可显著提高药物在肠液中的溶解和溶出[5]。
笔者在本实验中以阿司匹林为模型药物,选用HPMCAS为骨架材料,采用熔融挤出法制备阿司匹林固体分散体颗粒,优选挤出条件及改性辅料比例,以期同时达到载药颗粒的耐酸与肠溶性能要求。
1 仪器与试药
1.1仪器 SJ20-10单螺杆挤出机(张家港市惠平机械有限公司),SP-756紫外分光光度计(上海光谱仪器有限公司),ZB-3A自动溶出仪(天津市天大天发科技有限公司),Setsys Evolution差示扫描量热分析仪(法国塞塔拉姆仪器公司)。
1.2试药 阿司匹林(南京景竹生物科技有限公司,含量:98%,批号:JZ1711260),HPMCAS(武汉远程共创有限公司,批号:160716180),羟丙甲纤维素(hydroxypropyl methyl cellulose,HPMC,安徽山河药用辅料有限公司,批号:171206),乙基纤维素(ethyl cellulose,EC,安徽山河药用辅料有限公司,批号:170618),胶态二氧化硅(Evonik Degussa Gmb,批号:157041416),气相二氧化硅(Evonik Degussa GmbH,批号:059920001200),多孔二氧化硅(GRACE,批号:5210177091),硬脂酸镁(安徽山河药用辅料有限公司,批号:150418),十八醇(源叶生物有限公司,批号:Y08M9555357),丙烯酸树脂(上海昌为医药辅料有限公司,Eudragit®S、L,批号:B50805076,B20701416);其余试剂均为分析纯。
2 方法与结果
2.1肠溶材料的筛选 分别以丙烯酸树脂L型和S型、HPMCAS为肠溶载体,3%滑石粉为润滑剂,固定阿司匹林与载体比例为1:5,制备粉末物理混合物;挤出温度130 ℃,待细丝挤出后,冷却,切割细丝为短棒状颗粒,得到阿司匹林载药颗粒。
结果表明,以HPMCAS为肠溶材料时,细丝于110~140 ℃均可顺利挤出,且扭矩较小,冷却后可得淡黄色颗粒,无变性与焦糊状物质出现。但丙烯酸树脂熔融后黏性较大,挤出扭矩过高,出料量少。因此,以HPMCAS为肠溶载体进行后续研究。
2.2体外溶出度测定 精密称取阿司匹林固体分散体颗粒适量,按照2015年版《中华人民共和国药典》四部通则0931溶出度与释放度测定法中的篮法(方法2)测定。以0.1 mol·L-1盐酸(HCl)900 mL为溶出介质,温度(37±0.5)℃,转速75 r·min-1,2 h取样后弃去酸液,立即加入pH值6.8磷酸盐溶缓冲液(phosphate buffer saline,PBS)900 mL。分别在5,10,15,20,30,45,60,90,120 min取溶液10 mL,同时补加等量、等温介质,将溶液用溶出介质定量稀释,摇匀,照紫外-可见分光光度法,在276 nm波长处测定吸光度。计算样液中阿司匹林浓度及颗粒在各时间点累积溶出度(%)。
2.3辅料的筛选 分别以不同改性辅料:HPMC、EC、十八醇、丙烯酸树脂 S或L;不同润滑剂(滑石粉、疏水微粉硅胶、多孔微粉硅胶、亲水微粉硅胶),在挤出温度130 ℃下制粒,观察挤出过程是否顺利。所得颗粒分别测定pH值1.2盐酸中耐酸性及PBS(pH值6.8)缓冲液中体外溶出度(图1)。

图1 不同处方颗粒在PBS(pH值6.8)缓冲液中溶出曲线
结果表明,滑石粉用量>5%时才能达到较好润滑效果。不同微粉硅胶处方溶出曲线见图1。疏水性微粉硅胶润滑效果最佳,亲水性微粉硅胶略微提升了阿司匹林溶出度。微粉硅胶作为润滑剂用量低,因此选择3%疏水微粉硅胶为润滑剂。
比较不同改性辅料溶出行为发现,在pH值1.2盐酸中,HPMC作为改性材料所得颗粒的溶出度达10.73%,其余改性材料所得样品均低于10%;其中,十八醇作为改性材料所得样品在PBS(pH值6.8)缓冲液中溶出最快。因此以十八醇为改性辅料进一步优化肠溶颗粒处方。
2.4星点设计-效应面法优化阿司匹林肠溶颗粒处方 在单因素实验基础上,选取2个对阿司匹林肠溶颗粒溶出行为影响较大的因素,即总辅料用量(X1)和改性辅料占总辅料百分比(X2),并以pH值1.2人工胃液中2 h溶出度(Y1)与PBS(pH值6.8)缓冲液中45 min溶出度(Y2)作为评价指标,采用星点设计法进行处方优化。各考察因素及其水平设计见表1,各实验组处方见表2。
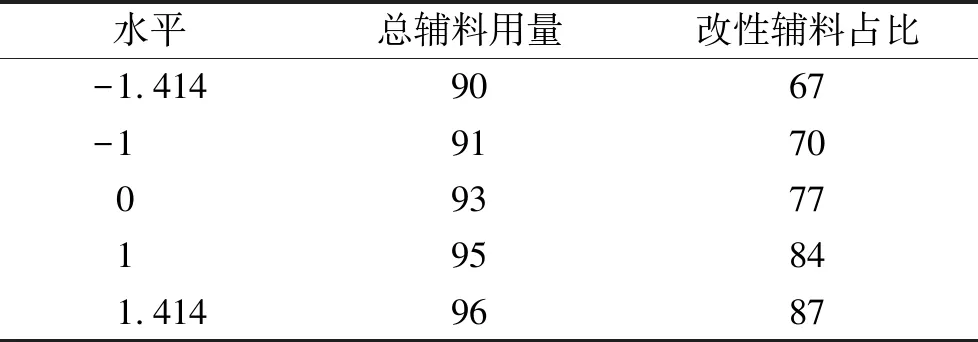
表1 星点设计因素水平
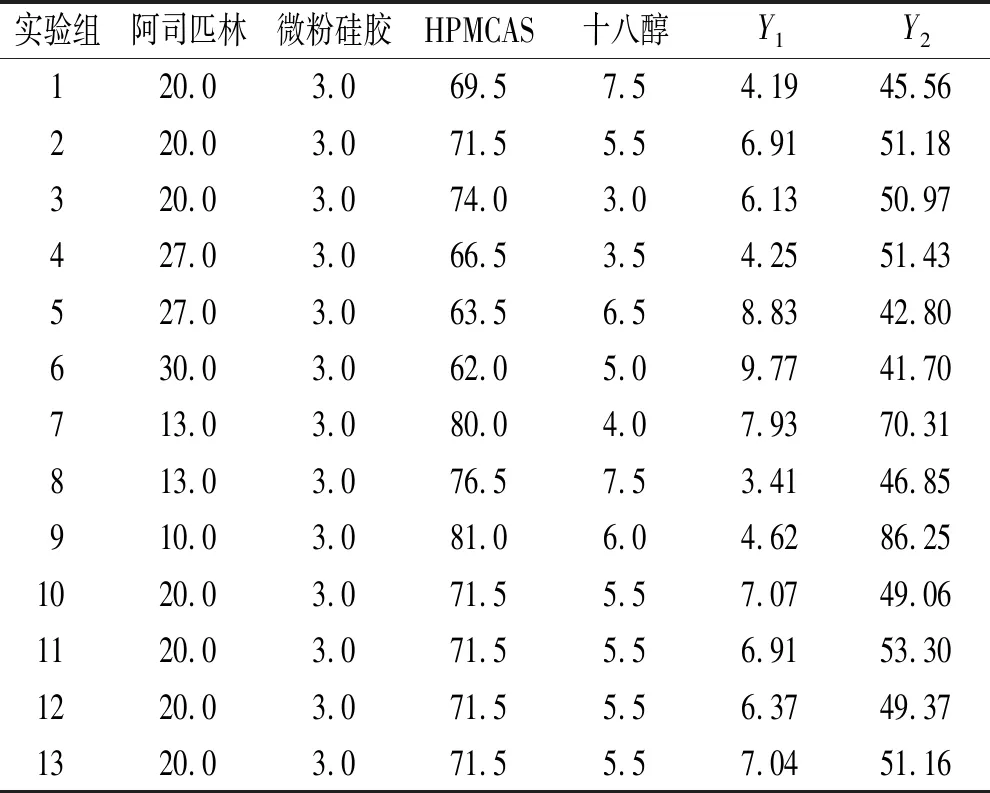
表2 各实验处方
分别按以上处方制备颗粒,测量其耐酸性与45 min时PBS(pH值6.8)缓冲液中溶出度。
使用Design-Expert 8.0版软件对实验结果进行多元回归拟合,得模拟方程R1=-114.630 11+16.845 08A+1.822 47B-0.162 52AB-0.321 36A2-5.493 20E-003B2,(R2=0.805 2;模型:F=5.79,P=0.019 8;失拟:F=1.14,P=0.434 2);R2=-43.597 40-2.709 85A+1.534 51B,(R2=0.535 3;模型:F=5.76,P=0.021 7;失拟:F=1.24,P=0.435 1)。
响应面分析见图2,3D响应面叠加后中心点为最优处方范围。
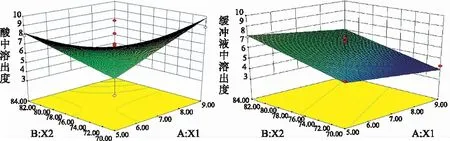
图2 3D响应面图
通过软件计算,阿司匹林肠溶颗粒最佳处方为:主药13.0%,HPMCAS 79.8%,十八醇4.2%,微粉硅胶3.0%。预测pH值1.2中2 h溶出度为7.69%,PBS(pH值6.8)缓冲液中45 min溶出度71.75%。根据上述优化处方制备3批样品进行体外溶出度实验(图3)。最终耐酸条件下溶出度(9.1±0.56)%,PBS(pH值6.8)缓冲液中45 min溶出度为(72.42±3.06)%。实测值与预测值偏差0.93%,预测效果较好。

图3 最优处方在PBS(pH值6.8)缓冲液中的体外溶出曲线
2.5差示扫描量热(differential scanning calorimetry,DSC)分析 采用DSC法,分别测定载药肠溶颗粒、HPMCAS粉末、物理混合物粉末、阿司匹林原料药,升温速度10 ℃·min-1,加热范围20~250 ℃,测量条件:氮气保护,结果见图4。

a.肠溶颗粒;b.HPMCAS;c.物理混合物;d.阿司匹林原料药。
阿司匹林在125 ℃下有明显吸热峰,HPMCAS辅料无吸热峰,物理混合物吸热峰位置与阿司匹林原料药基本一致,说明物理混合物中阿司匹林仍然处于晶体形态。而肠溶颗粒则显示阿司匹林特征吸热峰完全消失,表明阿司匹林已高度分散于载体材料HPMCAS中形成固体分散体。
3 讨论
HPMCAS在200 ℃以下对热稳定[6],其抗张强度与韧性较佳,温度越高,熔融黏度越低,应用于熔融挤出法时的可操作性较好[3]。HPMCAS有较强抑晶作用[7],对热稳定且熔融性好,其熔融温度略高于阿司匹林玻璃化温度。药物与载体熔融后软化温度相近[8],保证了药物以分子或无定型态分散在载体中,适宜制备固体分散体;载体肠溶性质解决了阿司匹林不宜在胃中释放的问题[9],改善了其溶出度。
阿司匹林对胃有较大刺激,在小肠吸收,为实现肠溶效果,以往的制剂多为溶蚀型骨架结构或肠溶膜控释制剂[10],制备方法与包衣工艺复杂。以丙烯酸树脂为肠溶材料,采用溶剂挥发法制备阿司匹林固体分散体也有报道[11],溶剂挥发法制得的固体分散体为粉末状态,还需进一步筛选填充剂处方、压片后制成最终片剂,工艺步骤较多。
熔融挤出法制备阿司匹林肠溶颗粒,不仅能实现耐酸性与肠溶要求,且制备工艺简单,易于控制,重复性好,利于大规模生产。
笔者在本实验通过结合熔融挤出法与肠溶材料HPMCAS,一步法制备了阿司匹林肠溶颗粒,DSC分析显示该颗粒呈固体分散体,为肠溶制剂新技术的开发应用提供了参考。
