盐酸萘甲唑啉滴鼻液质量评价
2021-03-08李苗童颖乔戈杨园聂小春
李苗,童颖,乔戈,杨园,聂小春
(武汉药品医疗器械检验所,武汉 430075)
盐酸萘甲唑啉滴鼻液为耳鼻咽喉科类非处方药,临床用于变应性鼻炎及炎症性鼻充血、急慢性鼻炎[1-2]。盐酸萘甲唑啉为咪唑啉类衍生物的α-受体激动剂,能直接激动肾上腺素受体,也可通过促进肾上腺素能神经末梢释放去甲肾上腺素而间接激动肾上腺素受体,兴奋α和β受体,引起鼻黏膜血管收缩,减少血管渗出物,减轻鼻黏膜肿胀充血,从而减轻炎症所致充血和水肿。但同时也可引起全身小动脉和小静脉收缩,使外周阻力明显增加,导致血压升高,微循环障碍,并容易透过血脑屏障,影响呼吸中枢和体温调节中枢,产生较严重的不良反应[3-7]。盐酸萘甲唑啉滴鼻液由美国Allergan公司于1972年研发上市,《美国药典》(USP)28版开始收载;中国国家卫生部标准1989年开始收载盐酸萘甲唑啉原料药及滴鼻液,《中华人民共和国药典》2000年版开始收载盐酸萘甲唑啉原料药及滴鼻液。笔者检索国家药品监督管理局网站,发现国内有33家企业生产盐酸萘甲唑啉滴鼻液,涉及批准文号50个,规格2个。
盐酸萘甲唑啉滴鼻液为2017年国家计划抽验品种,我所对来自生产和流通环节的262批次样品进行了法定检验和探索性研究,笔者在本文综合分析目前市售盐酸萘甲唑啉滴鼻液质量状况。
1 抽样情况
本次抽取的盐酸萘甲唑啉滴鼻液样品共262批,生产批号175个。全部样品涉及批准文号10个,占全部批准文号的20%;涉及生产企业10家,占全部企业的30%;涉及处方规格2个(0.05%,0.1%)及包装规格2种(8 mL,10 mL)。抽样涉及全国31个省、自治区、直辖市,其中在经营环节抽样254批,占全部样品的96.9%,生产环节抽样8批,使用环节未抽样。本次抽取的样品同批号情况较普遍。
2 法定检验
262批样品中,7批执行《中华人民共和国药典》2010年版二部标准,其他均执行《中华人民共和国药典》2015年版二部标准。两个标准完全相同,包括性状、鉴别、pH值、装量、微生物限度、含量测定,均不控制有关物质和渗透压摩尔浓度。
3 探索性研究
通过对10家企业进行文件调研和电话调研,笔者确定了有关物质、抑菌剂、渗透压摩尔浓度等几个重点研究方向:法定标准不控制有关物质,需建立合适的分析方法考察本品的杂质水平;本品为多剂量滴鼻液,处方中含有抑菌剂,各企业使用的种类和含量不一致,也需要建立方法考察抑菌剂含量;《中华人民共和国药典》2020年版制剂通则要求鼻用液体制剂应等渗,但法定标准中未检查渗透压摩尔浓度,故需要考察本品的渗透压整体水平。
4 结果
4.1法定检验结果 262批样品法定检验合格率为95.4%,12批样品不合格。不合格样品包括性状不合格1批(溶液显微黄色),含量不合格11批,全部由A企业生产。
4.1.1性状 盐酸萘甲唑啉滴鼻液应为无色澄清液体。不合格样品显黄色,检验时已接近有效期。该批次样品采用每盒50支大包装,无单独纸盒包装,且塑料瓶遮光性能不好,不能满足说明书中“遮光”的贮藏要求。
4.1.2含量测定 11批样品的含量不合格,结果在85%~88%,均由A企业生产,供试品溶液色谱图中存在明显未知物峰。虽然其他企业样品含量均符合规定,但部分企业结果显著偏高,B企业部分样品含量高达109%。全部262批样品含量测定结果分布见图1。
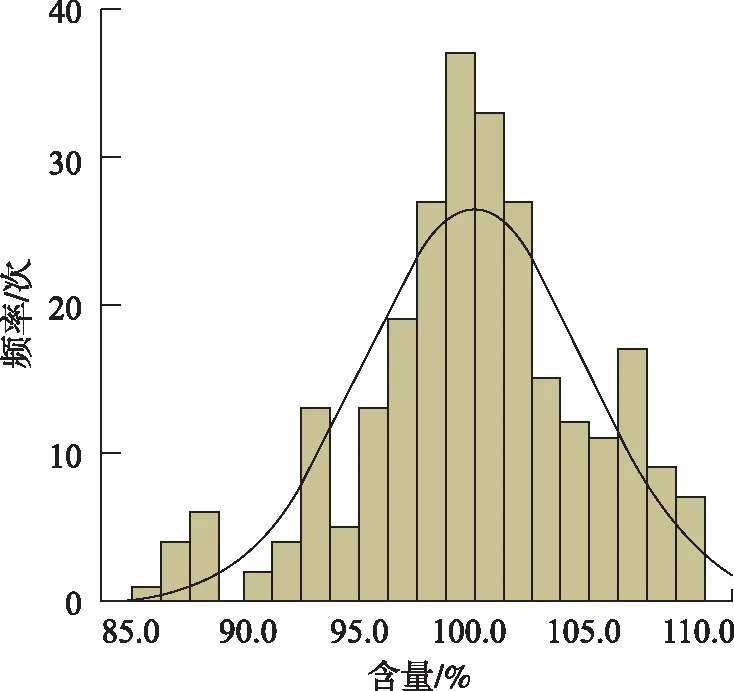
图1 含量测定分布频次图
4.2探索性研究 重点对有关物质、抑菌剂、渗透压摩尔浓度等进行探索性研究。
4.2.1有关物质 盐酸萘甲唑啉分子中存在二氢咪唑基团(图2),其中亚胺结构稳定性较差,易水解开环生成杂质A(萘乙酰乙二胺),并进一步水解生成杂质B(萘乙酸)。杂质A、杂质B、杂质C与杂质D均收载于《欧洲药典》(EP)10版盐酸萘甲唑啉原料药有关物质项下。盐酸萘甲唑啉滴鼻液为液体制剂,萘甲唑啉在水溶液中更容易水解开环,故本品中可能存在有关物质。
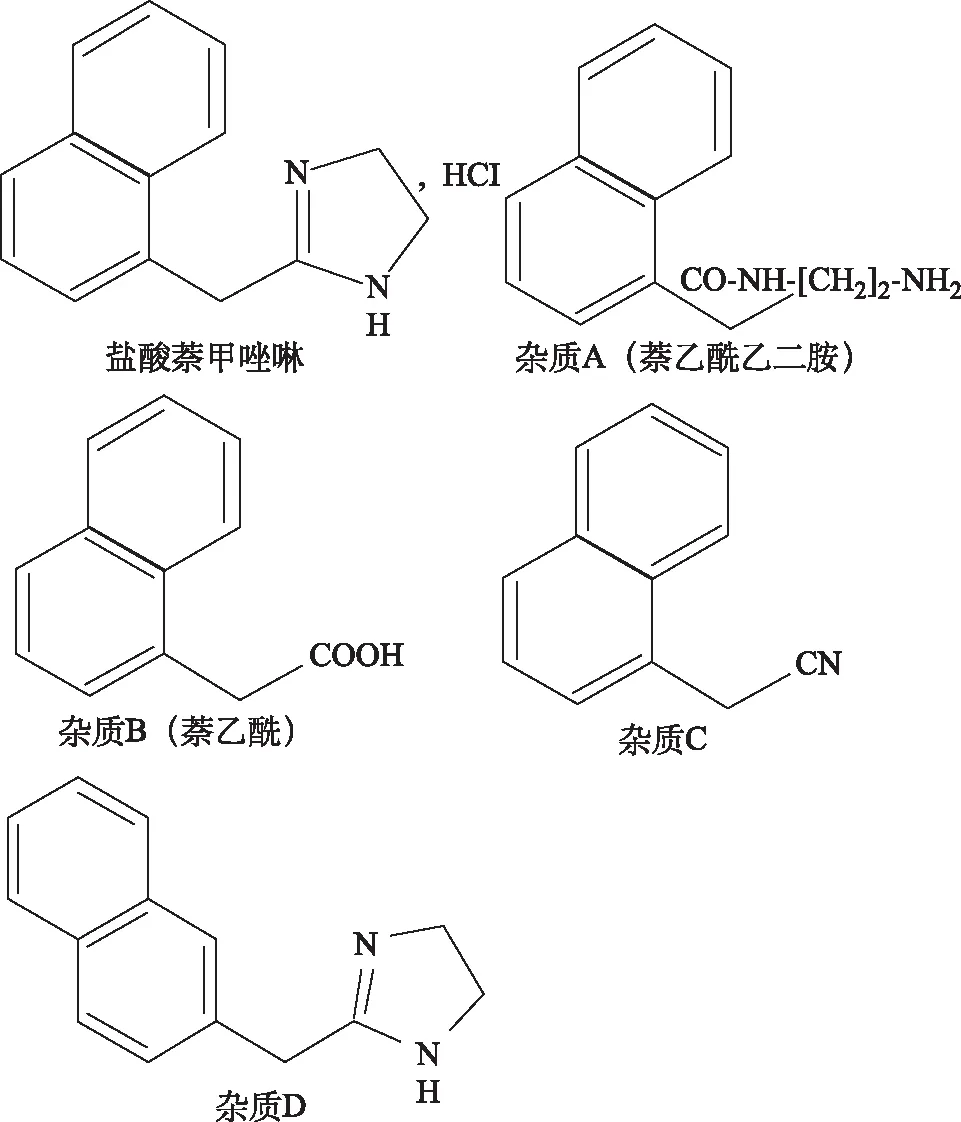
图2 盐酸萘甲唑啉及杂质结构
参考国内外药典方法和文献[8-12],建立新的高效液相色谱(HPLC)法,该法可将主成分、各已知杂质、处方中各种抑菌剂完全分离(图3),适用于同时测定不同处方中盐酸萘甲唑啉、杂质A~D含量,并进行方法学研究。采用Waters Symmetry C8色谱柱(150 mm×3.9 mm,5 μm),以磷酸盐缓冲液(pH值5.6)(取无水磷酸氢二钠14.2 g,加水1 900 mL溶解,加三乙胺20 mL,磷酸调pH值至5.6,加水至2 000 mL)作为流动相A,以乙腈为流动相B,洗脱梯度:0→24 min 88%A,24→25 min 88%A→70%A,25→48 min 70%A,48→49 min 70%A→88%A,49→59 min 88%A;流速为1.0 mL·min-1;柱温35 ℃;检测波长270 nm。采用该方法对全部262批样品进行测定,100%样品中检出萘乙酰乙二胺(杂质A),含量范围0.7%~13.6%(图4)。

图3 HPLC专属性分离色谱图

图4 萘乙酰乙二胺含量分布频次图
笔者采用液相色谱-质谱(LC-MS)法对样品中萘乙酰乙二胺进行验证。采用Ultimate XB-C18色谱柱(250 mm×4.6 mm,5 μm),以0.05 moL·L-1醋酸铵缓冲液(pH值5.6)(用冰醋酸调pH值至5.6)-乙腈(85:15)为流动相,流速1.0 mL·min-1;柱温35 ℃。采用API 4000三重四级杆液相质谱联用仪(AB Sciex Instruments公司),电喷雾离子化(electrospray ionization,ESI)模式,气帘气(curtain gas CUR):0.14 MPa(20 psi),碰撞气(collision gas,CAD):0.06 MPa(8 psi),离子化电压(ionspray voltage,IS):-5500 V,温度(temperature,TEM):500 ℃,喷雾气(ion source gas1,GS1):0.28 MPa(40 psi),喷雾气(ion source gas2,GS2:0.28 MPa(40 psi);定性离子对为229.3/141.2与229.3/212.2(图5)。
进口药品马来酸非尼拉敏盐酸萘甲唑啉滴眼液中含盐酸萘甲唑啉,质量标准规定萘乙酰乙二胺不得过盐酸萘甲唑啉标示量10%,说明萘乙酰乙二胺确是盐酸萘甲唑啉主要降解产物。毒理学研究表明,萘乙酰乙二胺为低毒化合物,半数致死剂量(LD50)=848 mg·kg-1。笔者重点从强制降解实验、加速稳定性实验等方面入手,研究盐酸萘甲唑啉降解生成萘乙酰乙二胺的途径和机制。

图5 萘乙酰乙二胺质谱图
按照《中华人民共和国药典》2015年版四部通则9102药品杂质分析指导原则要求,取盐酸萘甲唑啉原料药,分别在酸、碱、加热、氧化、光照条件下进行强制破坏,同时采用二极管阵列检测器(diode array detector,DAD)光谱和LC-MS联用技术利用欧洲药典(European Pharmacopoeia,EP)杂质A对照品对主要降解产物进行了结构确证。结果表明,温度和碱性环境是导致盐酸萘甲唑啉降解最主要的因素(图6)。

图6 盐酸萘甲唑啉强制降解实验色谱图
盐酸萘甲唑啉为咪唑啉类衍生物,结构中存在二氢咪唑基团,其中亚胺结构稳定性较差,盐酸萘甲唑啉在碱性条件下降解的反应机制如下(图7),加热能显著提高反应速度。
《中华人民共和国药典》2015年版四部通则9001原料药物与制剂稳定性实验指导原则要求包装在半透明容器中的液体制剂,应在40 ℃下放置不同时间进行稳定性考察。笔者将样品在40 ℃放置28 d,结果全部企业的样品中萘乙酰乙二胺的含量均较原来水平有显著增加(图8)。说明流通环节环境温度如果偏高,也会加速萘甲唑啉降解,导致来自不同地区相同批号样品含量测定结果不一致。
A企业有11批样品中杂质A含量超过10%,笔者通过对A企业进行调研,了解到该企业从配液到成品打包全过程持续约8 h,期间没有降温步骤,药液温度维持50~60 ℃,最后入常温库储存,自然降温。企业同时反映生产时按100%投料,但成品检验含量结果往往仅约97%,即刚生产出来含量就会降低3%。说明因生产过程中温度较高,盐酸萘甲唑啉降解速度较快,导致该企业样品中杂质A含量普遍偏高。
4.2.2过量投料 部分企业在本品的长期稳定性实验中发现盐酸萘甲唑啉含量随着储存时间延长而降低,但由于法定标准中无有关物质检查项,因此企业未对生产工艺和降解产物进行研究来避免降解发生,而是通过过量投料来保证本品在有效期内含量始终符合规定。因此B企业多批样品的含量达到109%。
4.2.3抑菌剂 本次抽样涉及10家企业,6家企业采用硫柳汞为抑菌剂,处方量为0.01%与0.002%;1家企业使用羟苯乙酯(0.03%),1家企业使用羟苯乙酯(浓度未知),1家企业使用苯甲酸钠(0.01%),1家企业采用苯扎溴铵(0.01%)。均同时使用依地酸二钠为稳定剂,以发挥协同抑菌作用。
笔者采用《中华人民共和国药典》2015年版标准提高课题“滴眼剂中抑菌剂的含量测定方法研究”中HPLC方法,同时测定盐酸萘甲唑啉滴鼻液中的多种抑菌剂,并进行方法学研究。课题中建议抑菌剂含量应为标示量80%~120%,全部262批样品有54批样品不合格,主要是多批样品中硫柳汞含量高出限度范围,说明部分企业在生产中存在过量添加抑菌剂的情况。硫柳汞作为含汞化合物,目前世界卫生组织(WHO)、美国食品药品管理局(FDA)已建议其不再用于药品及疫苗,且滴鼻液易通过血脑屏障,因此过量添加硫柳汞等抑菌剂存在一定临床风险。
4.2.4渗透压摩尔浓度 笔者对全部262批样品进行渗透压摩尔浓度测定,绝大部分企业样品渗透压摩尔浓度>330 mOsmol·kg-1(图9)。《中华人民共和国药典》2015年版二部盐酸萘甲唑啉滴眼液项下要求渗透压摩尔浓度比应为0.9~1.1。根据这个要求来判断,仅25批样品符合要求,合格率9.5%,说明多数企业在处方设计时未考虑等渗要求。
5 结束语
市售盐酸萘甲唑啉滴鼻液中均检出萘乙酰乙二胺等有关物质,主要原因有3点:①盐酸萘甲唑啉的稳定性较差,在高温及偏碱性环境下即可发生降解,生成萘乙酰乙二胺;②部分企业生产工艺不合理,生产过程中没有控制温度,导致盐酸萘甲唑啉快速降解;③流通环节未严格控制温度,说明书上贮存条件不合理,导致同批号样品在不同地区抽样含量结果差异较大。另外还存在硫柳汞等抑菌剂含量偏高、渗透压摩尔浓度偏高导致不等渗等问题。

图7 盐酸萘甲唑啉碱破坏反应机制

图8 加速实验中杂质A含量
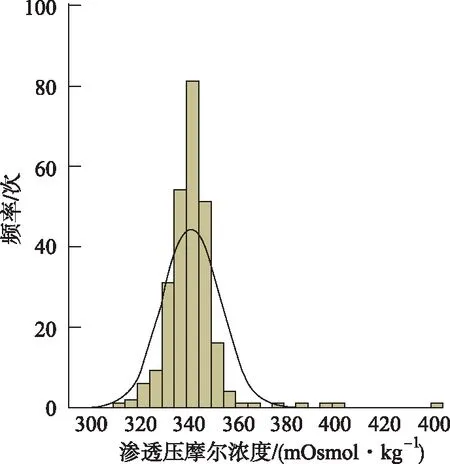
图9 渗透压摩尔浓度分布频次图
盐酸萘甲唑啉为五官科经典老药,临床常用作滴鼻液和滴眼液。因其使用历史悠久且价格低廉,生产企业大多忽视了盐酸萘甲唑啉的理化特性对药品质量的影响。本实验反映了国产鼻用制剂的普遍问题,即质量标准简单,早期设计处方工艺没有经过深入研究,质量控制不全面。考虑到本品多为易过敏人群使用,且鼻用制剂易通过血脑屏障,可能存在用药安全隐患。建议生产企业采取改进工艺、重新设计处方、控制流通环节温度等多种措施降低盐酸萘甲唑啉滴鼻液有关物质水平,同时提高质量标准、修订药品说明书来保障药品质量;建议关注硫柳汞作为抑菌剂的安全性和替代方案,提高国产鼻用制剂处方的合理性和有效性,保证国产鼻用制剂的安全有效。
