高中化学教学中宏观微观联系与模型认知的运用
——以碱金属密度变化和甲烷键角计算为例
2021-03-08徐音辰
徐音辰
(上海外国语大学尚阳外国语学校 上海 200333)
高中化学学习中,涉及到物质微观结构的部分,例如分子空间构型,物理性质变化规律等,学生想理解透彻往往比较困难,部分学生只能采取死记硬背的方法。这样的学习模式不利于化学学科核心素养的培养和落实。高中化学核心素养中与物质结构学习相关的素养为“宏观辨识与微观探析”和“证据推理与模型认知”。[1]
前者是化学学科解决问题的重要思维视角,“宏观”指的是物质的性质及存在状态,这些表现具有肉眼可观察或仪器能展现,“微观”指基本粒子层面探究和分析物质的组成、结构、性质。[2]
后者则要求“建立认知模型,并能运用模型解释化学现象,揭示现象本质和规律”。教师应深入理解并挖掘教材文本中蕴含的核心素养的培养目标,并指导课堂教学。教师应重视课堂中实物模型、思维模型、数学模型的功能与价值。[3]
下面以笔者教学过程中与“物质结构”相关的两个案例为例,具体分析一下知识背后如何体现核心素养。
1.碱金属的密度并没有严格递变,其中钾是反常的
一堂组内年轻教师的习题讲评课中,针对一道例题中学生提出的质疑,在课后教师讨论中引出了碱金属密度并非严格递增,钾比钠略小,详见表1。笔者以前讲周期律的时候都不会太在意密度的递变规律,觉得大趋势是密度变大的就行了呗。而且这也不算一个常规“考点”。但研讨过程中教师们都认为:既然问题被发现了,而且教材中明确给出了密度的数据,教师就应该根据宏观现象推测微观结构寻求满意的解释。

表1 碱金属的主要性质
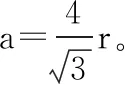
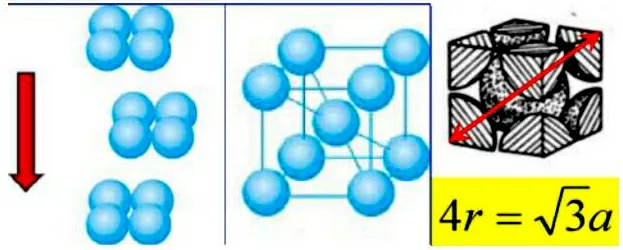
图1 碱金属的堆积方式及晶胞参数
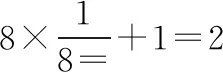
由于碱金属都是一种堆积方式,所以z不变,同样不变的常数一并约去,就得到密度ρ正比于M/r3的结论。可见,碱金属的密度受其摩尔质量和半径的共同影响。下面就以锂、钠、钾分别计算。
Li∝7/0.1523Na∝23/0.1863K∝39/0.2273
观察后发现,从锂到钠,表达式中分子扩大3倍多,分母只扩大了大约1.83倍;而从钠到钾,分子扩大了约1.7倍,分母扩大了约1.8倍。这样就从微观角度,构建几何模型解释出钾密度的“反常”现象了。
2.甲烷的键角为什么是109°28′?
学习有机化学中,接触到最简单的有机物甲烷,学生都容易说出其空间结构为正四面体,键角为109°28′。那么为什么这种结构和键角呢?其实这并不难推出,利用中学几何知识,建立好数学模型,完全就能解答。
我们先从杂化轨道开始说起。碳的价电子为4,但是4个电子分别处于2s和2p轨道上,且2s上的为成对电子。我们知道当两个原子都有未成对电子时就能形成一对共用电子对,也就形成了共价键。所以要形成CH4,按碳原有的轨道“安排”与氢原子成键就不太妥当。为了解释成键,美国化学家鲍林提出了杂化轨道理论,s和p轨道以一定方式形成杂化轨道来成键,这种成键是更稳定的。甲烷形成的是sp3杂化轨道,其轨道形状是正四面体。与碳成键的其他原子相同时,按照最大重叠原理所形成的分子结构也是正四面体,所以甲烷分子中,碳原子位于体心,四个氢原子位于顶点。
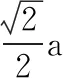
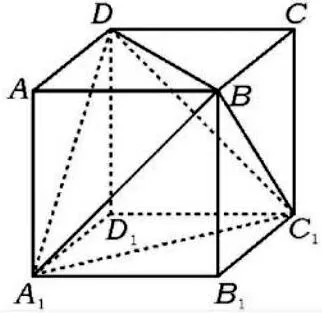
图2 正四面体外接正方体
以斜切面AA1CC1为观察视角,再利用一次勾股定理,体对角线为所以正四面体体心到顶点距离(其实R也可以理解为正四面体外接圆的半径)
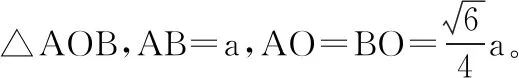
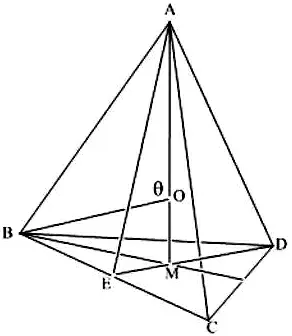
图3 构建模型中的θ相当于甲烷分子键角
联系几何中角度制60分为一度,所以109.47°=109°28′(当然两者都只保留了5位有效数字)
以上两个例子中都是教师教学过程中容易忽略的问题,教师和学生可能就参与简单记忆的手段,并没有深入挖掘成因。笔者在求解过程中充分利用了宏观辨析与微观探析和证据推理与模型认知的素养,而运用到的基础知识中学生也是具备的,教师完全可以给学生解释,并在教学中培养和提升学生的思维能力。
