不同代数SD大鼠骨髓间充质干细胞体外增殖和成骨分化能力的实验研究
2021-03-07王冬佳
王冬佳, 张 雄
(浙江大学医学院附属杭州市第一人民医院口腔科,浙江 杭州 310006)
口腔颌面部创伤、炎症、肿瘤及先天畸形所致的颌骨缺损会给患者的生理和心理带来极大的伤害[1-2]。因此,颌骨缺损的治疗一直受到口腔医生的重视。近年来,组织工程作为一门新兴的交叉学科,发展迅速。将种子细胞和支架材料相复合的骨组织工程为颌骨缺损的功能修复与重建提出了新思路,其已成为当前的研究热点之一[3-4]。
种子细胞和支架材料构成了组织工程的核心部分[5-6]。其中,骨髓间充质干细胞(BMSCs)因其易于分离培养、增殖能力强及免疫原性低,被认为是最理想的种子细胞[7-8]。但是,正常动物细胞在体外培养条件下并不是无限增殖的。体外培养中的大多数细胞仅在有限的时间内维持生长,然后自行停止生长[9]。这种培养过程中所呈现的细胞增殖极限现象最初由Hayflick[10]在1961年观察到,称为“Hayflick极限”。
已有的研究表明,间充质干细胞(marrow mesenchymal stem cells,MSCs)在体外扩增过程中会逐渐老化[11-12]。然而在实验研究中,研究者往往会使用不同代数的BMSCs进行各项实验。但是不同的细胞代数是否会对BMSCs的基本生物学特性产生影响,细胞体外增殖和成骨分化能力是否一致,细胞代数在几代以内可以用于实验研究而不影响实验结果,这些未曾报道过。在本研究中,通过比较P1、P3、P5、P7、P9 代 BMSCs的细胞形态、体外增殖和成骨分化能力,分析不同代数BMSCs在实验研究中是否对实验结果有影响。
1 材料和方法
1.1 材料
1.1.1实验动物 4周龄雄性SD大鼠由浙江大学医学院附属杭州市第一人民医院实验动物中心提供。
1.1.2实验仪器 超净工作台、细胞培养箱和离心机购于德国Heraeus公司;酶标仪、电子分析天平和扫描仪购于瑞士Tecan公司;倒置显微镜购于日本Nikon公司;流式细胞仪购于美国BD公司;PCR仪购于瑞士Roche公司。
1.1.3实验试剂 DMEM培养液购于美国Hyclone公司;胰蛋白酶和胎牛血清购于美国Gibco公司;青链霉素溶液购于美国Invitrogen公司;CCK-8试剂盒购于日本同仁公司;细胞凋亡检测试剂盒、结晶紫溶液和ALP试剂盒购于中国碧云天生物技术有限公司;逆转录试剂盒和TRIzol试剂盒购于日本TaKaRa公司。
1.2 方法
1.2.1大鼠BMSCs原代培养、传代和鉴定 采用骨髓贴壁培养法分离、培养BMSCs。将SD大鼠颈椎脱臼处死后置于75%乙醇中浸泡15 min,于超净工作台内取大鼠双侧股骨、胫骨,用完全培养液反复冲洗骨髓腔,收集冲洗液,1 800 r/min的转速下离心10 min。将其接种于直径为10 cm的细胞培养皿中,并置于CO2培养箱内。当细胞生长密度达到90%左右时,常规消化、离心,按1∶3的比例传代,随着细胞传代,细胞进一步纯化、扩增,得到P1代BMSCs。按同样的步骤获得P3、P5代BMSCs。取生长良好的BMSCs,待细胞生长密度达90%时,常规消化、离心,制成5×104个/mL的细胞悬液,以每皿1 mL的量接种于荧光小皿中,置于培养箱内培养,过夜。4%多聚甲醛固定细胞,0.3%Triton X-100溶液室温作用15 min。5%二喹啉甲酸(bicinchoninic acid,BCA)室温封闭1 h,滴加1∶100稀释比例的一抗CD44、CD90、 CD31、CD34,置 4 ℃过夜。室温复温 1 h,4′,6-二脒基-2-苯基吲哚 (4′,6-diamidino-2-phenylindole,DAPI)复染5 min,封片,荧光显微镜下采集图像。
1.2.2细胞形态学观察 分别取 P1、P3、P5、P7、P9代BMSCs,0.25%胰酶消化、离心,弃上清液,配制密度为1×106个/mL的细胞悬液。将配好的细胞悬液接种于6孔板中,每孔2 mL,置于培养箱中培养72 h后,倒置相差显微镜下采集图像。将以上细胞弃去培养液,4%多聚甲醛置室温下固定30 min,磷酸盐缓冲液(phosphate buffered saline,PBS)漂洗 3 次,每次5 min,用鬼笔环肽对细胞骨架进行染色,将红色鬼笔环肽以1∶500的比例稀释后滴加在爬片上,于室温下染色30 min,PBS漂洗3次,每次5 min。以1∶500的比例稀释DAPI,置室温染色5 min。封片剂封片,荧光显微镜下采集图像。
1.2.3CCK-8法测定BMSCs生长曲线 分别取P1、P3、P5、P7、P9 代 BMSCs,制作细胞悬液,将细胞接种于96孔板中,每孔含细胞数5 000个,边缘用无菌PBS封闭。分别在第1、3、5、7天时使用CCK-8试剂盒检测细胞生长曲线。每孔加入10 μL的CCK-8溶液,置于37℃培养箱中孵育2 h,酶标仪于450 nm波长处检测吸光度值。
1.2.4流式细胞术检测细胞凋亡 细胞常规消化、离心,配制密度为1×106个/mL的细胞悬液,将其接种于6孔板中,培养24 h后,消化、离心,弃上清液,1×Binding缓冲液重悬细胞,使细胞密度达1×106个/mL,取100 μL到一个新的流式管中。选取3管正常细胞作为补偿管:①双阴性-正常细胞,不加入任何抗体;②Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)补偿管,加入 Annexin V-FITC 抗体5 μL;③碘化丙啶(propidium iodide,PI)补偿管,加入PI抗体5 μL。加入Annexin V-FITC抗体5 μL和PI抗体5 μL,置避光室温 30 min。 最后加入 400 μL 1×Binding缓冲液,上机检测细胞凋亡率。
1.2.5ALP染色及定量分析 分别取 P1、P3、P5、P7、P9代BMSCs接种于24孔板中,接种密度为5×104个/孔,培养24 h后更换成骨诱导液培养。7 d后弃去培养液,4%多聚甲醛固定细胞15 min后,加入 ALP染色液,37℃避光孵育30 min。然后进行ALP半定量分析,培养皿里加入 RIPA裂解液,冰上裂解 30 min,用蛋白定量试剂盒检测总蛋白浓度,使用ALP半定量试剂盒检测ALP浓度。最后用测出的ALP浓度除以总蛋白浓度计算出ALP半定量的结果。
1.2.6茜素红染色及定量分析 分别取P1、P3、P5、P7、P9代BMSCs接种于24孔板中,接种密度为5×104个/孔,培养24 h后更换成骨诱导液培养。矿化诱导14 d后,4%多聚甲醛固定细胞15 min。配制成质量浓度为1 mg/mL的茜素红染液,每孔加500 μL染液,37℃避光孵育30 min。弃去上清液,加入氯化十六烷基置室温孵育30 min,酶标仪检测590 nm波长处吸光度值。
1.2.7RT-PCR检测基因表达 分别取 P1、P3、P5、P7、P9 代 BMSCs以 5×104个/孔的密度接种于6孔板中,培养24 h后更换成骨诱导液。矿化诱导14 d后,弃上清液,PBS冲洗3次,每次5 min。每孔加入1 mL TRIzol试剂,冰上放置15 min,提取细胞的总RNA。按照逆转录试剂盒说明书操作,将总RNA逆转录为cDNA。应用RT-PCR检测成骨标志物Ⅰ型胶原 A1(COL1A1)和骨钙素(OCN)的基因表达,引物序列见表1。反应条件为95℃变性5 s,55℃退火15 s,72 ℃延伸 10 s,共 40 个循环。使用 2-△△CT法进行相对定向量计算。
1.2.8免疫荧光检测蛋白表达 分别取P1、P3、P5、P7、P9代BMSCs接种于6孔板中,接种密度为5×104个/孔,培养24 h后更换成骨诱导液培养。矿化诱导14 d后,弃去上清液,PBS冲洗3次,每次5 min。4%多聚甲醛固定液固定30 min后,PBS漂洗3次,每次5 min。滴加0.3%的Triton X-100溶液,处理细胞15 min,对细胞进行通透,用PBS漂洗3次。5%牛血清白蛋白(bovine serum albumin,BSA)置室温封闭1 h后,加入1∶200的双标一抗COL1A1/OCN,4℃过夜。室温放置复温1 h后,去除双标一抗,用PBS漂洗3次,每次5 min。滴加双二抗,置室温孵育30 min。用DAPI染液对细胞核进行染色,置室温5 min。荧光显微镜下采集图像。
1.3 统计学方法
所有实验重复3次,结果均以平均值±标准差(±s)表示。使用SPSS 16.0软件对数据进行统计学分析,2组之间定量数值比较采用独立样本t检验,多组之间定量数值比较采用单因素方差分析(analysis ofvariance,ANOVA)。P<0.05为差异具有统计学意义。
2 结果
2.1 大鼠BMSCs的原代培养、传代和鉴定
采用骨髓贴壁法培养大鼠 BMSCs,培养72 h换液时可见部分细胞贴壁,细胞多呈梭性;第4天时,细胞形成较为分散的细胞群落,逐渐扩散并相互交联;第7天时,细胞集落呈漩涡状排列,基本铺满培养皿,细胞生长密度可达80%左右。免疫荧光染色鉴定大鼠BMSCs,结果显示CD44和CD90在细胞膜上呈阳性表达,而CD31和CD34未见荧光(图1)。
2.2 细胞形态学观察
2.2.1光学显微镜观察 如图2所示,P1、P3、P5代BMSCs呈多角形,细胞之间相互交联,细胞质饱满,状态良好,胞质均匀,核仁清晰,可见核分裂象。而P7、P9代BMSCs胞体相对较小,多呈梭形,细胞之间连接明显减少,细胞皱缩,形态纤细,状态较差。
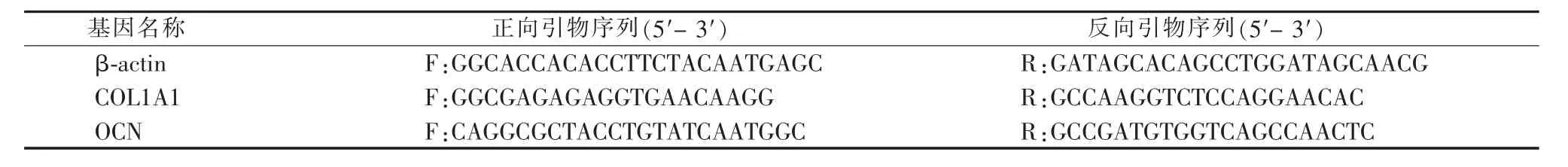
表1 引物序列Table 1 Primer sequence

图1 免疫荧光染色鉴定大鼠BMSCs(×200)Figure 1 Immunofluorescence detection of the cluster of differentiation on rat BMSCs (×200)

图2 光学显微镜下观察不同代数大鼠BMSCs(×100)Figure 2 Microscopic images of BMSCs in rats with different generations(×100)
2.2.2荧光显微镜观察细胞骨架 分别使用DAPI染液和鬼笔环肽对 P1、P3、P5、P7、P9 代 BMSCs细胞核和细胞骨架进行染色,通过荧光显微镜观察细胞的形态改变。如图3所示,P1、P3、P5代BMSCs荧光染色均较强,分布规则且清晰,肌动蛋白(actin)丝染色骨架均良好,胞质饱满,未见明显差异。而P7和P9代BMSCs荧光染色弱,分布不规则,细胞与细胞之间的连接显著减少,细胞皱缩,形态纤细。
2.3 细胞生长曲线
CCK8 检测结果显示,细胞接种后 1~7 d,P3、P5代BMSCs分别与P1代BMSCs增殖率比较,差异无统计学意义(P>0.05);细胞培养 3 d 之内,P7、P9 代BMSCs分别与P1代BMSCs相比,细胞增殖率无明显差异(P>0.05);细胞培养 3 d 之后,P7、P9 代细胞增殖率明显降低,与 P1代BMSCs比较,差异具有统计学意义(P<0.05)。 详见图 4。
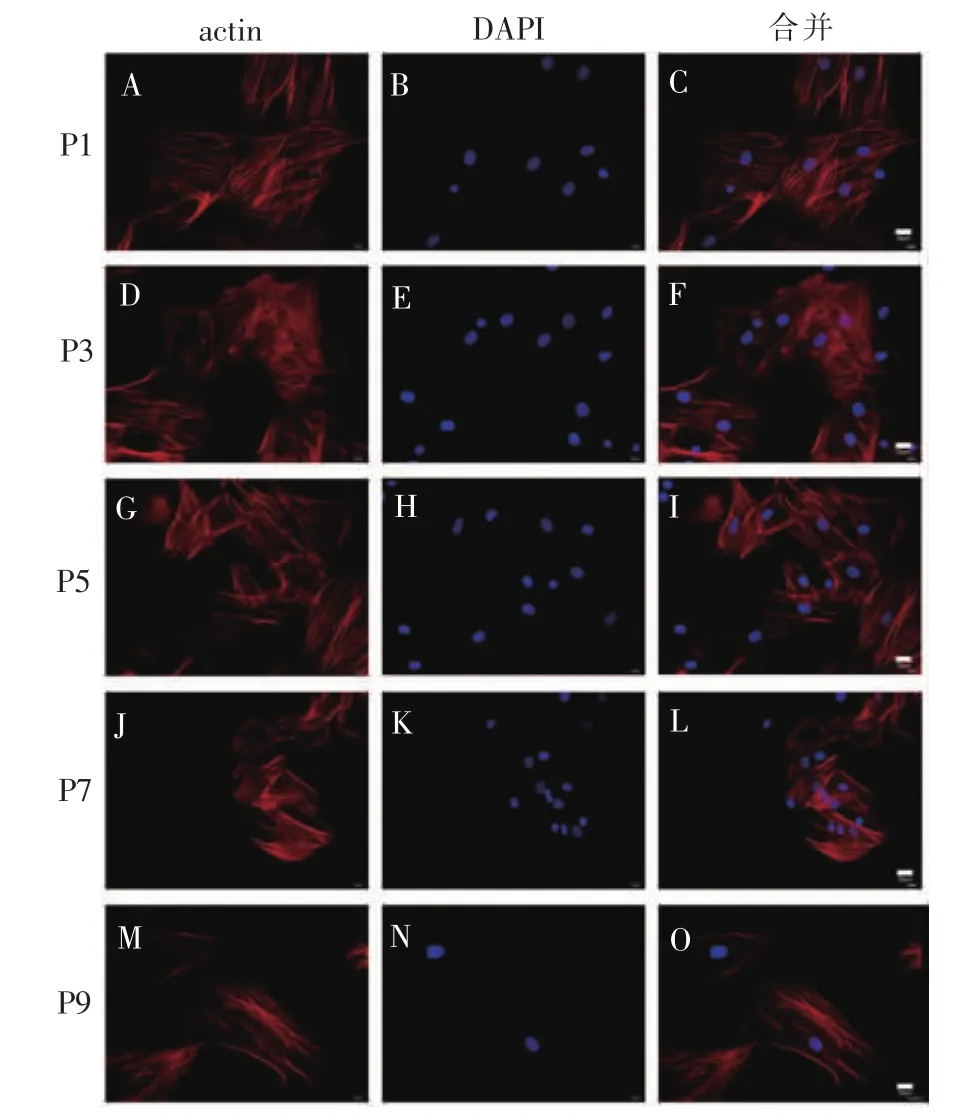
图3 荧光显微镜下观察不同代数大鼠BMSCs(×400)Figure 3 Immunofluorescence staining of BMSCs in rats with different generations(×400)
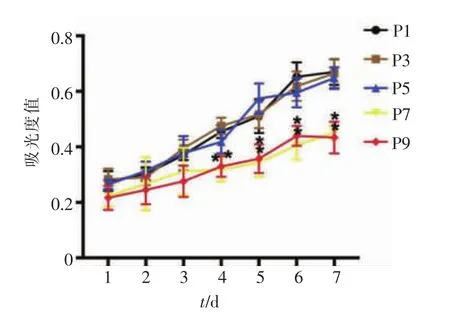
图 4 P1、P3、P5、P7、P9 代 BMSCs 生长曲线Figure 4 The growth curve of BMSCs in P1、P3、P5、P7 and P9
2.4 细胞凋亡分析结果
应 用 流 式 细 胞 仪 检 测 P1、P3、P5、P7、P9 代BMSCs的凋亡情况,图5A为3次流式细胞仪检测结果中的 1次。图5B统计学分析结果表明,P3、P5代BMSCs的细胞凋亡率分别与P1代BMSCs比较,差异无统计学意义(P>0.05);而 P7、P9 代 BMSCs分别与P1代BMSCs相比,差异具有统计学意义(P<0.05)。

图 5 P1、P3、P5、P7、P9 代 BMSCs 细胞凋亡结果Figure 5 Cell apoptosis of BMSCs in P1,P3,P5,P7 and P9
2.5 ALP染色结果
BMSCs矿化诱导7 d后,ALP染色结果显示,不同代数细胞均有蓝色颗粒形成(图6A),而且P1、P3、P5代细胞间的染色结果未见明显差异,P7、P9代细胞染色效果相对较弱。为排除因为接种细胞数量而引起的染色结果误差,每代细胞均同时进行ALP半定量检测。结果显示,P3、P5代BMSCs分别与 P1代BMSCs比较,差异无统计学意义(P>0.05);而 P7、P9代BMSCs分别与P1代BMSCs相比,ALP相对表达量显著降低(图 6B,P<0.05)。
2.6 茜素红染色结果
BMSCs矿化诱导14 d后,茜素红染色结果显示,不同代数细胞均有红色钙结节形成(图7A)。P1、P3、P5代细胞染色结果未见明显差异,P7、P9代细胞染色效果相对较弱。为排除因为接种细胞数量引起的染色结果误差,每代细胞均同时进行茜素红半定量检测。结果显示,P3、P5代BMSCs分别与P1代BMSCs比较,差异无统计学意义(P>0.05);而 P7、P9代BMSCs分别与 P1代BMSCs相比,体外钙结节形成能力显著降低(图 7B,P<0.05)。
图 6 P1、P3、P5 P7、P9 代 BMSCs ALP 活性表达Figure 6 Expression of ALP in P1,P3,P5,P7 and P9 of BMSCs

图 7 P1、P3、P5、P7、P9 代 BMSCs 钙结节形成结果Figure 7 Formation of calcium nodules in P1,P3,P5,P7 and P9 of BMSCs
2.7 RT-PCR检测结果
RT-PCR检测不同代数BMSCs经成骨诱导7 d后,细胞成骨相关基因(COL1A1及OCN)mRNA的表达。以β-actin为内参基因,计算各组基因的相对表达量。如图 8所示,P3、P5代BMSCs分别与P1代BMSCs比较,COL1A1与OCN基因mRNA表达的差异无统计学意义(P>0.05);而 P7、P9 代 BMSCs分别与 P1代相比,其mRNA的表达均显著降低(P<0.05)。
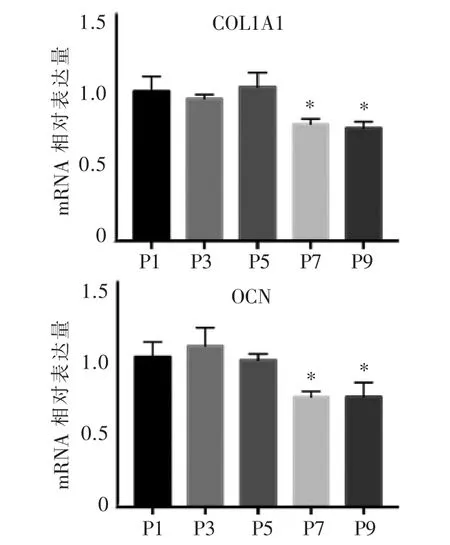
图8 RT-PCR检测不同代数BMSCs COLIA1和OCN mRNA的表达Figure 8 The mRNA expression of COL1A1 and OCN in different generations of BMSCs using RT-PCR
2.8 免疫荧光检测结果
免疫荧光检测不同代数BMSCs经成骨诱导7 d后,细胞COL1A1及OCN蛋白的表达。如图9所示,P1、P3、P5代 BMSCs COL1A1和 OCN 的双标荧光染色效果均较强,P3、P5代BMSCs分别与 P1代比较,COL1A1和OCN蛋白水平无明显差异,P7和P9代BMSCs分别与P1代BMSCs比较,COL1A1和OCN双标荧光染色效果明显减弱。
3 讨论
Friedenstein等[13]于1976年最早发现骨髓中除了造血干细胞外,还存在一类基质干细胞,随即将其命名为间充质干细胞(MSCs)。MSCs是一类具有多向分化能力的干细胞,加之其易于分离培养、增殖能力强及免疫原性低的优点,在再生医学和组织工程中常常被认为是最理想的种子细胞[14]。然而,有研究表明,大鼠BMSCs在体外培养过程中并不是无限制增殖的,会悄悄老化[9,15-17]。但是关于BMSCs在几代以内可以有效地保持其生物活性且不影响实验结果的问题,至今未见报道。本实验通过检测 P1、P3、P5、P7、P9代大鼠BMSCs增殖、凋亡能力,成骨分化和细胞形态学情况来进行相关研究。
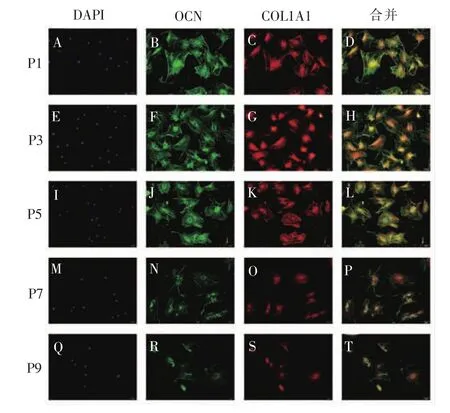
图9 免疫荧光检测不同代数BMSCs COL1A1和OCN蛋白表达(×400)Figure 9 Protein levels of COL1A1 and OCN in different generationsofBMSCsdetected by immunofluorescence staining (×400)
本实验采用骨髓贴壁培养法[18]分离、培养大鼠BMSCs,免疫荧光染色鉴定其干细胞特性[19]。结果显示,细胞在传代过程中,5代以内的细胞形态未见明显改变,光学显微镜下显示细胞呈多角形,细胞集落呈漩涡状排列;而P7、P9细胞胞体相对较小,多呈梭形,形态纤细,细胞与细胞之间间隙明显增宽。荧光显微镜观察细胞骨架的形态,结果显示,P1、P3、P5代BMSCs细胞荧光染色效果均较强,分布规则且清晰,肌动蛋白丝染色明显,细胞骨架形态均良好,胞质饱满,未见明显差异;而P7和P9代BMSCs细胞荧光染色效果弱,分布不规则,细胞与细胞之间的连接体显著减少,细胞皱缩,形态纤细。CCK-8检测细胞增殖能力,结果显示,P1、P3、P5代间BMSCs的增殖能力无明显改变,而P7、P9代细胞增殖能力显著降低。进一步应用流式细胞仪检测细胞凋亡情况,结果显示,P1、P3、P5代BMSCs细胞早期凋亡率无明显改变,而P7和P9代BMSCs细胞早期凋亡率明显升高。本研究证明,5代以内的BMSCs,随着细胞代数的增加,细胞形态、体外增殖能力及细胞早期凋亡率无显著差异,而5代以后,细胞形态改变明显,体外增殖能力显著降低,早期凋亡率明显增高。
ALP染色和茜素红染色半定量分析结果显示,5代以内的BMSCs随着代数的增加,细胞体外成骨分化能力无明显差异,而5代以后,细胞体外成骨分化能力显著下降。骨钙素(OCN)主要由骨和牙齿中的成骨细胞合成并分泌,是一种由成骨细胞分泌的特异性非胶质蛋白,是体内最丰富的非胶原骨基质蛋白,与骨的形成和生长密切相关[20]。保持正常的胶原代谢是人体内环境稳定的基础,Ⅰ型胶原A1(COL1A1)是维持骨结构和骨生物力学特性的关键部分[21]。在本实验中,我们对OCN和COL1A1进行了RT-PCR检测,结果显示,BMSCs在5代以内,随着代数的增加,OCN和COL1A1基因表达无明显差异,细胞在5代以后,两者的基因表达显著降低。免疫荧光染色检测进一步从蛋白水平表明,BMSCs在5代以内,随着代数的增加,OCN和COL1A1蛋白表达无明显差异,细胞在5代以后,两者的蛋白表达显著降低。
综上所述,本研究证明,BMSCs在5代以内,其细胞形态、增殖能力、早期凋亡率及体外成骨分化能力无明显改变;而5代以后,各项指标均显著降低。因此,我们建议将5代以内的大鼠BMSCs用于实验研究,对细胞增殖、凋亡及成骨分化相关实验结果没有影响。
